Response Mechanism of Lactobacillus plantarum R23 to Sulfur Dioxide Stress
-
摘要:目的 考察植物乳杆菌R23抗氧化酶与膜磷脂脂肪酸等在菌体应答二氧化硫胁迫中的作用机制。方法 以植物乳杆菌R23为试验菌并对其进行梯度二氧化硫胁迫处理,借助扫描电子显微镜观察菌体超微形态,采用酶联免疫法与考马斯亮蓝法检测抗氧化酶活力及丙二醛含量,通过MIDI系统分析细胞膜磷脂脂肪酸结构。结果 二氧化硫胁迫激发了植物乳杆菌R23胞内抗氧化酶(尤其是过氧化氢酶CAT)活力的显著提升,80 mg·L−1二氧化硫胁迫下超氧化物歧化酶SOD、CAT和谷胱甘肽过氧化物酶GPX活力分别是对照处理的1.64、2.14、1.62倍,进而维持了丙二醛MDA较低的增长幅度和基本正常的菌体形态;然而过高二氧化硫(120 mg·L−1)胁迫后,抗氧化酶活力趋于下降,膜脂质过氧化反应加剧,部分菌体细胞表面出现明显皱缩。细胞膜磷脂脂肪酸分析发现,二氧化硫胁迫促使植物乳杆菌R23中饱和、直链、长链和环丙烷脂肪酸总量发生不同程度提升,其中总直链脂肪酸高达52%,且与支链脂肪酸比例从7.15显著提升至9.72。结论 植物乳杆菌R23通过提高抗氧化酶活力或增加饱和、直链、长链以及环丙烷脂肪酸比例,可以降低细胞膜对毒性物质的透过性或清除胞内过量的自由基,从而抵御二氧化硫对菌体细胞的伤害。Abstract:Objective Roles of antioxidase and phospholipid fatty acid (PLFA) play in the response of Lactobacillus plantarum R23 to sulfur dioxide stress were studied.Methods L. plantarum R23 was exposed to a gradient of sulfur dioxide to observe the ultrastructural changes on the bacterium under scanning electron microscopy, determine the antioxidase activity and MDA content by ELISA and coomassie brilliant blue method, and analyze the PLFA composition using MIDI.Results The increasing sulfur dioxide stress induced in L. plantarum R23 a high antioxidase activity, especially CAT. Under 80 mg·L−1 of sulfur dioxide exposure, 1.64-fold rise on SOD activity, 2.14-fold on CAT, and 1.62-fold on GPX were found in the bacteria that afforded a relatively low increasing rate on MDA and maintained a largely intact morphology. However, the imposition of 120 mg·L−1 sulfur dioxide lowered the antioxidase activity and intensified the lipid peroxidation with appearance of wrinkles on the cellular surface. The PLFAs underwent varying degrees of increases on saturated, straight-chain, long-chain, and cyclopropane fatty acids under the stress. The straight-chain fatty acids accounted for 52% of all with a ratio to the branched-chain fatty acids significantly raised from 7.15 to 9.72.Conclusion When L. plantarum R23 encountered sulfur dioxide stress, by increasing the antioxidase activity and/or altering the PLFA composition (especially the saturated, straight-chain, long-chain, and cyclopropane fatty acids) it lowered the cell membrane permeability to deter the invasion of toxic substances or removed the excessive free radicals to prevent and mitigate possible damage.
-
0. 引言
【研究意义】二氧化硫是葡萄酒等果酒酿造中常用的添加剂,具有防止酒体过度氧化、挥发酸含量上升和抑制杂菌生长等作用[1]。但高量的二氧化硫(60 mg·L−1以上)会对酒体中的乳酸菌产生胁迫作用,使其生长受抑制甚至死亡,影响了果酒的苹果酸-乳酸发酵(Malolactic fementation,MLF)生物降酸效果和酒体品质提升[2];而低量的二氧化硫又不能充分发挥作用,从而易导致酒体品质劣变;因此高耐受二氧化硫的MLF乳酸菌的选择备受关注。植物乳杆菌(Lactobacillus plantarum)R23是本试验人员从自然发酵的枇杷酒中分离出的高耐硫、高抗逆性优良MLF乳酸菌,已在山葡萄、枇杷和杨梅等高酸性水果的酿造中广泛应用,成为果酒生物降酸中的重要菌株[3-4]。【前人研究进展】已有研究表明,二氧化硫在液体介质中以HSO3−、SO32−等形式存在,这些离子转化为SO42−的过程会产生活性氧簇(Reactive oxygen species,ROS)如∙O2ˉ、H2O2、∙OH等;持续增加的ROS将作用于细胞内生物大分子进而诱发核酸、蛋白质和脂质等的氧化损伤[5-6]。但同时,生物体会启动氧化防御系统以清除过多的ROS进而维持其正常的生长代谢,即所谓的氧化应激。事实上,强氧化环境均会导致生物体内ROS大量积累,引发生物体氧化应激反应[7],如槲皮素、芦丁等诱发了嗜酸乳杆菌NCFM氧化应激,且主要依靠过氧化氢酶的作用清除胞内自由基[8];另外,在李斯特氏菌的氧化应激反应中,超氧化物歧化酶活性和DNA损伤修复主导了自由基的清除过程[9]。【本研究切入点】推测二氧化硫胁迫可能引发植物乳杆菌R23氧化应激反应,且其抗氧化相关系统发挥了积极作用,但迄今植物乳杆菌R23耐受二氧化硫的应激机制尚不明确。【拟解决的关键问题】本研究从胞内抗氧化酶活力、细胞形态、细胞膜丙二醛和磷脂脂肪酸含量等方面进行探究,明确二氧化硫胁迫下植物乳杆菌R23生理代谢变化,以期揭示植物乳杆菌R23对二氧化硫胁迫的适应性机制。
1. 材料与方法
1.1 试验材料
1.1.1 菌株
植物乳杆菌(Lactobacillus plantarum)R23,由本实验室人员从自然发酵的枇杷酒中分离并保存,NCBI号为HQ58056。
1.1.2 培养基
LHR20液体培养基:酵母膏0.74%,牛肉膏1.0%,蛋白胨0.5%,蔗糖2.0%,柠檬酸铵0.2%,MgSO4 0.036%,MnSO4 0.005%,吐温-80 0.1%,苹果酸钠5.7%(体积分数35%),番茄汁5%,平菇浸汁5%,0.2 mol·L−1 Na2HPO4-0.2 mol·L−1 KH2PO4 缓冲盐稀释4倍,121 ℃湿热灭菌20 min。
1.1.3 主要仪器
SCIENTZ-950E细胞破碎仪(宁波新芝生物科技股份有限公司),SPX-250BS-Ⅱ型生化培养箱(上海新苗医疗器械制造有限公司),SW-CJ-IFD型单人单面净化工作台(苏州净化设备有限公司),TGL-18C型高速冷冻离心机(上海安亭科学仪器厂),GI54DW型高压灭菌器(美国致微),6380LV型扫描电镜(日本电子公司),BioTek Epoch2全波长酶标仪(Bio Tek), UV-1705紫外可见分光光度计(日本岛津),Agilent7890N型气相色谱系统(美国MIDI公司)。
1.1.4 主要试剂
(1)抗氧化酶活力测定及丙二醛含量测定试剂盒(上海起子生物科技有限公司)。(2)磷脂脂肪酸提取试剂。皂化试剂(试剂1):NaOH 45 g + 甲醇(HPLC grade)150 mL+去离子蒸馏水150 mL和甲醇混合后加入NaOH中,同时搅拌至完全溶解;甲基化试剂(试剂2):6.0 mol·L−1盐酸 325 mL+甲醇(HPLC grade)275 mL把盐酸加入到甲醇中,并不断搅拌;萃取试剂(试剂3):正己烷 (HPLC Grade ) 200 mL+MTBE (HPLC Grade ) 200 mL,把MTBE加入到正己烷中,并搅拌均匀;洗涤试剂(试剂4):NaOH 10.8 g+去离子蒸馏水900 mL。
1.2 试验方法
1.2.1 菌种活化
将植物乳杆菌R23甘油冻存种以5%(V/V)接种于LHR20中,30 ℃培养15~18 h,连续转接活化2次,备用。
1.2.2 菌体二氧化硫胁迫培养
将植物乳杆菌R23活化种以体积分数为5%接种于二氧化硫质量浓度分别为0、40、80、120 mg·L−1的 LHR20液体培养基中,30 ℃恒温静置培养4 h后,备用。
1.2.3 菌体处理与形态观察
取1 mL不同质量浓度二氧化硫胁迫处理后的菌液于1.5 mL无菌离心管中,5000 r·min−1离心3 min,用无菌水洗涤2次后,用适量2.5%戊二醛(pH 7.0)固定,后续制样、扫描电镜观察均在福建省农业科学院农业质量标准与检测技术研究所进行。
1.2.4 抗氧化酶活力测定样品制备
取50 mL不同质量浓度二氧化硫胁迫处理的植物乳杆菌R23菌悬液,以9000 r·min−1、4 ℃离心10 min,弃上清;加无菌生理盐水洗涤1次;菌泥中加入5 mL PBS(pH8.0)缓冲液,加玻璃珠旋涡震荡混匀;然后进行超声破碎,条件为:功率400 W、工作总时间5 min、工作1 s、间歇2 s、变幅杆直径5 mm;细胞破碎液经12000 r·min−1、4 ℃离心10 min;将上清液装于10 mL离心管,4 ℃暂存,备用。
1.2.5 蛋白质含量测定
采用考马斯亮蓝法。标准曲线的制作:取6支具塞试管,编号,按表1加入试剂,摇匀,反应10 min,于595 nm处测定吸光度。
表 1 蛋白质含量测定标准曲线Table 1. Standard curve for protein determination试剂
Reagent管号
Tube No.1 2 3 4 5 6 蛋白质标准液
Standard solution of protein/mL0 0.2 0.4 0.6 0.8 1.0 蒸馏水
Distilled water/mL1.0 0.8 0.6 0.4 0.2 0 考马斯亮蓝G-250试剂
Coomassie brilliant blue G-250 reagent/mL5 5 5 5 5 5 样品测定:取样品溶液0.1 mL于试管中,加水0.9 mL,各加入5 mL考马斯亮蓝试剂,充分混合,放置10 min,以试剂空白为对照,595 nm处测定吸光值,同时做3个重复。
1.2.6 酶活力及丙二醛含量测定
超氧化物歧化酶SOD、谷胱甘肽过氧化物酶GPX、过氧化氢酶CAT活力及丙二醛MDA含量的测定,采用试剂盒法,具体操作按照说明书进行。
1.2.7 细胞膜脂肪酸提取
(1)获菌:取植物乳杆菌R23胁迫前、后(分别用0、80 mg·L−1二氧化硫处理)的菌液20 mL,4 ℃、5000 r·min−1,离心5 min,用接种环挑取约40 mg湿重的菌落置于清洁干燥的有螺旋盖的试管(13 mm × 100 mm)底部;(2)皂化:在装有菌体的试管内加入(1.0±0.1)mL试剂1,锁紧盖子,震荡试管5~10 s,95~100 ℃水浴5 min,从沸水中移开试管并轻微冷却,震荡5~10 s,再水浴25 min,取出室温冷却;(3)甲基化:加入(2.0±0.1)mL试剂2,拧紧盖子,震荡5~10 s,80 ℃水浴10 min,移开且快速用流动自来水冷却至室温;(4)萃取:加入(1.25±0.1)mL 试剂3萃取溶剂,盖紧盖子,温和混合旋转10 min ,打开管盖,利用干净的移液管取出下层似水部分,弃去;(5)基本洗涤:加入(3.0±0.21)mL试剂4,拧紧盖子,温和混合旋转5 min,打开盖子,利用干净的移液管移出约2/3体积的上层有机相到干净的GC检体小瓶。
1.2.8 脂肪酸检测
应用MIDI系统,色谱分析柱温采用二阶顺序升温法,即第一阶段170 ℃起始,每分钟升温5 ℃,升至260 ℃,第二阶段每分钟升温40 ℃,升至310 ℃,维持90 s;汽化室温度250 ℃、检测器温度300 ℃;载气为氢气(2 mL·min−1)、尾吹气为氮气(30 mL∙min−1);柱前压68.95 kPa;进样量1 μL,进样分流比100∶1。将检测出的脂肪酸数据转换成以乳酸菌为样本、以脂肪酸生物标记为指标的数据矩阵Excel文件,然后利用生物统计软件SPSS 23.0中的Graphs进行分析。
2. 结果与分析
2.1 二氧化硫胁迫激发的菌体抗氧化防御反应
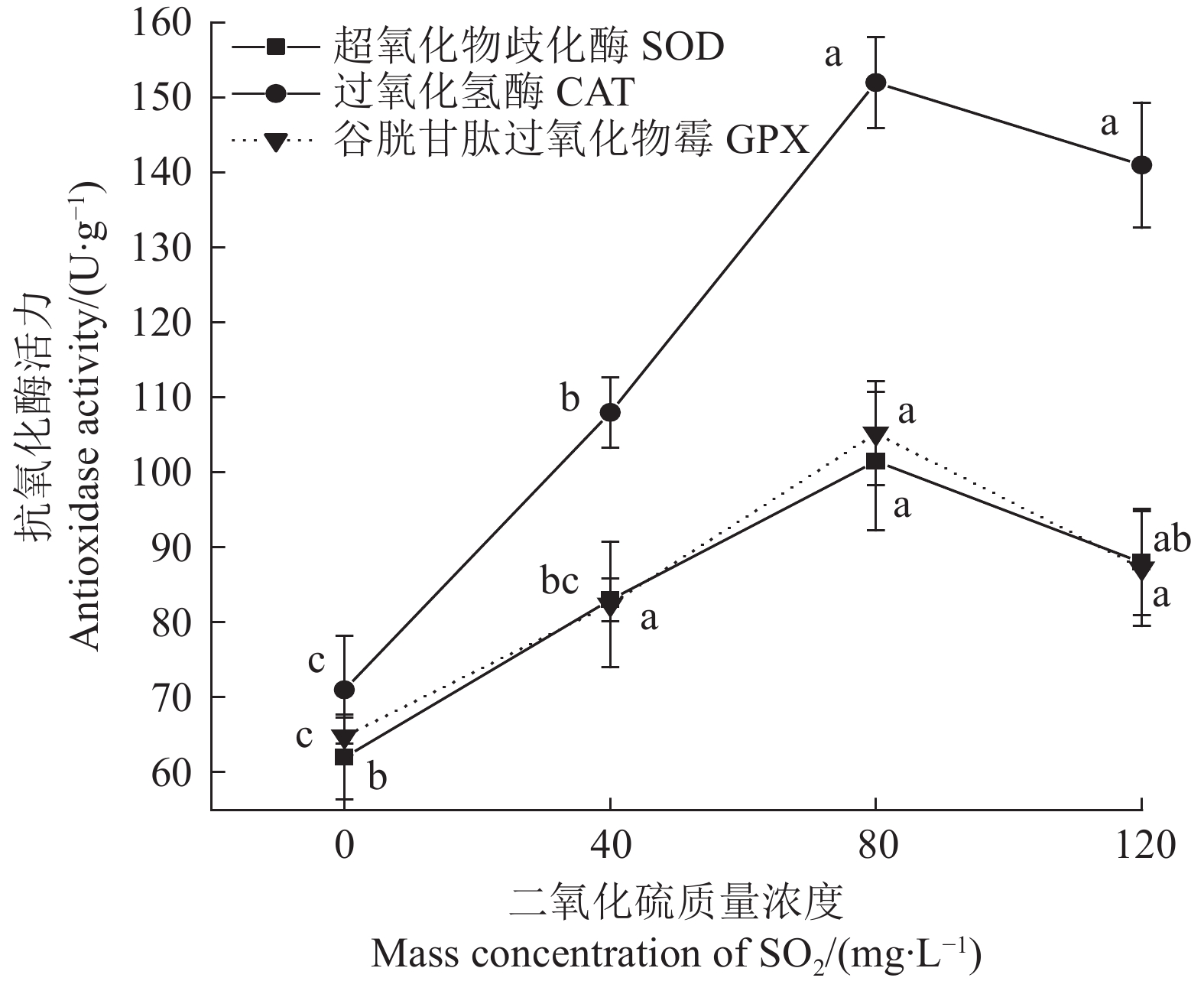
植物乳杆菌R23在梯度二氧化硫胁迫处理条件下的胞内抗氧化酶活力、膜丙二醛含量和超微形态变化如图1、图2和图3所示。以正常培养条件为对照,二氧化硫胁迫处理后3种抗氧化酶活力均显著提升(P < 0.05),其中80 mg·L−1 二氧化硫胁迫下SOD、CAT、GPX分别是无胁迫处理的1.64、2.14、1.62倍,特别是CAT活力提升速率最快且后续下降幅度最小,提示适量二氧化硫胁迫可有效激发植物乳杆菌R23的抗氧化系统,而CAT可能起了主导作用。当胁迫二氧化硫质量浓度增大到120 mg·L−1时,酶活力略有下降但与最高值无显著差异,且显著高于对照值(P<0.05)(图1)。
![]() 图 1 梯度二氧化硫胁迫下植物乳杆菌R23胞内抗氧化酶活力小写字母表示梯度二氧化硫质量浓度胁迫后菌体抗氧化酶活性差异显著(P<0.05)。Figure 1. Intracellular antioxidase activity of L. plantarum R23 under gradient of SO2 stressData with different lowercase letters represent significant differences on antioxidase activity of L. plantarum R23 treated by gradient of SO2 at P<0.05
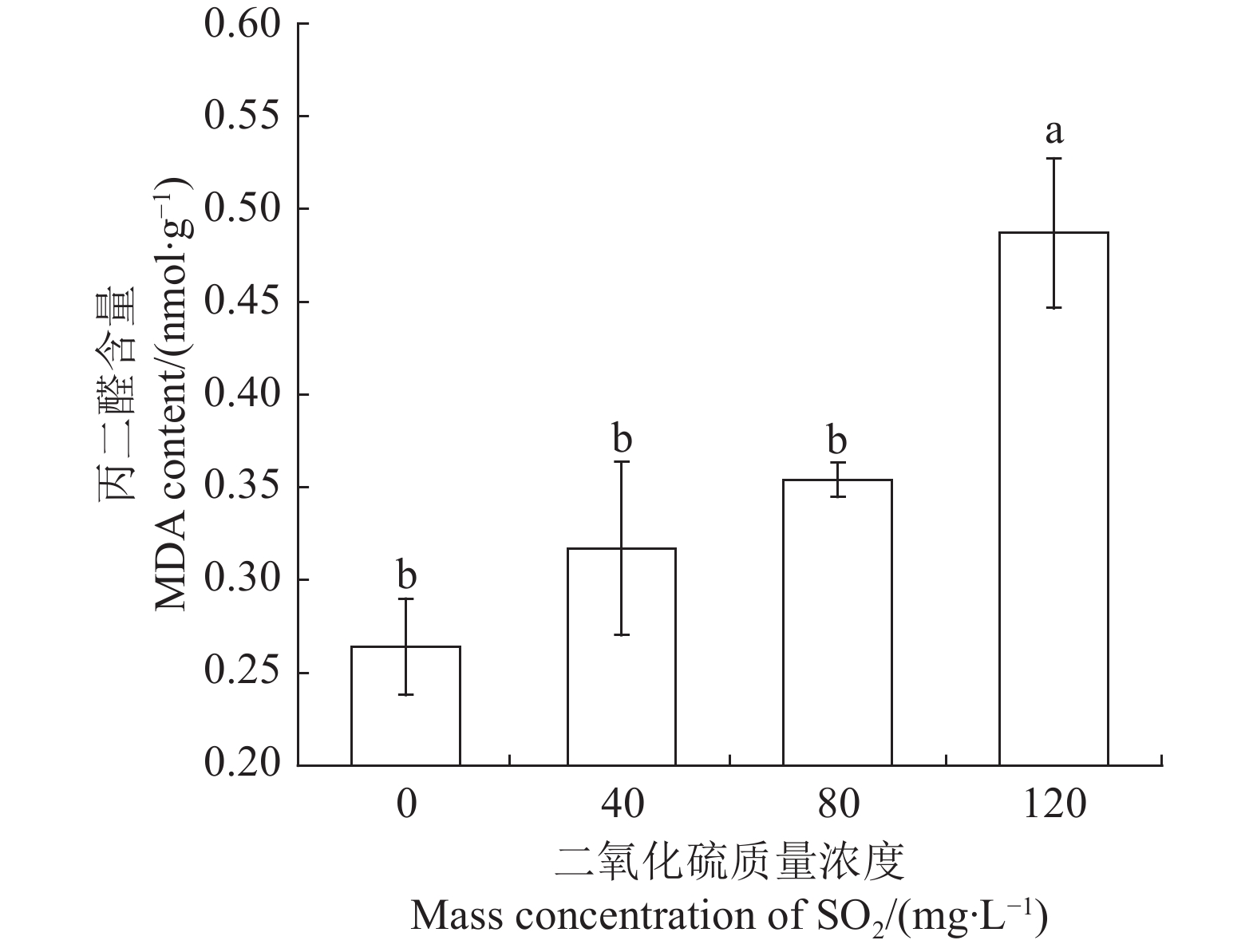
图 1 梯度二氧化硫胁迫下植物乳杆菌R23胞内抗氧化酶活力小写字母表示梯度二氧化硫质量浓度胁迫后菌体抗氧化酶活性差异显著(P<0.05)。Figure 1. Intracellular antioxidase activity of L. plantarum R23 under gradient of SO2 stressData with different lowercase letters represent significant differences on antioxidase activity of L. plantarum R23 treated by gradient of SO2 at P<0.05图2显示,梯度二氧化硫胁迫导致MDA含量不断增加;其中40或80 mg·L−1二氧化硫胁迫下MDA变化幅度较小,之后加速上升 (P <0.05),在120 mg·L−1 二氧化硫胁迫下MDA含量是对照处理的1.84倍;说明抗氧化酶活力下降后胞内ROS不能得到有效清除,进而导致菌体脂质过氧化反应加剧。
植物乳杆菌R23在不同质量浓度二氧化硫胁迫下的菌体细胞超微形态如图3所示。正常培养条件下(0 mg·L−1二氧化硫),菌体饱满,呈杆状、单个或短链状排列,不生孢(图3-a);40 mg·L−1二氧化硫胁迫并未导致菌体形态发生肉眼看见的变化(图3-b);但胁迫程度进一步加深后,有些菌体表面发生皱缩现象,细胞失去原有的饱满程度(图3-c、d),其中120 mg·L−1二氧化硫胁迫下这一变化更加明显。可见80 mg·L−1 SO2胁迫下菌体尚可维持基本的形态,而120 mg·L−1二氧化硫胁迫虽未导致抗氧化酶活力显著下降,但其防御性能下降,这不仅表现在MDA含量显著提升,也表现在菌体形态的变化上。
2.2 二氧化硫胁迫诱导的细胞膜磷脂脂肪酸变化
上述研究结果表明,80 mg·L−1二氧化硫胁迫可有效激发植物乳杆菌R23生理应答,且未导致明显的结构损伤,因此考察了该浓度胁迫下菌体细胞膜磷脂脂肪酸的结构变化,结果如表2和图4所示。无胁迫时菌体细胞膜脂肪酸的组成成分包括饱和脂肪酸即十四烷酸(C14:0)、十六烷酸(C16:0)、十八烷酸(C18:0)、十二碳异脂肪酸(iso-C12:0)、十七碳前异脂肪酸(anteiso-C17:0),单不饱和脂肪酸即十六碳异脂肪酸(iso-C16:1)、十六碳顺式脂肪酸(iso-C16:1)和十九碳反式脂肪酸(trans-C19:1),以及环丙烷脂肪酸(cyclo-19:0)。其中C14:0、C16:0、C18:0和cyclo-19:0含量之和超过57.2%,占总脂肪酸的比例较大,特别是C16:0占总量的27%以上,应为植物乳杆菌R23脂肪酸主要组成成分。胁迫条件下,菌体脂肪酸发生不同程度变化,其中饱和脂肪酸即十四碳异脂肪酸(iso-C14:0)、十五碳异脂肪酸(iso-C15:0)和十八碳顺式单不饱和脂肪酸(cis-C18:1)从无到有,而iso-C16:1、anteiso-C17:0从有到无。说明二氧化硫胁迫不仅导致菌体脂肪酸含量发生变化,也调整了脂肪酸的组成成分。
表 2 不同二氧化硫胁迫下植物乳杆菌R23细胞膜磷脂脂肪酸相对含量Table 2. Relative contents of PLFA in L. plantarum R23 under SO2 stress磷脂脂肪酸
PLFA磷脂脂肪酸相对含量
Relative amount of PLFA/%胁迫前
Before stress胁迫后
After stress十二碳异脂肪酸 12:0 iso 1.36±0.08 2.45±0.11 十四烷酸 14:0 7.34±0.21 3.36±0.31 十四碳异脂肪酸 14:0 iso 0 1.92±0.18 十五碳异脂肪酸 15:0 iso 0 0.98±0.04 十六碳异脂肪酸 16:1 iso 3.99±0.18 0 十六碳顺式单不饱和脂肪酸 16:1 cis 3.19±0.55 2.87±0.65 十六烷酸 16:0 27.77±1.29 30.10±1.20 十七碳前异脂肪酸 17:0 anteiso 1.55±0.10 0 Sum In Feature 8 7.35±0.23 12.05±0.92 Sum In Feature 9 18.67±0.11 8.14±0.96 十八烷酸 18:0 8.65±0.59 10.92±0.17 十八碳顺式单不饱和脂肪酸 18:1 cis 0 2.46±0.20 十九碳反式脂肪酸 19:1 trans 2.41±0.16 2.29±0.40 Sum In Feature 11 4.28±0.03 7.80±0.08 环丙烷脂肪酸 19:0 cyclo 13.44±0.31 14.66±0.34 ![]() 图 4 二氧化硫对植物乳杆菌R23细胞膜磷脂脂肪酸相对含量的影响a、b、c、d分别表示二氧化硫胁迫导致的总饱和脂肪酸与总不饱和脂肪酸、总长链脂肪酸与总短链脂肪酸、总直链脂肪酸与总支链脂肪酸、总顺式脂肪酸与总反式脂肪酸的变化;“*”表示两者间的差异显著(P < 0.05)。Figure 4. Effect of SO2 on relative contents of PLFA in L. plantarum R23a, b, c, and d: changes caused by SO2 stress on saturated (Sa-), unsaturated (Us-), long-chain (L-), short-chain (S-), straight-chain (Sc-), branched-chain (Bc-), cis (Cis-), and trans fatty acids (Trans-) PLFAs. “*” indicates significant difference at P<0.05.
图 4 二氧化硫对植物乳杆菌R23细胞膜磷脂脂肪酸相对含量的影响a、b、c、d分别表示二氧化硫胁迫导致的总饱和脂肪酸与总不饱和脂肪酸、总长链脂肪酸与总短链脂肪酸、总直链脂肪酸与总支链脂肪酸、总顺式脂肪酸与总反式脂肪酸的变化;“*”表示两者间的差异显著(P < 0.05)。Figure 4. Effect of SO2 on relative contents of PLFA in L. plantarum R23a, b, c, and d: changes caused by SO2 stress on saturated (Sa-), unsaturated (Us-), long-chain (L-), short-chain (S-), straight-chain (Sc-), branched-chain (Bc-), cis (Cis-), and trans fatty acids (Trans-) PLFAs. “*” indicates significant difference at P<0.05.对不同类型脂肪酸的统计分析发现,二氧化硫胁迫后菌体总饱和脂肪酸含量上升,总不饱和脂肪酸含量下降(图4-a),两者比值提高1.75,即二氧化硫胁迫导致菌体膜脂肪酸饱和程度增加。类似的,二氧化硫胁迫导致了总直链脂肪酸提升(从49.36%升至52.0%),而总支链脂肪酸显著下降(从6.90%降至5.35%,P<0.05),总体直链/支链比值显著提升(从7.15升至9.72,P<0.05);值得注意的是,支链脂肪酸中的异脂肪酸虽未发生变化,但前异脂肪酸从1.55%降低为0,因此,总体异脂肪酸和前异脂肪酸的比值增大(图4-c)。另外,顺式/反式脂肪酸的比值也从1.33显著提升到2.33(P<0.05)(图4-d)。不同的是,菌体长链脂肪酸和短链脂肪酸在二氧化硫胁迫后的相对含量均有微量提升,但长链脂肪酸的增加幅度更大,因此总体上长链/短链的比值提升0.12(图4-b)。另外还可以发现,作为植物乳杆菌R23脂肪酸主要组成成分之一的环丙烷脂肪酸cyclo-C19:0,在胁迫处理后其相对含量也得以提升,提示其在该菌体耐受二氧化硫胁迫过程中发挥了一定的作用。从整体变化趋势分析,二氧化硫胁迫后植物乳杆菌R23膜脂肪酸成分向着饱和、长链、直链和环型调整。
3. 讨论与结论
3.1 抗氧化酶应激酶系对二氧化硫胁迫的响应
微生物体会启动自身应激机制以抵御各种逆境胁迫等不利条件,如产生特殊保护功能的蛋白[10]、改变细胞膜流动性[11-12]等,从而维持菌体正常的生长代谢和功能;本研究则发现植物乳杆菌R23通过提高抗氧化酶活力、调节细胞膜脂肪酸结构的方式来应对二氧化硫胁迫。已有研究发现,在生物体氧化应激反应中SOD、GPX和CAT是清除ROS的重要抗氧化酶类 [13],如将sod基因进行外源表达后,可明显提高乳杆菌的抗氧化能力[14];而发酵乳杆菌ME-3中的谷胱甘肽过化物酶和谷胱甘肽还原酶,可以从环境中运输及合成谷胱甘肽来参与抗氧化反应[15]。本研究植物乳杆菌R23抗氧化酶活力的显著提升表明该菌也启动了氧化应激反应,且其抗氧化系统整体呈现一个主动防御到被破坏的趋势。起始阶段,随着胁迫程度增大,SOD、GPX和CAT活性明显提高(P<0.05),以清除胞内过量的∙O2ˉ、H2O2、∙OH;但当二氧化硫质量浓度超过菌体耐受阈值时,各酶活力开始下降,MDA含量上升幅度加大。这揭示了过高二氧化硫胁迫会导致菌体抗氧化系统失调,使得胞内自由基产生和清除失去动态平衡,过量自由基与细胞膜中的脂肪酸等物质发生脂质过氧化反应,进而引起细胞膜流动性或通透性改变,促使胞内离子和其他电解质及可溶性物质大量外渗,破坏了细胞内酶及代谢作用原有的区域性,最终导致细胞皱缩甚至破裂。因此,抗氧化酶活性对菌体细胞应对氧化损伤起到至关重要的作用。
3.2 细胞膜对二氧化硫胁迫的响应
细胞膜是把菌体细胞与外界环境隔离的第一道屏障,也是逆境因子生理胁迫的首要目标之一,因此在维持胞内微环境的稳定性等方面发挥极其重要的作用[16]。一般认为,细胞膜的生化特性很大程度上取决于组成磷脂的脂肪酸结构[17]。本研究借助MIDI系统对二氧化硫胁迫前后植物乳杆菌R23膜脂肪酸测定结果发现,胁迫后菌体脂肪酸成分及比例均发生变化,整体向着饱和、长链、直链和环型增长,其中直链/支链、顺式/反式的比值显著提升(P<0.05)。由于总直链脂肪酸占比较高(50%以上),因此推断直链(尤其是C16:0)与支链的比例在植物乳杆菌R23防御二氧化硫胁迫中起主导作用。虽然本研究中菌体总饱和脂肪酸和长链脂肪酸含量增加不显著,但其占比也较大,所以认为它们同样发挥了积极作用。另有研究认为,不同类型脂肪酸的比例均会对细胞膜的流动性产生影响[18],其中支链脂肪酸(尤其是前异脂肪酸)中的甲基会破坏酰基链的紧凑性[19],降低膜流动性;如单增李斯特菌依靠增加直链脂肪酸同时降低前异脂肪酸C15:0、C17:0来适应酸性环境[20],而本研究中总支链脂肪酸增加以及前异脂肪酸anteiso-C17:0显著降低(P<0.05)应是植物乳杆菌R23应对二氧化硫胁迫的又一适应性调节方式。另外,长链饱和脂肪酸可以增加磷脂双分子层间酰基链的相互作用力,使其结构更为牢固且具有较高的相变温度和较低的渗透性[17];因此植物乳杆菌R23对长链/短链、饱和/不饱和脂肪酸的调整,可以降低细胞膜对HSO3−、SO32−等的透过性,从而防止ROS大量产生。另外,由于不饱和脂肪酸的氢键易被ROS氧化,本研究中其含量降低可以减弱膜脂对过氧化作用的敏感性。然而,目前关于不同类型脂肪酸在菌株抵御逆境胁迫中的作用并未取得一致观点。如:郑昀昀等[21]在新物种Anoxybacillus flavithermus ssp. Yunnanesis E13T对甲苯的耐受性,以及Huang 等[11]对植物乳杆菌ZDY2013 对酸的耐受性研究中,均证实饱和脂肪酸发挥了积极作用,与本研究结果相一致;而Taranto等[22]在罗伊氏乳杆菌耐胆盐、袁峥[23]在嗜酸乳杆菌耐酸的相关研究中发现,不饱和脂肪酸比例增加对菌体耐受性更有利;由此可见,不同特性的菌株或不同因子胁迫下其耐受性机制也不尽相同。
综上,本研究发现了植物乳杆菌R23抗氧化酶、膜磷脂脂肪酸等在其应答二氧化硫引发的氧化应激中的作用,可初步阐明该菌对二氧化硫胁迫的适应性生理机制,为深入理解该菌抵抗高二氧化硫环境而生存的分子机制提供理论依据,同时为筛选高抗逆性菌株以解决目前高酸性果酒降酸中存在的问题提供思路。
-
图 1 梯度二氧化硫胁迫下植物乳杆菌R23胞内抗氧化酶活力
小写字母表示梯度二氧化硫质量浓度胁迫后菌体抗氧化酶活性差异显著(P<0.05)。
Figure 1. Intracellular antioxidase activity of L. plantarum R23 under gradient of SO2 stress
Data with different lowercase letters represent significant differences on antioxidase activity of L. plantarum R23 treated by gradient of SO2 at P<0.05
图 4 二氧化硫对植物乳杆菌R23细胞膜磷脂脂肪酸相对含量的影响
a、b、c、d分别表示二氧化硫胁迫导致的总饱和脂肪酸与总不饱和脂肪酸、总长链脂肪酸与总短链脂肪酸、总直链脂肪酸与总支链脂肪酸、总顺式脂肪酸与总反式脂肪酸的变化;“*”表示两者间的差异显著(P < 0.05)。
Figure 4. Effect of SO2 on relative contents of PLFA in L. plantarum R23
a, b, c, and d: changes caused by SO2 stress on saturated (Sa-), unsaturated (Us-), long-chain (L-), short-chain (S-), straight-chain (Sc-), branched-chain (Bc-), cis (Cis-), and trans fatty acids (Trans-) PLFAs. “*” indicates significant difference at P<0.05.
表 1 蛋白质含量测定标准曲线
Table 1 Standard curve for protein determination
试剂
Reagent管号
Tube No.1 2 3 4 5 6 蛋白质标准液
Standard solution of protein/mL0 0.2 0.4 0.6 0.8 1.0 蒸馏水
Distilled water/mL1.0 0.8 0.6 0.4 0.2 0 考马斯亮蓝G-250试剂
Coomassie brilliant blue G-250 reagent/mL5 5 5 5 5 5 表 2 不同二氧化硫胁迫下植物乳杆菌R23细胞膜磷脂脂肪酸相对含量
Table 2 Relative contents of PLFA in L. plantarum R23 under SO2 stress
磷脂脂肪酸
PLFA磷脂脂肪酸相对含量
Relative amount of PLFA/%胁迫前
Before stress胁迫后
After stress十二碳异脂肪酸 12:0 iso 1.36±0.08 2.45±0.11 十四烷酸 14:0 7.34±0.21 3.36±0.31 十四碳异脂肪酸 14:0 iso 0 1.92±0.18 十五碳异脂肪酸 15:0 iso 0 0.98±0.04 十六碳异脂肪酸 16:1 iso 3.99±0.18 0 十六碳顺式单不饱和脂肪酸 16:1 cis 3.19±0.55 2.87±0.65 十六烷酸 16:0 27.77±1.29 30.10±1.20 十七碳前异脂肪酸 17:0 anteiso 1.55±0.10 0 Sum In Feature 8 7.35±0.23 12.05±0.92 Sum In Feature 9 18.67±0.11 8.14±0.96 十八烷酸 18:0 8.65±0.59 10.92±0.17 十八碳顺式单不饱和脂肪酸 18:1 cis 0 2.46±0.20 十九碳反式脂肪酸 19:1 trans 2.41±0.16 2.29±0.40 Sum In Feature 11 4.28±0.03 7.80±0.08 环丙烷脂肪酸 19:0 cyclo 13.44±0.31 14.66±0.34 -
[1] FERNÁNDEZ-PÉREZ R, TENORIO RODRÍGUEZ C, RUIZ-LARREA F. Fluorescence microscopy to monitor wine malolactic fermentation [J]. Food Chemistry, 2019, 274: 228−233. DOI: 10.1016/j.foodchem.2018.08.088
[2] JIANG J, SUMBY K M, SUNDSTROM J F, et al. Directed evolution of Oenococcus oeni strains for more efficient malolactic fermentation in a multi-stressor wine environment [J]. Food Microbiology, 2018, 73: 150−159. DOI: 10.1016/j.fm.2018.01.005
[3] LIN X Z, HE Z G, LI W X, et al. Validation of reference genes for real-time quantitative polymerase chain reaction analysis in Lactobacillus plantarum R23 under sulfur dioxide stress conditions [J]. Australian Journal of Grape and Wine Research, 2018, 24(3): 390−395. DOI: 10.1111/ajgw.12331
[4] 李维新, 何志刚, 郑宝东, 等. 植物乳杆菌R23产苹果酸乳酸酶特性研究 [J]. 中国食品学报, 2012, 12(5):35−40. DOI: 10.3969/j.issn.1009-7848.2012.05.006 LI W X, HE Z G, ZHENG B D, et al. Studies on characteristics of Lactobacillus plantarum R23 in producing malolactic enzyme [J]. Journal of Chinese Institute of Food Science and Technology, 2012, 12(5): 35−40.(in Chinese) DOI: 10.3969/j.issn.1009-7848.2012.05.006
[5] YI H L, LIU J, ZHENG K. Effect of sulfur dioxide hydrates on cell cycle, sister chromatid exchange, and micronuclei in barley [J]. Ecotoxicology and Environmental Safety, 2005, 62(3): 421−426. DOI: 10.1016/j.ecoenv.2004.11.005
[6] JIANG C M, SHI J L, CHEN X Q, et al. Effect of sulfur dioxide and ethanol concentration on fungal profile and ochratoxin a production by Aspergillus carbonarius during wine making [J]. Food Control, 2015, 47: 656−663. DOI: 10.1016/j.foodcont.2014.08.011
[7] LINLEY E, DENYER S P, MCDONNELL G, et al. Use of hydrogen peroxide as a biocide: New consideration of its mechanisms of biocidal action [J]. Journal of Antimicrobial Chemotherapy, 2012, 67(7): 1589−1596. DOI: 10.1093/jac/dks129
[8] HOUGAARD A B, PINDSTRUP H, ARNEBORG N, et al. Free radical formation by Lactobacillus acidophilus NCFM is enhanced by antioxidants and decreased by catalase [J]. Food Research International, 2016, 79: 81−87. DOI: 10.1016/j.foodres.2015.12.003
[9] HUANG Y Y, MORVAY A A, SHI X M, et al. Comparison of oxidative stress response and biofilm formation of Listeria monocytogenes serotypes 4b and 1/2a [J]. Food Control, 2018, 85: 416−422. DOI: 10.1016/j.foodcont.2017.10.007
[10] FIOCCO D, CAPOZZI V, GOFFIN P, et al. Improved adaptation to heat, cold, and solvent tolerance in Lactobacillus plantarum [J]. Applied Microbiology and Biotechnology, 2007, 77(4): 909−915. DOI: 10.1007/s00253-007-1228-x
[11] HUANG R H, PAN M F, WAN C X, et al. Physiological and transcriptional responses and cross protection of Lactobacillus plantarum ZDY2013 under acid stress [J]. Journal of Dairy Science, 2016, 99(2): 1002−1010. DOI: 10.3168/jds.2015-9993
[12] BROADBENT J R, LARSEN R L, DEIBEL V, et al. Physiological and transcriptional response of Lactobacillus casei ATCC 334 to acid stress [J]. Journal of Bacteriology, 2010, 192(9): 2445−2458. DOI: 10.1128/JB.01618-09
[13] 蔡秋杏, 吴燕燕, 李来好, 等. 来源于腌干鱼的乳酸菌中抗氧化酶及胞外多糖研究 [J]. 水产学报, 2017, 41(6):952−961. CAI Q X, WU Y Y, LI L H, et al. Study on antioxidant enzymes and exopolysaccharides of lactic acid bacteria separated from salt-dried fish products [J]. Journal of Fisheries of China, 2017, 41(6): 952−961.(in Chinese)
[14] LIN J Z, ZOU Y X, CAO K L, et al. The impact of heterologous catalase expression and superoxide dismutase overexpression on enhancing the oxidative resistance in Lactobacillus casei [J]. Journal of Industrial Microbiology & Biotechnology, 2016, 43(5): 703−711.
[15] KULLISAAR T, SONGISEPP E, AUNAPUU M, et al. Complete glutathione system in probiotic Lactobacillus fermentum ME-3 [J]. Prikladnaia Biokhimiia i Mikrobiologiia, 2010, 46(5): 527−531.
[16] MONTANARI C, SADO KAMDEM S L, SERRAZANETTI D I, et al. Synthesis of cyclopropane fatty acids in Lactobacillus helveticus and Lactobacillus sanfranciscensis and their cellular fatty acids changes following short term acid and cold stresses [J]. Food Microbiology, 2010, 27(4): 493−502. DOI: 10.1016/j.fm.2009.12.003
[17] 张一敏. 三种有机酸对单增李斯特菌诱导性耐酸响应研究[D]. 泰安: 山东农业大学, 2014 ZHANG Y M. Adaption to three types of organic acid induces resistance to acid in Listeria monocytogenes[D]. Taian: Shandong Agricultural University, 2014. (in Chinese)
[18] GIOTIS E S, MCDOWELL D A, BLAIR I S, et al. Role of branched-chain fatty acids in pH stress tolerance in Listeria monocytogenes [J]. Applied and Environmental Microbiology, 2007, 73(3): 997−1001. DOI: 10.1128/AEM.00865-06
[19] ZHANG Y M, ROCK C O. Membrane lipid homeostasis in bacteria [J]. Nature Reviews Microbiology, 2008, 6(3): 222−233. DOI: 10.1038/nrmicro1839
[20] MASTRONICOLIS S K, BERBERI A, DIAKOGIANNIS I, et al. Alteration of the phospho- or neutral lipid content and fatty acid composition in Listeria monocytogenes due to acid adaptation mechanisms for hydrochloric, acetic and lactic acids at pH 5.5 or benzoic acid at neutral pH [J]. Antonie Van Leeuwenhoek, 2010, 98(3): 307−316. DOI: 10.1007/s10482-010-9439-z
[21] 郑昀昀, 陈茂娇, 王敏, 等. 甲苯胁迫下有机溶剂耐受菌Anoxybacillus flavithermus ssp. yunnanesis E13T膜脂肪酸的变化 [J]. 微生物学报, 2015, 55(6):719−724. ZHENG Y Y, CHEN M J, WANG M, et al. Adaptation of Anoxybacillus flavithermus ssp. yunnanesis E13T to toluene at the level of fatty acid composition of membrane [J]. Acta Microbiologica Sinica, 2015, 55(6): 719−724.(in Chinese)
[22] TARANTO M P, FERNANDEZ MURGA M L, LORCA G, et al. Bile salts and cholesterol induce changes in the lipid cell membrane of Lactobacillus reuteri [J]. Journal of Applied Microbiology, 2003, 95(1): 86−91. DOI: 10.1046/j.1365-2672.2003.01962.x
[23] 袁峥. 嗜酸乳杆菌耐酸机理研究[D]. 新乡: 河南科技学院, 2013 YUAN Z. Study on the acid tolerance-mechanism of Lactobacillus acidophilus[D]. Xinxiang: Henan Institute of Science and Technology, 2013. (in Chinese)




 下载:
下载: