Identification and Functions of ACY1 Family in Polygonatum cyrtonema
-
摘要:目的 筛选鉴定多花黄精中氨基酰化酶(aminoacylase 1,ACY1)基因,为多花黄精抗逆基因功能研究奠定基础。方法 基于多花黄精转录组数据,对多花黄精氨基酰化酶(PcACY1)基因家族进行鉴定,分析基本理化性质、基因结构、保守基序、进化关系等,并采用qRT-PCR验证ACY1家族成员在不同组织器官中和盐胁迫处理下的表达模式。结果 多花黄精ACY1家族有2个成员,均为亲水蛋白,具有信号肽,无跨膜结构,亚细胞定位预测结果显示2个成员均定位于细胞质中。与植物其他物种ACY1构建进化树发现,其进化特性可分为2类。植物ACY1启动子顺式作用元件预测结果显示,ACY1存在多种激素、胁迫和生长发育相关的响应元件。qRT-PCR分析结果显示,PcACY1成员在多花黄精不同组织器官中的表达水平差异较大且受盐胁迫诱导。结论 PcACY1在多花黄精生长发育和抵御逆境过程中可能发挥重要作用,这为进一步研究多花黄精ACY1的功能及遗传改良等奠定基础。Abstract:Objective Family of aminoacylase 1 genes (ACY1) in Polygonatum cyrtonema Hua was identified, and associated resistance functions analyzed.Methods Based on the transcriptome data, the family of P. cyrtonema Hua aminoacylase genes (PcACY1) was identified. Physicochemical properties, structure, conserved motifs, and evolutionary relationships of the members were analyzed. Expressions of PcACY1 in tissues/organs and under salt stress were detected by qRT-PCR.Results The PcACY1 family had two members located in the cytoplasm, both of which were hydrophilic proteins with signal peptides and no transmembrane structure. As shown in the phylogenetic tree, they exhibited two categories of evolutionary characteristics. The predicted cis-acting elements of the plant ACY1 promoter indicated the presence of multiple hormone-, stress-, and growth/development-related functions. PcACY1 displayed significantly differentiated expressions in different tissues and organs which could be induced by salt stress.Conclusion PcACY1 appeared to play an important role in the growth and development as well as stress resistance of P. cyrtonema .
-
Keywords:
- Polygonatum cyrtonema Hua /
- ACY1 /
- gene family identification /
- expression analysis
-
0. 引 言
【研究意义】海棠(Malus spp.)是蔷薇科(Rosaceae)苹果属 (Malus Mill.)中果实直径较小(≤5 cm)的落叶乔木或小乔木,我国海棠品种资源丰富,是世界海棠资源分布中心,距今约有2 000年栽培历史[1-3]。海棠在中国传统园林中应用历史悠久,随着育种和栽培技术的提高,目前已经培育出许多具有优良性状的新品种[4-5]。在园林景观中,将具有观叶、观花、观果等多种观赏价值的称为观赏海棠[6]。观赏海棠在我国栽培范围广泛,观赏期长,适应性强,属于维护成本较低的优质绿化树种。近年来,随着保护生态环境意识的增强以及园林景观市场需求量的增大,对木本彩叶植物栽培育种的研究逐渐得到重视。【前人研究进展】目前多采用国内外引种、变异选种、杂交育种等育种途径来获得彩叶植物新品种,对彩叶植物呈色机理的研究以及抗寒性彩叶植物的改良也逐渐成为主流[7-10] 。观赏海棠作为重要的园林造景植物,目前研究主要集中于对花色特征与动态变化[11-13]以及果香、果色时序变化等[14-16]。【本研究切入点】而关于不同叶位叶片色彩与色素组分的分类研究较少。【拟解决的关键问题】以48份观赏海棠种质为试验材料,采用色差仪和光谱仪对不同品种的上、中、下位叶进行色彩参数和色素含量的测定,对该群体的观赏海棠种质进行数字化叶色评价分析体系的建立,为筛选优良观赏海棠种质以及观赏植物叶色品质的改良提供参考依据。
1. 材料与方法
1.1 试验材料
江苏省扬州市(32°42′N,119°55′E),属亚热带季风气候,年降水量达1000 mm,年平均气温 14.9 ℃,最冷月平均气温在0 ℃以上,全年无霜期较长。48份观赏海棠种质主要来源于扬州市海棠国家林木种质资源库选育的新品种(序号1~41)和扬州小苹果园艺有限公司(序号42~48),为实生苗优株的嫁接子代,生长健壮,养护管理条件一致,可用于叶色测定,具体种质名称见表1。
表 1 48份观赏海棠种质种质信息Table 1. Information on 48 sampled ornamental crabapple germplasms序号
Code种质名称
Cultivars品种审定号
Variety validation number序号
Code种质名称
Cultivars品种审定号
Variety validation number1 琉璃盏
M. Liu Lizhan20190169 25 白云
M. Bai Yun20210210 2 红与黑
M. Hong Yuhei20190170 26 橙之梦
M. Cheng Zhimeng20190076 3 云卷云舒
M. Yunjuan Yunshu20190361 27 茶花女
M. Cha Huanv20210208 4 影红秀
M. Ying Hongxiu20190171 28 二乔
M. Er Qiao20210207 5 忆红莲
M. Yi Honglian20190364 29 红晨
M. Hong Chen20210206 6 疏红妆
M. Shu Hongzhuang20190172 30 红粉佳人
M. Hongfen Jiaren20210205 7 棱镜
M. Leng Jing20190168 31 红色经典
M. Hongse Jingdian20210204 8 白羽扇
M. Bai Yushan20190173 32 红云
M. Hong Yun20210203 9 涟漪
M. Lian Yi20190167 33 浪花
M. Lang Hua20210202 10 卷珠帘
M. Juan Zhulian20190363 34 飘
M. Piao20210209 11 依人
M. Yi Ren20190365 35 水袖
M. Shui Xiu20210201 12 洛可可女士
M. Luokeke Nvshi20190080 36 西子姑娘
M. Xizi Guniang20210200 13 胭脂雨
M. Yan Zhiyu20180299 37 夏荷
M. Xia He20210199 14 羊脂玉
M. Yang Zhiyu20190078 38 紫嫣
M. Zi Yan20210198 15 紫蝶儿
M. Zi Dieer20190081 39 红颜
M. Hong Yan20210411 16 红色依恋
M. Hongse Yilian20180296 40 金秋
M. Jin Qiu20210414 17 云想容
M. Yun Xiangrong20190079 41 春花秋月
M. Chunhua Qiuyue20210410 18 粉芭蕾
M. Fen Balei20170082 42 满堂红
M. Man Tanghong20170094 19 画轴
M. Hua Zhou20180298 43 香荷
M. Xiang He20170096 20 烟雨江南
M. Yanyu Jiangnan20190366 44 香云
M. Xiang Yun20160062 21 晚宴
M. Wan Yan20180297 45 昌红
M. Chang Hong20160061 22 粉红霓裳
M. Fenhong Nichang20190077 46 昌辉
M. Chang Hui20160058 23 红珊瑚
M. Hong Shanhu20190367 47 丽辉
M. Li Hui20160060 24 千层金
M. Qian Cengjin20190362 48 蕊沁
M. Rui Qin20160059 1.2 试验方法
于2021年6月上旬天气晴朗的上午7:00–8:00进行叶片采集。由于叶片成熟时颜色和大小已趋于稳定,为使采样更具有客观性且兼顾叶片色彩梯度变化,供试种质的植株皆选择具有代表性、长势相同、性状稳定且无明显病虫害的健康植株,供试叶片皆选自苗木向阳处同一方位的健康叶片,分别按照上、中、下3个叶位进行叶片的采集,其中位于苗干下部、叶片较大的成熟叶为下位叶,位于苗干中部且面积约为成熟叶1/2的叶片为中位叶,苗干新梢完全展开且面积约为成熟叶1/3以下的为上位叶[17-18]。每个叶位各采集5枚健康叶片,采摘后置于便携式冷藏箱带回室内,并在6 h内完成测量。
1.3 试验测定
1.3.1 色彩测定
叶片色彩参数测定采用X-Rite CI64型色差仪(爱色丽CI64,美国)进行测定,色差仪参数设置如下:D65 光源,色斑测量直径8 mm,观测角度10°。测量点为每个叶片上表皮对称的6个点,避开主叶脉,每个叶位重复30次。叶片色彩参数亮度值(L*)、饱和度(C*)、色调角(h°)均由色差仪测量后直接获得。
1.3.2 色素含量测定
叶片色素相对含量测定采用Unispec-SC光谱分析仪(PP System,美国)分别对48份观赏海棠品种上、中、下位叶中花青素(Anth)、类胡萝卜素(Car)和叶绿素(Chl)的反射光谱指标进行测定,每个叶片测量6个点,避开主叶脉,每个叶位重复次数为30次。
各色素相对含量计算公式如下:花青素(Anth)=R800(1/R550−1/R700);类胡萝卜素(Car)=R800(1/R520−1/R700);叶绿素(Chl)=(R750−R445)/(R705−R445)[19-22]。
1.4 数据处理
3D散点图和折线图使用Origin 2021 软件进行绘制,叶色聚类分析图和参数相关性统计使用SPSS 26.0 软件进行处理。
2. 结果与分析
2.1 观赏海棠不同叶位叶色变化规律
48份海棠种质的3个叶位叶色位点多集中于中亮度值区域,在CIELCH色空间中呈现由两端向中间集中的趋势(图1)。其中低亮度值的品种权重(当L*<31时,上、中和下位叶分别为 16.67%、25.00%和 39.58%)呈现逐渐递增趋势,中亮度值的品种权重(当31≤L*<40时,上、中和下位叶分别为58.33%、68.75%和58.32%)呈现先增后减的趋势,而高亮度值(当40≤ L*<50时,上、中和下位叶分别为 25.00%、6.25%和2.08%)的品种权重呈现减小趋势(图2)。
观赏海棠品种群的3个叶位叶色多集中于低色彩饱和度区域,在CIELCH色空间中呈左移趋势(图1)。其中低色彩饱和度的品种权重(当C*<15时,上、中和下位叶分别为54.17%、66.66%、79.17%)呈递增趋势,中色彩饱和度品种权重(当15≤C*<25时,上、中和下位叶分别为25.00%、29.17%和18.75%)呈先增后减趋势,而高色彩饱和度品种权重(当C*≥25时,上、中、下位叶分别为20.83%、4.17%、2.08%)呈减小趋势(图2)。
观赏海棠品种群的上位叶多集中于中色调角区域,中、下位叶位点多集中于高色调角区域,3个叶位在CIELCH色空间中表现为向绿色区域集中的趋势(图1)。其中低色调角品种权重(当h°<100°时,上、中、下位叶分别为35.42%、2.08%、0.00%)逐渐递减趋势,中色调角品种权重(当100°≤h°<120°时,上、中、下位叶分别为41.66%、39.58%、16.67%)呈逐渐递减趋势,高色调角品种权重(当h°≥120°区间,上、中、下位叶分别为22.92%、58.34%、83.33%)呈递增趋势(图2)。
综上表明,48份观赏海棠种质的叶片色彩呈整体性变化,上位叶L*、C*、h°参数位点在CIELCH色空间中最为分散,即幼嫩时期的上位叶色彩表现最为丰富,最具园林观赏价值,而中位叶、下位叶的L*、C*值逐渐下降,h°值呈增大趋势,即叶片颜色随着叶位降低逐渐转化为深绿状态。
2.2 观赏海棠不同叶位叶片色素相对含量的空间变化分布格局
48份观赏海棠种质叶片中的花青素(Anth)、类胡萝卜素(Car)相对含量位点随着叶位下降整体均呈左移(减小)趋势(Anth:上位叶0.01~3.46 mg·g−1,中位叶0~1.53 mg·g−1,下位叶0.01~0.41 mg·g−1;Car:上位叶0.43~3.67 mg·g−1,中位叶0.66~1.84 mg·g−1,下位叶0.73~1.81 mg·g−1)(图3-A)。Anth和Car的权重随着叶位下降整体呈逐渐递减趋势(Anth:上位叶0.47%~38.32%,中位叶0.10%~26.32%,下位叶0.31%~7.98%;Car:上位叶10.18%~43.27%,中位叶11.68%~36.92%,下位叶11.47%~35.04%)(图3-B)。
![]() 图 3 观赏海棠种质不同叶位色素相对含量与权重的空间分布A为观赏海棠种质不同叶位色素相对含量的空间分布,B为观赏海棠种质不同叶位色素权重占比的空间分布。Figure 3. Spatial distribution of relative content and weight of pigments in upper to lower leaf of ornamental crabapple germplasmsA shows the spatial distribution of relative pigment content in different leaf positions of ornamental crabapple germplasms, and B shows the spatial distribution of pigment weight ratio in different leaf positions of ornamental crabapple germplasms.
图 3 观赏海棠种质不同叶位色素相对含量与权重的空间分布A为观赏海棠种质不同叶位色素相对含量的空间分布,B为观赏海棠种质不同叶位色素权重占比的空间分布。Figure 3. Spatial distribution of relative content and weight of pigments in upper to lower leaf of ornamental crabapple germplasmsA shows the spatial distribution of relative pigment content in different leaf positions of ornamental crabapple germplasms, and B shows the spatial distribution of pigment weight ratio in different leaf positions of ornamental crabapple germplasms.观赏海棠种质叶片的叶绿素(Chl)相对含量位点随着叶位下降整体呈现上移(增大)趋势。其中上位叶叶绿素相对含量1.47~5.25 mg·g−1,权重占比21.13%~89.35%;中位叶叶绿素相对含量1.92~5.48 mg·g−1,权重占比41.88%~87.76%;下位叶叶绿素相对含量2.22~5.85 mg·g−1,权重占比56.98%~87.29%(图3-A、B)。
2.3 观赏海棠种质色彩与色素参数统计与聚类分析
基于上位叶为观赏海棠的主要观赏叶位,对上位叶色彩参数(L*、C*、h°)进行聚类分析(图4),将48份观赏海棠种质划分为绿色系(A)、棕色系(B)和红色系(C)3大色系类群,其中,将绿色系又分为亮绿色A1、深绿色A2等2个子色系,红色系又分为红棕色C1和紫红色C2等2个子色系。基于上位叶色彩参数的聚类分析结果对各类群色彩与色素参数进行统计分析,结果见表2。
表 2 各类群色彩与色素参数统计Table 2. Statistics on color measurements and pigment contents of each taxon色系分类
Color category种质数量
Quantity色彩参数
Color parameters色素含量
Pigment parametersL* C* h°/° 花青素Anth/% 类胡萝卜素Car/% 叶绿素Chl/% 花青素/叶绿素Anth/Chl A绿色系
Green32 37.89±5.71 ab 19.46±8.40 ab 115.23±7.73 ab 0.03±0.03 c 0.24±0.08 cd 0.73±0.09 a 0.04±0.06 c A1亮绿色系
Bright green17 42.58±3.29 a 26.09±5.42 a 109.72±6.47 b 0.03±0.04 c 0.28±0.07 bc 0.68±0.09 a 0.06±0.07 c A2深绿色系
Dark green15 32.58±1.74 bc 11.94±2.96 bc 121.47±2.42 a 0.03±0.02 c 0.19±0.06 d 0.78±0.07 a 0.04±0.03 c B棕色系
Brown3 36.78±0.44 b 16.63±3.25 bc 86.27±7.18 c 0.24±0.02 b 0.38±0.00 a 0.38±0.02 b 0.65±0.10 b C 红色系
Red13 31.13±3.27 c 9.51±2.32 c 35.18±11.41 e 0.34±0.03 a 0.37±0.04 ab 0.29±0.05 b 1.19±0.26 a C1红棕色系
Reddish brown10 30.44±3.43 c 9.14±2.32 c 29.74±4.74 e 0.35±0.03 a 0.37±0.03 ab 0.29±0.03 b 1.22±0.24 a C2紫红色系
Red purple3 33.44±0.80 bc 10.77±2.20 c 53.28±6.42 d 0.32±0.03 a 0.37±0.06 ab 0.31±0.08 b 1.09±0.34 a 数值表示为平均值±标准差;同列数据后无相同小写字母表示差异显著(P<0.05)。
Data are presented as mean±standard deviation; data with different lowercase letters on same column indicate significant difference (P<0.05).A类群共32个种质,亮度值L*分布在29.54~48.29,饱和度C*分布在7.89~37.79,色调角h°分布在92.20°~125.94°,花青素与叶绿素相对含量之比属于较低水平(Anth/Chl=0.05±0.06),叶绿素相对含量在3种类群中最高,从而主导叶片颜色呈绿色。其中,A1亮绿色系的亮度和饱和度在所有色系类群中处于最高水平(L*=42.58±3.29,C*=26.09±5.42),色调角位于绿色区域(h°=109.72°±6.47°),包含棱镜、白羽扇、卷珠帘、胭脂雨、紫蝶儿、橙之梦、云想容、茶花女等17个品种。A2深绿色系的亮度和饱和度均低于A1类群(L*=32.58±1.74,C*=11.94±2.96),饱和度在所有色系类群中处于最高水平(h°=121.47°±2.42°),在3种色素相对含量中,叶绿素相对含量最高,叶片绿色特征更显著,Anth/Chl的值较A1类群低(Anth/Chl=0.04±0.03),包含涟漪、羊脂玉、粉芭蕾、影红秀、红珊瑚、白云等15个品种。
B类群共3个种质,亮度、饱和度和色调角较C类群高(L*=36.78±0.44,C*=16.63±3.25,h°=86.27°±7.18°),Anth/Chl的值在所有类群中属于中等水平(Anth/Chl=0.65±0.10),花青素相对含量高于A类群所有品种,类胡萝卜素相对含量在所有类群中处于最高水平,色调角接近于黄色区域,包含依人、红色依恋、画轴3个品种。
C类群共13个种质,亮度值L*分布在26.76~36.12,饱和度C*分布在4.83~12.75,色调角h°分布在20.56°~57.68°,花青素相对含量最高,Anth/Chl的值较A、B类群高(Anth/Chl=1.19±0.26),使得该类群叶片颜色呈红色。C1红棕色系,色彩参数值在所有类群中最低(L*=30.44±3.43,C*=9.14±2.32,h°=29.74°±4.74°),Anth/Chl的值在所有类群中最高(Anth/Chl=1.22±0.24),红色属性最明显,包含洛可可女士、琉璃盏、香云、红与黑、疏红妆等10个品种。C2紫红色系,亮度和饱和度较A、B类群低(L*=33.44±0.80,C*=10.77±2.20),色调角较C1类群高(h°=53.28°±6.42°),包含云卷云舒、忆红莲、红色经典3个品种。
3. 讨论与结论
3.1 观赏植物叶色变化机制
植物色彩搭配是园林造景中的重要内容,同时也带给人们最直接的视觉和心理感受,它直接影响着造园呈现效果的好坏。随着木本彩叶植物市场需求量的增大,探究观赏植物叶色变化机制,挖掘和培育出具有更多优良性状的彩叶观赏植物已经成为当下林木育种的重要工作内容。叶片颜色呈现不同主要是内在遗传和外部环境共同作用的结果,是叶片中多种色素作用下产生的综合效应,叶片中的主要色素相对含量的占比以及对光线的吸收程度导致了叶片呈色的不同[23]。在吴飞洋等[24]的研究中发现,乌桕在中度水分胁迫下叶片中叶绿素降解量和花色素苷合成量最多,叶片颜色更加鲜艳,红色效果更显著。低温环境可以促进紫叶李、鸡爪槭等彩叶植物体内pH值的变化和叶片中花青素等色素组分的合成,从而影响叶片的显色效果[25-26]。
目前多采用RHSCC比色卡对植物新品种的花、叶等器官的颜色性状进行色彩描述,相比于目测法虽然更加标准化,但当样本数量比较大时,还是避免不了外部环境对比色卡造成的损伤以及视觉疲劳带来的人为误差,精确度会有所降低[27]。沈星诚等[28]研究发现,相比于使用RHSCC比色卡,采用色差计结合CIELCH色空间分布图对日本红枫的不同生长发育时期的叶色进行定量描述的方法,拟合度更高,更能够区分相近颜色属性的品种,可以更直观地看到叶片在不同生长时期的色彩变化。本研究通过测量48份观赏海棠3个叶位的色彩与色数参数绘制了CIELCH色空间分布图以及不同叶位的叶色频率分布图,发现在6月份观赏海棠上位叶的色彩表现最为丰富,花青素相对含量最高,这与前文上位叶色彩参数L*、C*、h°位点在CIELCH色空间中最为分散的结果一致。随着叶位下降,叶片成熟度增加,花青素相对含量降低,叶绿素相对含量增大,色彩参数位点呈逐渐集中的趋势,其中,L*、C*的值逐渐下降,h°值呈增大趋势。因此,叶片颜色随着叶位降低逐渐转化为深绿状态,这与龚洪泳等[29]的研究结果一致。
3.2 观赏海棠叶片色彩评价与改良途径
观赏海棠叶片色彩的变化受多种因素的影响,赵圃圃等[30]研究发现,观赏海棠上位叶在7~9月份的叶色位点呈逐渐集中趋势,影响叶片呈色的主要色素占比随着月份增长呈现不同的变化。观赏海棠品种群在4月幼叶时期品种间差异较大,5~6月幼叶逐渐成熟,色彩趋于稳定阶段,而同一品种叶位不同,叶片色彩也存在一定差异,因此本研究是在叶片观赏期较好的6月上旬对观赏海棠叶片的3个叶位色彩与色素相对含量进行研究,从而获得观赏海棠叶片色彩与色素参数变化的时空分布规律,得到48份观赏海棠种质在6月份的最佳观赏叶位以及色彩表达效果与色素相对含量的关系。基于上位叶观赏价值最高的结果,对上位叶色彩与色素参数进行参数统计与聚类分析后发现,绿色系中A1子色系的叶绿素相对含量高,色调角位于绿色区域(h°=109.72°±6.47°),奠定了该色系的绿色基调,且相比于其他类群又具有高亮度值、高饱和度的特点,是绿色类群中绿色属性表达较好的亮绿色观叶品种。B类群各色彩参数与色素相对含量差异性显著,类胡萝卜素相对含量显著高于其他类群,因此色调角接近于黄色区域(h°=86.27°±7.18°),可作为观赏海棠中进行叶色改良的试验品种。C类群中C1子色系的色调角位于红色区域(h°=29.74°±4.74°),叶绿素相对含量最低,花青素与叶绿素相对含量之比为所有类群中最高的水平(Anth/Chl=1.22±0.24),红色特征显著,是48个观赏海棠种质中的优质红叶观赏品种。研究表明,48份观赏海棠上位叶的L* 处于26.76~48.29,C*处于4.83~37.79,h°处于20.56°~125.94°。江皓等[31]通过对观赏海棠不同叶位的叶片色彩参数范围的研究发现色彩参数L*为30.69~72.14,C* 为9.10~41.50,h°为67.60°~123.51°,研究结果存在一定差异。因此,在今后对观赏海棠叶片色彩的研究中,应综合考虑多方面因素对叶片色彩变化的影响,尽可能扩大样本的比例,综合考虑种间差异以及叶片色彩与温度、光照、物候期和叶位采集标准的关系进行采样,以期获取更加充足的观赏海棠叶片色彩与色素参数数据库,得到更为精准的观赏海棠不同叶位叶色评价体系,为丰富种质资源的多样性以及观赏海棠新品种的选育工作提供更多参考依据。
目前通过低温诱导、调节土壤酸碱度、改变光照条件、杂交育种、诱变育种、分子修饰等手段以改变3种色素含量和比例,是观赏植物叶色改良的重要途径[32]。韩文学等[33]研究发现,观赏海棠叶片色彩参数中代表红绿属性的色相值a*与花青素相对含量呈正相关,代表黄蓝属性的色相值b*与类胡萝卜素相对含量呈正相关。因此可以通过改变观赏海棠生长的环境因子、调节植物体内的主要色素含量从而达到对叶片色彩的调节效果。本研究基于48个观赏海棠品种的色彩参数和色素占比,对该群体上位叶进行量化分析得到3个色系类群和5个子色系类群,对该群体的观赏海棠进行叶色评价分析,为观赏海棠选育提供初步参考依据,但由于未对整个叶片发育期的多个叶位进行全面观测,观赏海棠最佳观赏时期不同叶位色素变化差异,以及呈色与植物体内遗传物质的相关性,有待今后从色素代谢、环境因素等进一步研究其显色机制。
-
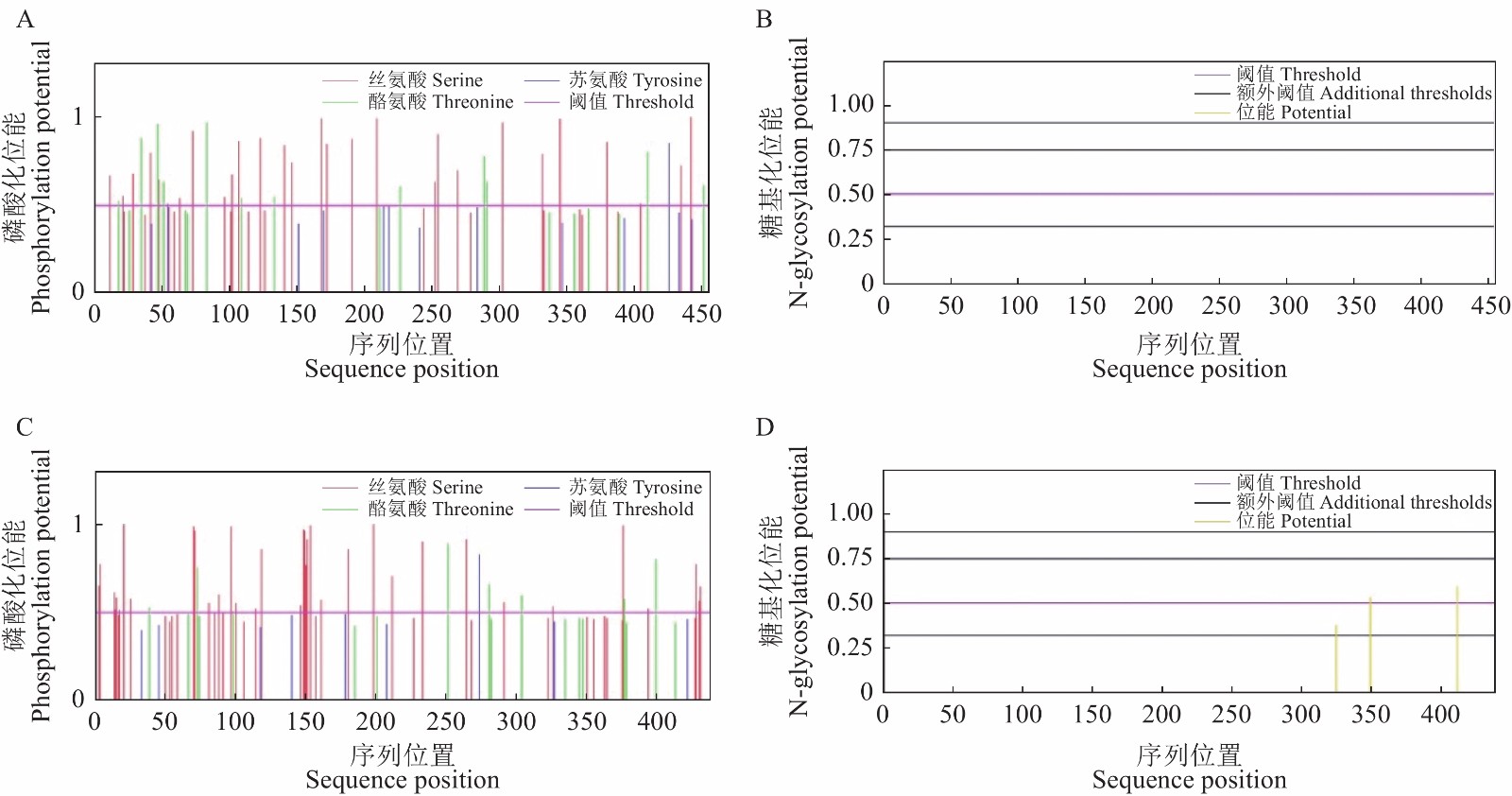
图 3 PcACY1蛋白磷酸化位点分析和糖基化位点分析
A:PcACY1-1中预测磷酸位点位置,B:PcACY1-1中预测糖基化位点位置,C:PcACY1-2中预测磷酸位点位置,D:PcACY1-2中预测糖基化位点位置。
Figure 3. Phosphorylation and N-glycosylation sites of PcACY1 proteins
A: Predicted phosphorylation sites in PcACY1-1; B: predicted N-glycosylation sites in PcACY1-1; C: predicted phosphorylation sites in PcACY1-2; D: predicted N-glycosylation sites in PcACY1-2.
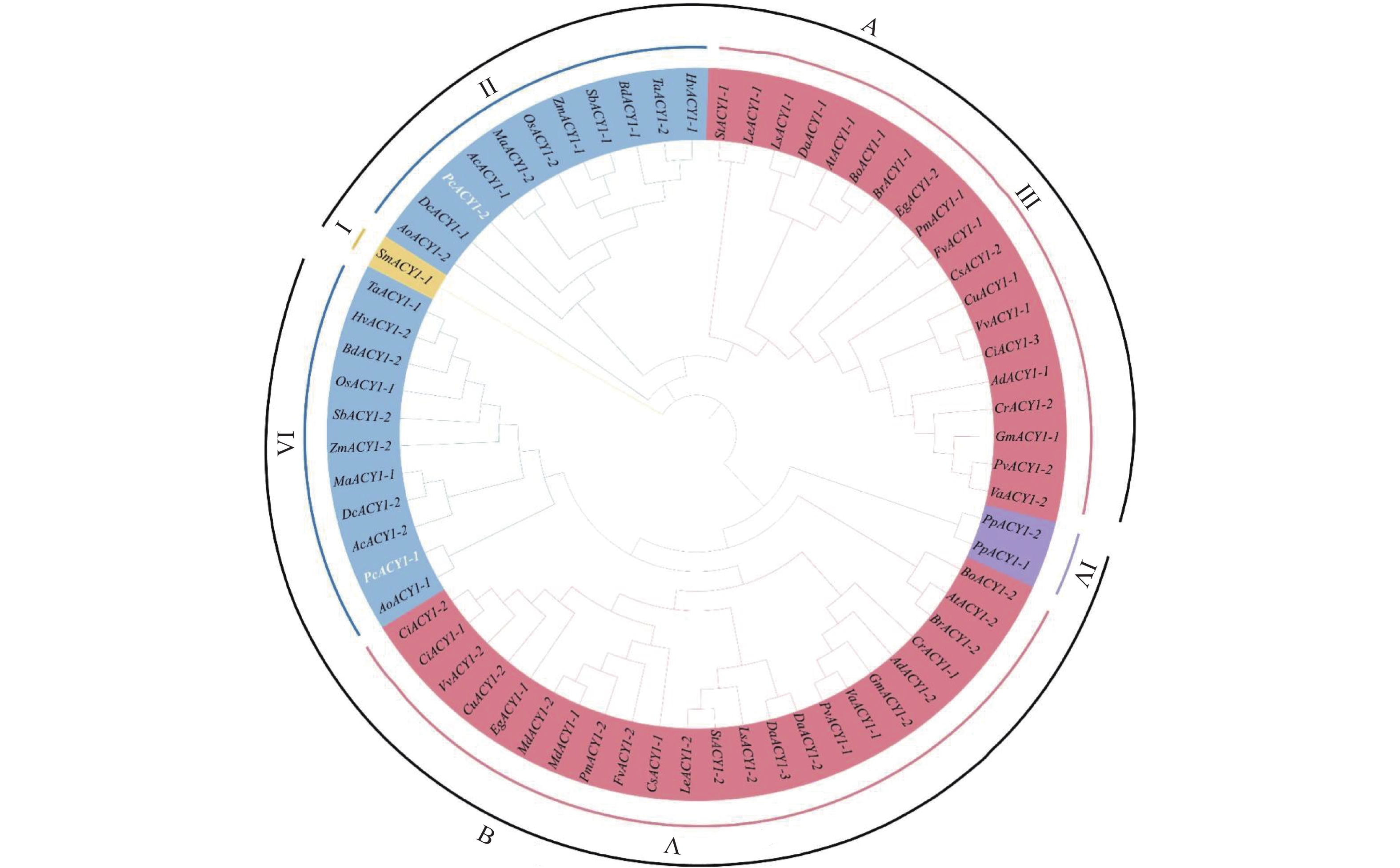
图 4 植物ACY1家族成员进化树
蓝色区域(A-ClassⅡ和B-ClassⅥ)为单子叶植物,红色区域(A-ClassⅢ和B-ClassⅤ)为双子叶植物,黄色区域(A-ClassⅠ)为苔藓植物,紫色区域(B-ClassⅣ)为蕨类植物。
Figure 4. Phylogenetic tree of ACY1 family members in plants
Blue-colored areas (A-Class II and B-Class VI) are monocotyledons; red-colored areas (A-Class III and B-Class V), dicotyledons; yellow-colored areas (A-Class I), mosses; and purple-colored areas (B-Class IV), ferns.
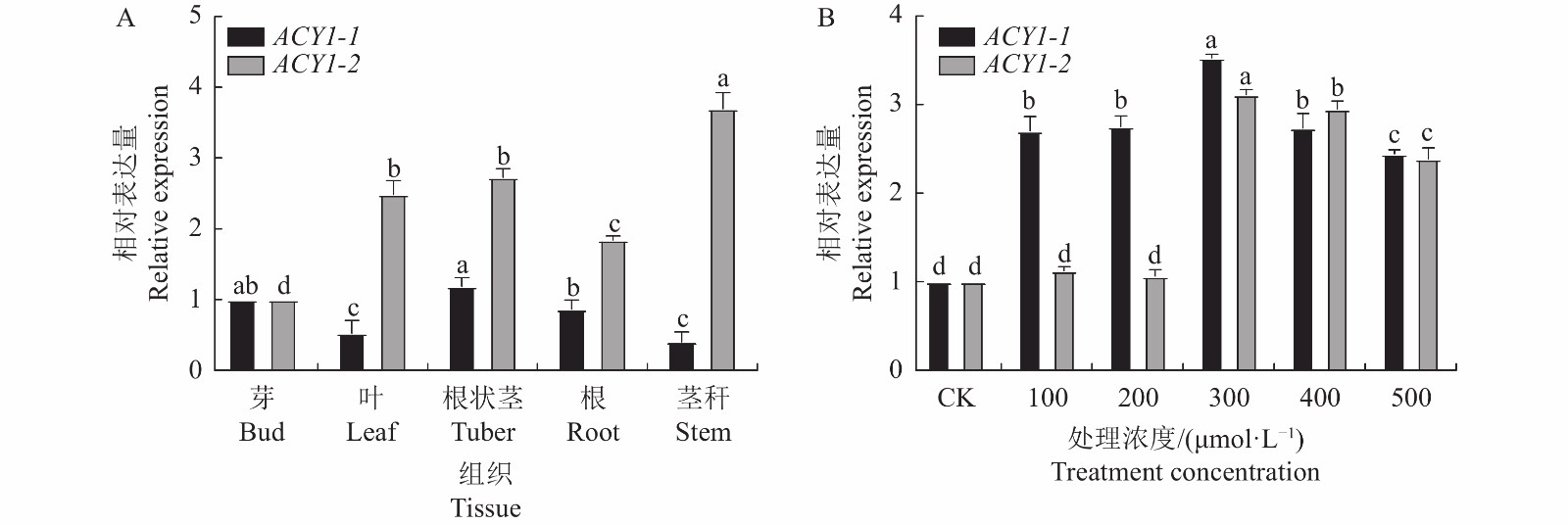
图 10 PcACY1 家族成员在多花黄精不同的组织器官(A)和不同浓度NaCl处理下(B)的表达
不同小写字母表示同一基因不同处理间差异显著(P<0. 05)。
Figure 10. Expressions of PcACY1 family members in tissues and organs of P. cyrtonema (A) and under treatments of different concentration of NaCl (B)
Datas with different lowercase letters indicate significant differences between different treatments of the same gene at P<0.05.
表 1 qRT-PCR引物
Table 1 Primers for qRT-PCR
引物名称
Primer name引物序列(5′-3′)
Primer sequences( 5′-3′)PcACY1-1F CCTCCTCTCCCTCCTCGAAA PcACY1-1R GAGTTGAGGAGGAGGGAGGA PcACY1-2F CTCAACTCCCACACCGACTC PcACY1-2R GTACTGGATGGCGATGCACT ACTIN-F GGGCTCATAGACTGATCACAAG ACTIN-R TTGTGCTTACCGACCTAATGG 表 2 多花黄精ACY1基因家族成员信息
Table 2 Information on ACY1 family of P. cyrtonema
基因名称
Gene name转录组基因ID
Accession No.编码区
CDS/bp长度
Length/aa分子量
MW/kD等电点
PI不稳定指数
Instability
index (II)亲水性
Gravity信号肽
Singal
peptide脂肪指数
Aliphatic
Index跨膜结构
Trans membrane
domain亚细胞定位
Subcellular
localizationPcACY1-1 A21014918a_transcript_7940 1371 456 50.06 5.35 32.99 −0.173 YES 87.52 0 细胞质 Cytoplasm PcACY1-2 A21014918a_transcript_9264 1317 438 48.02 5.42 50.75 −0.103 YES 86 0 细胞质 Cytoplasm 表 3 PcACY1蛋白保守结构域
Table 3 Conserved domain of PcACY1 protein
基因名称
Gene name登录号
Accession名称
Name位置
MatchesPcACY1-1 IPR002933 Peptidase_M20 
IPR001261 ArgE/DapE_CS 
IPR010159 N-acyl_aa_amidohydrolase 
PcACY1-2 IPR001261 ArgE/DapE_CS 
IPR002933 Peptidase_M20 
IPR036264 Bact_exopeptidase_dim_dom 
IPR011650 Peptidase_M20_dimer 
IPR010159 N-acyl_aa_amidohydrolase 
表 4 植物ACY1家族成员分布和数量
Table 4 Distribution and number of ACY1 family members in plants
分类 Classification 物种
Species数量
Number门
Divisio纲
Classis目
Ordo科
Quncs苔藓植物门 Bryophyta 藓纲 Musci 真藓目 Eubryales 葫芦藓科 Funariaceae 小立碗藓 Pp 2 蕨类植物门 Pteridophyta 石松纲 Lycopodiinae 卷柏目 Selaginellales 卷柏科 Selaginellaceae 江南卷柏 Sm 1 被子植物门 Angiosperms 单子叶植物纲 Monocotyledons 禾本目 Poales 禾本科 Poaceae 水稻 Os 2 小麦 Ta 2 玉米 Zm 2 二穗短柄草 Bd 2 大麦 Hv 2 双色高粱 Sb 2 百合目 Liliflorae 百合科 Liliaceae 石刁柏 Ao 2 粉状胚乳目 Farinosae 凤梨科 Bromeliaceae 菠萝 Ac 2 芭蕉目 Scitamineae 芭蕉科 Musaceae 香蕉 Ma 2 百合目 Liliflorae 薯蓣科 Dioscoreaceae 薯蓣 Dc 2 双子叶植物纲 Dicotyledons 蔷薇目 Rosales 豆科 Leguminosae 大豆 Gm 2 花生 Ad 2 豇豆 Va 2 鹰嘴豆 Cr 2 菜豆 Pv 2 蔷薇科 Rosaceae 野草莓 Fv 2 日本梅 Pm 2 苹果 Md 2 十字花目 Brassicales 十字花科 Brassicaceae 拟南芥 At 2 芜菁 Br 2 甘蓝 Bo 2 茄目 Solanales 茄科 Solanaceae 马铃薯 St 2 番茄 Le 2 葫芦目 Cucurbitales 葫芦科 Cucurbitaceae 黄瓜 Cu 2 无患子目 Sapindales 芸香科 Rutaceae 甜橙 Cs 2 葡萄目 Vitales 葡萄科 Vitaceae 葡萄 Vv 2 桃金娘目 Myrtales 桃金娘科 Myrtaceae 巨桉 Eg 2 伞形目 Apiales 伞形科 Apiaceae 胡萝卜 Da 3 壳斗目 Fagales 胡桃科 Juglandaceae 山核桃 Ci 3 菊目 Asterales 菊科 Asteraceae 莴苣 Ls 2 -
[1] 于冰. ACY-1在结直肠癌中的表达及作用机制[D]. 济南: 山东大学, 2017. YU B. Expression and mechanism of ACY-1 in colorectal cancer [D]. Jinan: Shandong University, 2017. (in Chinese)
[2] COOK R M, BURKE B J, BUCHHAGEN D L, et al. Human aminoacylase-1. Cloning, sequence, and expression analysis of a chromosome 3p21 gene inactivated in small cell lung cancer [J]. Journal of Biological Chemistry, 1993, 268(23): 17010−17017. DOI: 10.1016/S0021-9258(19)85294-8
[3] LINDNER H A, LUNIN V V, ALARY A, et al. Essential roles of zinc ligation and enzyme dimerization for catalysis in the aminoacylase-1/M20 family [J]. Journal of Biological Chemistry, 2003, 278(45): 44496−44504. DOI: 10.1074/jbc.M304233200
[4] FONES W S, LEE M. Hydrolysis of n-acyl derivatives of alanine and phenylalanine by acylase i and carboxypeptidase [J]. Journal of Biological Chemistry, 1953, 201(2): 847−856. DOI: 10.1016/S0021-9258(18)66242-8
[5] POLEVODA B, SHERMAN F. Nalpha-terminal acetylation of eukaryotic proteins [J]. The Journal of Biological Chemistry, 2000, 275(47): 36479−36482. DOI: 10.1074/jbc.R000023200
[6] SHI H J, HAYES M T, KIRANA C, et al. Overexpression of aminoacylase 1 is associated with colorectal cancer progression [J]. Human Pathology, 2013, 44(6): 1089−1097. DOI: 10.1016/j.humpath.2012.09.015
[7] PERRIER J, DURAND A, GIARDINA T, et al. Catabolism of intracellular N-terminal acetylated proteins: Involvement of acylpeptide hydrolase and acylase [J]. Biochimie, 2005, 87(8): 673−685. DOI: 10.1016/j.biochi.2005.04.002
[8] 张露莹. ACY1调控mTOR信号通路的机制[D]. 广州: 广州医科大学, 2020. ZHANG L Y. Mechanism of ACY1 regulation of mTOR signaling pathway [D]. Guangzhou: Guangzhou Medical University, 2020. (in Chinese)
[9] 国家药典委员会. 中华人民共和国药典: 一部[M]. 北京: 中国医药科技出版社, 2010. [10] 中国科学院中国植物志编辑委员会. 中国植物志: 第十五卷[M]. 北京: 科学出版社, 1978. [11] BIRNBAUM S M, LEVINTOW L, KINGSLEY R B, et al. Specificity of amino acid acylases [J]. Journal of Biological Chemistry, 1952, 194(1): 455−470. DOI: 10.1016/S0021-9258(18)55898-1
[12] CHEN Z M, GAO J H, SUN J, et al. Aminoacylase 1 (ACY-1) mediates the proliferation and migration of neuroblastoma cells in humans through the ERK/transforming growth factor β (TGF-β) signaling pathways [J]. Medical Science Monitor, 2020, 27: e928813.
[13] TYLKI-SZYMANSKA A, GRADOWSKA W, SOMMER A, et al. Aminoacylase 1 deficiency associated with autistic behavior [J]. Journal of Inherited Metabolic Disease, 2010, 33(3): 211−214.
[14] SASS J O, VAITHILINGAM J, GEMPERLE-BRITSCHGI C, et al. Expanding the phenotype in aminoacylase 1 (ACY1) deficiency: Characterization of the molecular defect in a 63-year-old woman with generalized dystonia [J]. Metabolic Brain Disease, 2016, 31(3): 587−592. DOI: 10.1007/s11011-015-9778-6
[15] ZHONG Y, ONUKI J, YAMASAKI T, et al. Genome-wide analysis identifies a tumor suppressor role for aminoacylase 1 in iron-induced rat renal cell carcinoma [J]. Carcinogenesis, 2009, 30(1): 158−164. DOI: 10.1093/carcin/bgn255
[16] CHENG Q A, GU S H, LIU Z W, et al. Expressional divergence of the fatty acid-amino acid conjugate-hydrolyzing aminoacylase 1 (L-ACY-1) in Helicoverpa armigera and Helicoverpa assulta [J]. Scientific Reports, 2017, 7: 8721. DOI: 10.1038/s41598-017-09185-2
[17] JIN G Z, DONG H, YU W L, et al. A novel panel of biomarkers in distinction of small well-differentiated HCC from dysplastic nodules and outcome values [J]. BMC Cancer, 2013, 13: 161. DOI: 10.1186/1471-2407-13-161
[18] STOCKER P, BRUNEL J M, DE REZENDE L, et al. Aminoacylase 1-catalysed deacetylation of bioactives epoxides mycotoxin-derived mercapturates; 3, 4-epoxyprecocenes as models of cytotoxic epoxides [J]. Biochimie, 2012, 94(8): 1668−1675. DOI: 10.1016/j.biochi.2012.01.006
[19] KOREISHI M, NAKATANI Y, OOI M, et al. Purification, characterization, molecular cloning, and expression of a new aminoacylase from Streptomyces mobaraensis that can hydrolyze N-(middle/long)-chain-fatty-acyl-L-amino acids as well as N-short-chain-acyl-L-amino acids [J]. Bioscience, Biotechnology, and Biochemistry, 2009, 73(9): 1940−1947. DOI: 10.1271/bbb.90081
[20] CHEN D B, LI J H, JIAO F C, et al. ZmACY-1 antagonistically regulates growth and stress responses in Nicotiana benthamiana [J]. Frontiers in Plant Science, 2021, 12: 593001. DOI: 10.3389/fpls.2021.593001
[21] NAKANO M, NISHIHARA M, YOSHIOKA H, et al. Silencing of DS2 aminoacylase-like genes confirms basal resistance to Phytophthora infestans in Nicotiana benthamiana [J]. Plant Signaling & Behavior, 2014, 9(2): e28004.
[22] CHEN C J, CHEN H, ZHANG Y, et al. TBtools: An integrative toolkit developed for interactive analyses of big biological data [J]. Molecular Plant, 2020, 13(8): 1194−1202. DOI: 10.1016/j.molp.2020.06.009
[23] BAUMEIER C, KAISER D, HEEREN J, et al. Caloric restriction and intermittent fasting alter hepatic lipid droplet proteome and diacylglycerol species and prevent diabetes in NZO mice [J]. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids, 2015, 1851(5): 566−576. DOI: 10.1016/j.bbalip.2015.01.013
[24] LINDNER H A, TÄFLER-NAUMANN M, RÖHM K H. N-acetylamino acid utilization by kidney aminoacylase-1 [J]. Biochimie, 2008, 90(5): 773−780. DOI: 10.1016/j.biochi.2007.12.006
[25] CAIRA S, IANNELLI A, SCIARRILLO R, et al. Differential representation of liver proteins in obese human subjects suggests novel biomarkers and promising targets for drug development in obesity [J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 2017, 32(1): 672−682. DOI: 10.1080/14756366.2017.1292262
[26] KUHNS E H, SEIDL-ADAMS I, TUMLINSON J H. A lepidopteran aminoacylase (L-ACY-1) in Heliothis Virescens (Lepidoptera: Noctuidae) gut lumen hydrolyzes fatty acid-amino acid conjugates, elicitors of plant defense [J]. Insect Biochemistry and Molecular Biology, 2012, 42(1): 32−40. DOI: 10.1016/j.ibmb.2011.10.004
[27] KUTMON M, RIUTTA A, NUNES N, et al. WikiPathways: Capturing the full diversity of pathway knowledge [J]. Nucleic Acids Research, 2016, 44(D1): D488−D494. DOI: 10.1093/nar/gkv1024
[28] WU G, MORRIS S. Arginine metabolism: nitric oxide and beyond [J]. Biochemical Journal, 1998: 331-336.
[29] LINDNER H, HÖPFNER S, TÄFLER-NAUMANN M, et al. The distribution of aminoacylase I among mammalian species and localization of the enzyme in porcine kidney [J]. Biochimie, 2000, 82(2): 129−137. DOI: 10.1016/S0300-9084(00)00191-7
-
期刊类型引用(2)
1. 王彬, 丁雁鑫, 林仙军, 周芷锦, 毛石明. 生物发酵床腐熟垫料的资源化利用及安全性评价. 家畜生态学报. 2020(03): 71-75 .  百度学术
百度学术
2. 陈倩倩, 刘波, 王阶平, 车建美, 朱育菁, 张海峰. 养猪微生物发酵床垫料细菌多样性分析. 环境科学学报. 2018(12): 4751-4759 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: