Regulating Effect of Exogenous Melatonin on Aluminum Toxicity in Solanum lycopersicum L.
-
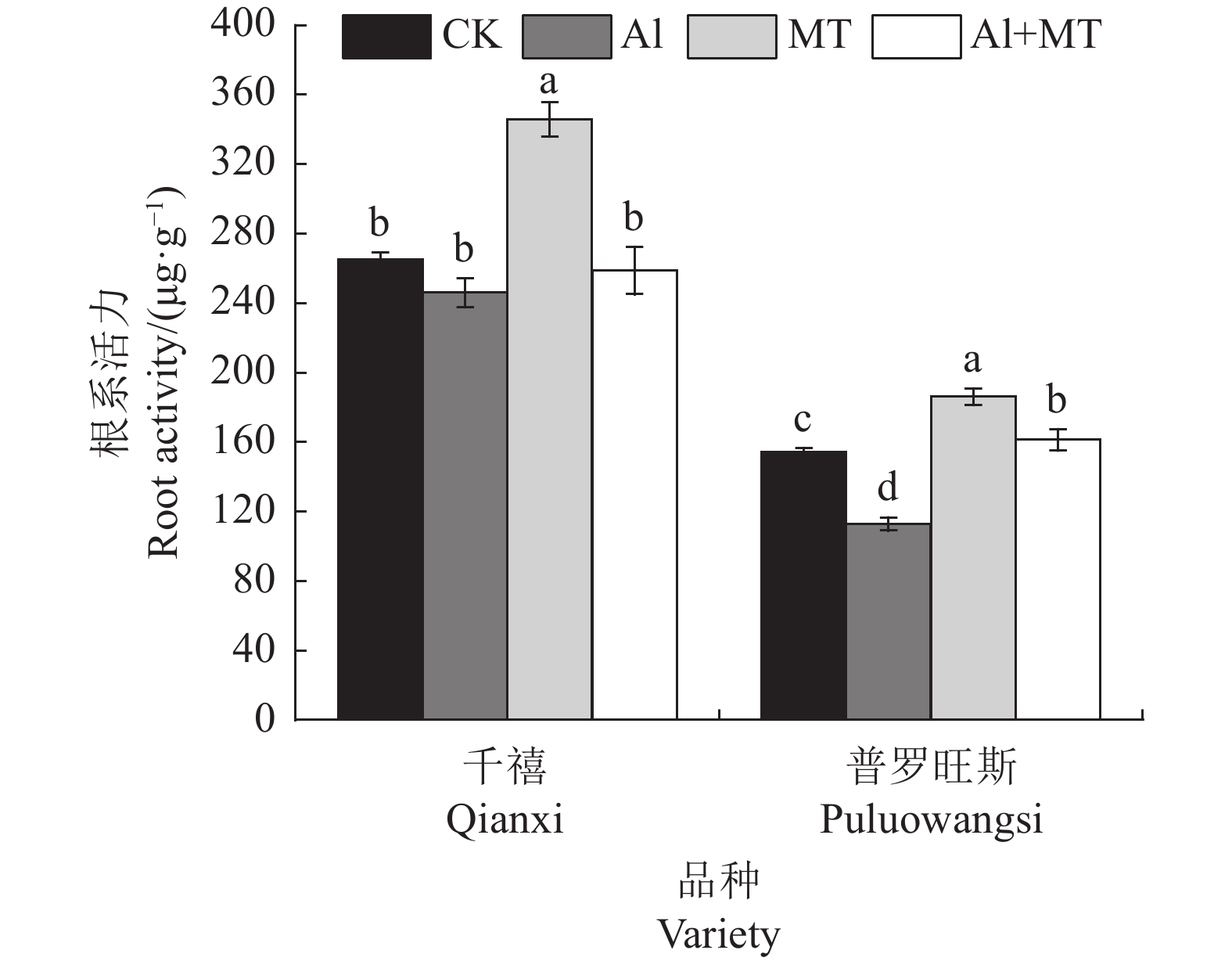
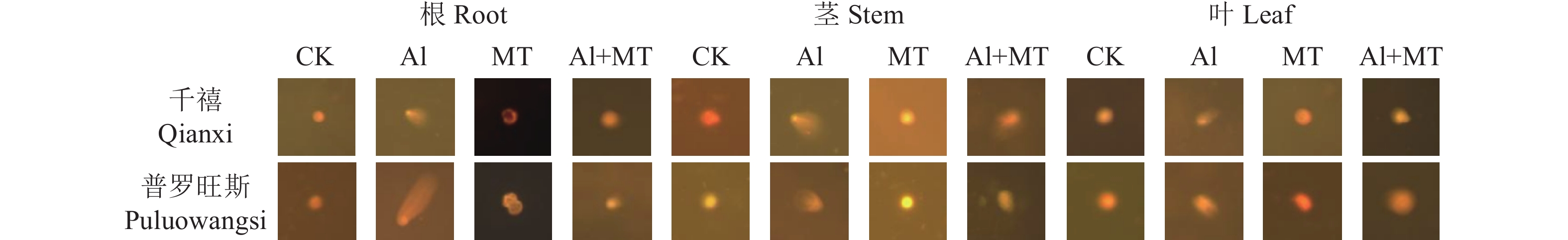
摘要:目的 研究褪黑素对铝胁迫下番茄生理上的调控作用,为缓解土壤酸铝化对番茄生长造成的不利影响提供理论依据。方法 以耐铝品种千禧番茄和铝敏感品种普罗旺斯番茄为供试植物,设置空白组、单铝组、褪黑素(MT)处理组和铝+褪黑素共同施加组,测定各处理组生长周期(10 d、20 d、30 d)过程中番茄叶片抗氧化酶[超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)]活性、丙二醛(MDA)、脯氨酸(Pro)、抗坏血酸(AsA)、谷胱甘肽(GSH)含量、叶绿素含量和叶绿素荧光参数,检测根部铝富集含量和根系活力,并对番茄的根、茎、叶进行DNA损伤检测。结果 铝逆境下两品种番茄生长发育均受到严重抑制,各器官DNA均受损严重,且其根系DNA损伤最为严重。施用褪黑素能够明显缓解番茄的铝毒症状,两品种番茄株高、根长及叶面积等主要生长指标均有所增长;抗氧化酶活性得到显著提高,且随实验周期延长呈现先上升后下降的趋势;GSH和AsA含量最大增幅达91.14%、13.52%;MDA含量降幅最大可达38.39%,脯氨酸含量增幅可达144.81%,调节番茄体内渗透平衡;叶绿素含量明显升高,各项荧光参数得到改善,恢复其光合能力;千禧番茄和普罗旺斯番茄根系活力增幅分别为5.19%和43.03%,两者的根、茎、叶铝富集能力均降低。同时,施加褪黑素也能够有效减缓番茄各器官DNA拖尾现象,修复细胞DNA损伤。结论 施加外源褪黑素能有效激活铝胁迫下番茄的各项生理响应,促进其生长发育,不仅能提高抗氧化酶系统活性,增强光合能力与根系活力,还可以减少植株体内铝含量,降低细胞DNA受损程度,进一步提升其抗铝能力,为探索MT对逆境下植物的调控作用提供新思路。Abstract:Objective Regulating effect of melatonin application on the physiology of a tomato plant under aluminum stress was studied.Method Al-tolerant Millennial tomato and Al-sensitive Provence tomato plants were grown in blank control, Al-added, melatonin-added (MT), or Al-and-melatonin-added (AMT) potting soils. Activities of superoxide dismutase (SOD), peroxidase (POD), and catalase (CAT), contents of malondialdehyde (MDA), proline (Pro), ascorbic acid (AsA), glutathione (GSH), and chlorophyll as well as chlorophyll fluorescence parameters, Al-accumulation, and root activity in the plants were monitored. DNA damage occurred to the roots, stems, and leaves of the plants during the experimentation were recorded. Statistical analysis was performed on all collected data using the one-way ANOVA and Duncan test.Result Under Al-stress, the growth and development of the tomato plants of either variety were severely inhibited, and the DNA in the organs, especially the roots, seriously damaged. Whereas the presence of melatonin in the soil (MT and/or AMT ) significantly alleviated the symptoms of Al-toxicity on the plants. For instance, with the addition, the main growth indicators, such as plant height, root length, and leaf area, were improved; the activity of antioxidant enzymes significantly heightened with an increasing trend initially and followed by a decline as treatment duration prolonged; the contents of GSH and AsA raised by 91.14% and 13.52% respectively; the reduction on MDA maximized at 38.39%; proline, which regulates the osmotic balance in tomato, increased to 144.81% and chlorophyll significantly; the fluorescence parameters improved; the photosynthetic capacity much restored; the root activity of Millennial tomato plant increased by 5.19%, and that of Provence tomato by 43.03%; the Al-accumulation in the roots, stems, and leaves significantly reduced; the DNA tailing in organs slowed; and the repairs on damaged DNA in cells observed.Conclusion Applying exogenous melatonin in soil effectively activated various physiological responses, raised the activity of antioxidant enzymes, enhanced the plant photosynthesis, reduced damage on cellular DNA, and elevated the resistance to Al-toxicity of the tomato plants under the heavy metal stress.
-
Keywords:
- Melatonin /
- Solanum lycopersicum /
- aluminum stress /
- physiological response /
- DNA damage
-
0. 引言
【研究意义】中国沙棘(Hippophae rhamnoides subsp. sinensis Rousi)抗逆能力强,耐寒、耐旱、耐盐碱、耐瘠薄,具有抗风沙、保持水土、固氮解磷解钾等特性,是青藏高原首选的造林树种[1−2]。在青海复杂的自然条件下中国沙棘分布范围广,生态适应性强,因原始生存环境复杂,沙棘类群多样且种类丰富,因而相较于人工种植的沙棘其功能基因更加多样,遗传物质更加丰富,更有利于研究根际促生菌丰富度和多样性[3]。通过对野生沙棘根际土壤假单胞属菌株的筛选及其解磷解钾固氮降解纤维素等促生功能研究,可以提高土壤养分分解速率,增加土壤的养分含量,使农作物获得更好的生长环境[4]。【前人研究进展】根际促生菌可以通过黏附到矿物表面并释放酸性物质,将难溶性钾、磷和硅等营养元素释放出来进而供植物吸收利用[5−8]。目前,从植物根际土中分离出的菌株主要有假单胞菌、芽孢杆菌、不动杆菌,其中假单胞菌是青藏高原地区根际促生菌的优势菌株,具有溶磷、解钾、固氮和促进植物生长等作用[9]。马福林等[10]从西藏沙棘中分离出了具有解磷解钾功能的假单胞菌菌株,西藏沙棘接种该菌株后生长得到明显改善。Hameeda等[11]混合接种5种不同菌属的菌株于玉米后发现,假单胞菌可显著提高种子发芽率,并能促进玉米生长,减少氮肥使用。杨晓帆等[12]对桃树根际土壤中的假单胞菌进行分离筛选,发现桃树接种假单胞菌对其叶片、须根数、株高、鲜质量均有明显的促生效应。近些年来的研究表明,植物根际中分离的假单胞菌菌株在促进种子萌发、幼苗生长、提高农作物产量、品质和改善土壤特性等方面起着重要的作用[13]。【本研究切入点】目前,根际促生菌中的分离鉴定工作主要集中在玉米、马铃薯等经济作物方面[14−16],对沙棘,尤其是青海野生中国沙棘根际促生菌中的分离及研究其多功能能力的相关研究鲜有报道。【拟解决的关键问题】从青海野生中国沙棘根际土壤中分离具有解磷解钾固氮降解纤维素能力的假单胞菌,对其进行生理生化、分子鉴定、种子发芽试验和促生试验,以期为研发适宜高原农业生产所需的高效生物菌肥奠定基础。
1. 材料与方法
1.1 取样地概况
于2021年8月,采集分布于西宁大通的野生中国沙棘根际土壤。土壤为沙质土壤,伴生植物有西藏沙棘、金露梅等。
1.2 试验材料
试验试剂:革兰氏染液、磷标准溶液、抗坏血酸溶液 、钼酸盐溶液、钼锑抗显色剂、琼脂糖、细菌DNA提取试剂盒、甘油、75%硫酸溶液,细菌生化鉴定管。试验培养基:普通肉汤琼脂培养基、阿须贝固氮培养基、无机磷培养基、有机磷培养基、卵黄琼脂培养基、硅酸盐培养基、LB液体培养基、1/2MS固体培养基、纤维素刚果红培养基。以上试验试剂及试验培养基均购自青岛海博生物技术有限公司。
1.3 试验方法
1.3.1 样土采集
用土壤钻在采样点按照S形采样法,采集中国沙棘根际土壤,将其制成混合土样,保存于4 ℃冰箱,用于根际促生菌的分离、纯化与鉴定。
1.3.2 菌株分离筛选
在无菌条件下,称取10 g混合土壤样品,溶解在装有90 mL生理盐水的三角形烧瓶中,完全摇匀并在28 ℃和170 r·min−1的摇床中振荡30 min,配制成体积分数分别为10%、1%、0.1%、0.01%、0.001%和0.0001%的稀释液,分别吸取上述稀释液100 μL到阿须贝固氮培养基、无机磷培养基、有机磷培养基、硅酸盐培养基、纤维素刚果红培养基等筛选固体培养基上,用涂布棒均匀涂抹。每种培养基平板重复3次。倒置于30 ℃生化培养箱中,培养3 d。
1.3.3 菌株纯化
选择在有机磷固体培养基、无机磷固体培养基、硅酸盐固体培养基、阿须贝固体培养基和纤维素刚果红固体培养基上长势好、凸起高的单菌落接种在普通肉汤琼脂培养基上进行划线,直至出现单一菌株。
1.3.4 菌株形态学鉴定
在普通肉汤琼脂培养基上选择单一菌落,观察该菌落形态特征,并根据《常见细菌系统鉴定手册》[17]对菌株进行形态学鉴定。
1.3.5 菌株生理生化鉴定
根据《常见细菌系统鉴定手册》[17]对菌株的生理生化特征进行测定,参照生化管说明书判定结果并记录。
1.3.6 菌株分子生物学鉴定
将待提取DNA的细菌制成悬浊液,利用细菌DNA提取试剂盒提取中国沙棘根际细菌DNA。使用通用引物[5′-AGAGTTTGATCCTGGCTCAGGATGA-3′(27F)和5′-TACGGCTACCTTGTTACGACTTAGC-3′(1492R)]扩增16S rDNA。预期扩增产物长度为1 500 bp。扩增体系:Premix Taq 25 μL,上下游引物各1 μL,基因组DNA 0.5 μL,ddH2O补足至50 μL。扩增条件:95 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,35个循环;72 ℃ 5 min,4 ℃结束反应。用 1% 琼脂糖凝胶电泳检测产物质量后,送至北京奥维森基因科技有限公司进行测序。将测序所得基因序列提交于NCBI数据库中的核苷酸序列进行BLAST分析,从中下载同源性较高的16S rDNA序列进行比对分析后运用MEGA构建系统发育树,确定其分类地位。
1.3.7 菌种解磷能力测定
溶磷定性测定:用打孔器分别在卵黄琼脂培养基、无机磷培养基上打3个孔,每个孔接种 30 μL 菌液,每个平板重复3次。置于28 ℃生化培养箱中培养 3 d,分别在1 d后和3 d后测量透明圈直径和浑浊圈直径。
溶磷定量测定:参考张祥胜[18]的方法进行磷含量测定。
1.3.8 菌株解钾能力测定
解钾定性测定:运用点接法将单一菌株接种于硅酸盐细菌培养基上,每个平板重复3次,倒置于30 ℃生化培养箱中培养3 d,分别在1 d后和3 d后测量黄色透明圈直径。
解钾定量测定:接种400 μL 菌液到10 mL硅酸盐液体培养基中,于28 ℃、180 r·min−1条件下振荡培养3 d,重复3次;取上述10 mL菌液于离心管中,10 000 r·min−1、4 ℃下离心10 min后转移至另一个离心管中,加入5 mL70%(体积分数)浓H2SO4和2 mL20%(体积分数)H2O2溶液;放入消煮炉中消煮至黏稠物质变成透明色,用无菌水定容至50 mL,再用原子吸收仪测定其K+含量。
1.3.9 菌株固氮能力测定
使用灭菌牙签挑取已纯化平板上的单菌落,接种在阿须贝固体培养基上,每个平板重复3次,于30 ℃生化培养箱中培养。分别在1 d后和3 d后使用游标卡尺测量透明圆圈直径(D)与菌落直径(d)。
1.3.10 菌株降解纤维素能力测定
运用点接法,将单一菌株用灭菌牙签点接到纤维素刚果红培养基,每个处理重复3次,于28 ℃生化培养箱中倒置培养3 d,测量纤维素透明圈直径。
1.3.11 种子发芽能力的测定
将分离菌株接种于LB液体培养基中,于30 ℃、170 r·min−1的摇床中培养12 h后,将菌液加入96孔板中。 酶标仪波长设置为595 nm,测定菌液光密度值,运用无菌水添加法将菌液的光密度调为1,加无菌水稀释100倍,备用。
将雍菜种子浸泡于10%(体积分数)的双氧水中消毒10 min,用无菌水多次清洗晾干。挑取大小一致、饱满的雍菜种子在菌液中浸泡2 h,以无菌水作为对照,每种菌株重复3次。将浸泡后的种子用镊子转移至铺有湿润滤纸的培养皿中,每个培养皿50粒种子,28 ℃培养72、120 h,分别在第3 天和第5 天时测量雍菜种子发芽率。
1.3.12 植物生长能力的测定
选取15个长势一致的出苗期雍菜幼苗均匀种植于1/2MS固体培养基中。在幼苗根系下方3 cm处滴加200 μL稀释后的菌液,对照组滴加200 μL无菌水。每个处理组重复3次。置于光照培养箱28 ℃、光周期16L∶8D培养10 d,观察平板植物生长状况,并且记录植物的茎长、叶长、叶宽、根长、须根、鲜重等生长指标。
1.4 数据分析方法
采用SPSS 25.0软件对数据进行单因素方差分析;采用 Microsoft Excel 2010 绘制柱形图,采用 MEGA构建系统发育树。
2. 结果与分析
2.1 菌株形态学鉴定
在普通肉汤琼脂培养基上纯化得到23株假单胞菌属菌株,其中有7株菌株在硅酸盐培养基、无机磷培养基、有机磷培养基、阿须贝固氮培养基和纤维素刚果红培养基上均长势良好。
将7株菌株分别命名为ZGSJ-1、ZGSJ-2、ZGSJ-3、ZGSJ-4、ZGSJ-5、ZGSJ-6、ZGSJ-7,并接种到普通肉汤琼脂培养基上进行培养。其生长形态如图1,菌体镜检如图2所示。菌株ZGSJ-1:菌落扁平,圆形,淡黄色,单一菌落直径3~4 mm;菌体革兰氏染色呈阴性,短棒状。菌株ZGSJ-2:菌落中间凸起,椭圆形,淡黄色,单一菌落直径2~4 mm;菌体革兰氏染色呈阴性,棒状。菌株ZGSJ-3:菌落中间凸起,圆形,淡黄色,单一菌落直径3~4 mm;菌体革兰氏染色为阴性,圆球状。菌株ZGSJ-4:菌落扁平,圆形,黄色,单一菌落直径1~3 mm;菌体革兰氏染色呈阴性,圆球形。菌株ZGSJ-5:菌落中央隆起边缘扁平,圆形,单一菌落直径1~2 mm;菌体革兰阴性菌,小杆状略弯曲。菌株ZGSJ-6:菌落微隆起,微隆起,黄色,单一菌落直径2~3 mm;菌体革兰氏阴性菌,呈杆状。菌株ZGSJ-7:菌落凸起,圆形,淡黄色,单一菌落直径2~4 mm;菌体革兰氏染色为阴性,圆球状。
2.2 菌株生理生化特征鉴定
由表1可知,7株细菌在接触酶试验为阳性,在甲基红、水杨苷、吲哚试验试验中呈阴性,不能水解淀粉,生长pH值为5.7,符合假单胞菌的生理生化特征。其中ZGSJ-1、ZGSJ-7可还原硝酸盐、可分解木糖。在葡萄糖氧化发酵测试(oxidation-fermentation test, OF)中,产碱型细菌为ZGSJ-1、ZGSJ-2,氧化型细菌为ZGSJ-3、ZGSJ-6、ZGSJ-7,发酵型细菌为ZGSJ-4、ZGSJ-5。
表 1 菌株生理生化特征鉴定结果Table 1. Physio-biochemical characteristics of isolates
项目
Item菌株
Strain
项目
Item菌株
StrainZGSJ-1 ZGSJ-2 ZGSJ-3 ZGSJ-4 ZGSJ-5 ZGSJ-6 ZGSJ-7 ZGSJ-1 ZGSJ-2 ZGSJ-3 ZGSJ-4 ZGSJ-5 ZGSJ-6 ZGSJ-7 接触酶
Catalase+ + + + + + + 7%氯化钠
7%sodium
chloride+ − − + + + + 氧化酶
Oxidase− + − − + − − 木糖
Xylose+ − − + − − + 甲基红
Methyl
red− − − − − − − pH5.7 + + + + + + + 明胶液化
Gelatin liquefaction+ − − − − − + 水杨苷
Salicin− − − − − − − 淀粉水解
Starch
hydrolysis− − − − − − − 吲哚
Indole− − − − − − − 硝酸盐
还原
Nitrate
reduction+ − − − − − + L-精氨酸
双水解
L-arginine dihydrolyze− − − + − + − 葡萄糖
Glucose− + + − + + − 葡萄糖OF
Glucose
OF产碱
Alkali production产碱
Alkali production氧化
Oxidation发酵
Fermentation发酵
Fermentation氧化
Oxidation氧化
Oxidation2.3 菌株分子生物学鉴定
提取菌株16S rDNA进行PCR扩增,将扩增产物送至北京奥维森基因科技有限公司测序。基于测定的16S rDNA序列,在NCBI中BLAST比对分析,运用MEGA建立系统发育树,结果如图3所示。菌株ZGSJ-1、ZGSJ-2、ZGSJ-3、ZGSJ-4、ZGSJ-5、ZGSJ-6和ZGSJ-7分别与模式菌株盖氏假单胞菌(Pseudomonas gessardii)KC790316、萨拉曼卡假单胞菌(Pseudomonas_helmanticensis)NR
126220 、莫尔氏假单胞菌(Pseudomonas umsongensis)MF716696、贝提卡假单胞菌(Pseudomonas baetica)KC790260、克氏假单胞菌(Pseudomonas kribbensis)MK240439、克氏假单胞菌(Pseudomonas kribbensis)MK240439、孟氏假单胞菌(Pseudomonas mandelii)OK13585共聚一支,同源性分别为100.0%、99.0%、99.9%、99.8%、99.0%、99.6%和100.0%,结合形态学和生理生化特征,可将7株菌株均鉴定为假单胞菌。2.4 菌株的解磷能力的测定
在卵黄琼脂培养基和无机磷培养基上对7株菌株进行解磷定性测定(表2),通过平板上的浑浊圈直径(解有机磷)和透明圈直径(解无机磷),可以初步确定菌株的解磷定性能力。本试验结果显示,在卵黄琼脂培养基上培养1 d,各菌株所形成的浑浊圈直径为2.91~9.75 mm,浑浊圈直径大小依次为ZGSJ-6>ZGSJ-1>ZGSJ-4>ZGSJ-5>ZGSJ-7>ZGSJ-3>ZGSJ-2,ZGSJ-6浑浊圈直径最大,为9.75 mm,显著高于其他6株菌。培养3 d,浑浊圈直径为4.28~13.71 mm,ZGSJ-1浑浊圈最大,较ZGSJ-2显著提高220.3%(P<0.05)。在无机磷培养基上培养1 d,透明圈直径在0.63~4.30 mm,ZGSJ-5显著高于除ZGSJ-4外的其他菌株(P<0.05)。培养3 d,透明圈直径在3.51~7.62 mm,ZGSJ-4最大,较ZGSJ-7增加117.1%,差异显著(P<0.05)。
表 2 菌株解磷能力的定性测定结果Table 2. Phosphate-degrading ability of isolates菌株
Strain1 d后的浑浊圈直径
Diameter of turbid circle
after 1 d/mm3 d后的浑浊圈直径
Diameter of turbid circle
after 3 d/mm1 d后的透明圈直径
Diameter of transparent ring
after 1 d/mm3 d后的透明圈直径
Diameter of transparent ring
after 3 d/mmZGSI-1 7.79±1.10b 13.71±0.49a 1.66±0.16c 4.27±1.06b ZGSI-2 2.91±2.91d 4.28±0.70c 0.82±0.51d 5.13±0.78b ZGSI-3 3.75±0.74cd 8.05±0.49b 0.63±0.35d 5.45±0.8ab ZGSI-4 7.56±0.98b 11.65±2.48a 3.62±0.96ab 7.62±0.78a ZGSI-5 4.92±0.52c 9.07±0.36b 4.30±0.11a 4.31±0.85b ZGSI-6 9.75±0.80a 12.05±0.67a 1.93±0.07c 4.82±2.75b ZGSI-7 4.12±0.00cd 7.95±0.29b 2.94±0.24b 3.51±0.01b 同列不同小写字母表示差异达显著水平(P<0.05)。下同。
Data with different lowercase letters on same column indicate significant differences at P<0.05. Same for below.解磷量通过检测发酵液中的P含量确定,菌株在有机磷液体培养基和无机磷液体培养基下培养3 d,测得磷质量浓度结果如表3所示。在有机磷液体培养基下测得7株菌的磷质量浓度为5.15~25.41 μg·mL−1,在无机磷液体培养基下测得菌株的磷质量浓度为2.15~22.26 μg·mL−1。其中,菌株ZGSJ-5解有机磷功能显著高于其他菌株,其次为菌株ZGSJ-3。菌株ZGSJ-5解无机磷功能显著高于其他菌株。
表 3 菌株的解磷量Table 3. Phosphorus-degrading capacity of isolates菌株
Strain解有机磷量
Organophosphorus
hydrolysis
/(μg·mL−1)解无机磷量
Hydrolysis of
inorganic phosphorus
/(μg·mL−1)ZGSJ-1 8.08±0.41e 2.15±0.13f ZGSJ-2 7.41±0.39e 2.49±0.43f ZGSJ-3 18.77±0.14b 16.62±0.36b ZGSJ-4 17.79±0.47c 9.46±0.41d ZGSJ-5 25.41±0.77a 22.26±0.68a ZGSJ-6 5.15±0.14f 13.01±0.07c ZGSJ-7 9.76±0.19d 3.06±0.51e 2.5 菌株的解钾能力的测定
菌株的定性结果如表4所示。培养1 d后,各菌株所形成的解钾黄色光圈直径为3.01~21.66 mm,解钾黄色光圈直径大小依次为ZGSJ-3>ZGSJ-4>ZGSJ-1>ZGSJ-6>ZGSJ-7>ZGSJ-2,ZGSJ-3解钾黄色光圈直径最大,为21.66 mm,显著高于其他菌株。培养3 d后,解钾黄色光圈直径为11.12~21.85 mm,ZGSJ-3解钾黄色光圈最大,较ZGSJ-2显著提高96.5%。
表 4 菌株解钾能力的定性测定结果Table 4. Potassium-degrading ability of isolates菌株
Strain1 d后的黄色光圈直径
Diameter of yellow
aperture after
1 d /mm3 d后的黄色光圈直径
Diameter of yellow
aperture after
3 d /mmZGSI-1 9.18±1.39c 13.70±1.94bc ZGSI-2 3.01±0.42e 11.12±1.85c ZGSI-3 21.66±0.40a 21.85±0.60a ZGSI-4 12.17±2.29b 16.98±0.19b ZGSI-5 5.99±1.73d 14.00±3.10bc ZGSI-6 8.25±1.34cd 17.61±3.58b ZGSI-7 3.48±0.67e 11.49±1.39c 如图4所示,培养3 d,7种菌株菌液中的K+含量均大于CK,ZGSJ-3最高,达14.33 μg·mL−1,较CK显著增加374.5 %。菌株ZGSJ-5、ZGSJ-7、ZGSJ-2解钾量较CK分别显著增加198.7%、165.89%、150.0%,其他菌株与CK无显著差异。
2.6 菌株的固氮能力的测定
在阿须贝固氮培养基上对7株菌株进行固氮能力测定,结果(图5)表明,通过测量平板上菌落的透明圈直径(D)和菌落生长直径(d)的比值(D/d),可以初步确定菌株的固氮能力。在阿须贝固氮培养基上培养1 d,各菌株所形成的透明圈直径(D)和菌落生长直径(d)的比值(D/d)为1.29~1.77,D/d大小依次为ZGSJ-3>ZGSJ-7>ZGSJ-5>ZGSJ-4>ZGSJ-1>ZGSJ-2>ZGSJ-6,ZGSJ-3 D/d最大,为1.77,显著高于其他菌株。培养3 d,D/d为1.33~1.86,ZGSJ-3 D/d最大,较ZGSJ-6显著提高39.8%。
2.7 菌株降解纤维素能力的测定
不同菌株降解纤维素功能测定结果如图6所示,7种菌株均具有降解纤维素功能,且降解纤维素功能存在显著差异,培养3 d,降解纤维素的透明圈直径在4.61~10.22 mm,效果最好的为菌株ZGSJ-6,降解纤维素功能较差的为ZGSJ-4。
2.8 菌株对雍菜种子发芽的影响
由表5可知,不同菌株菌液处理均可促进雍菜种子发芽。在光照培养箱内培养3 d,测得对照组发芽率为53.3%,试验组发芽率在63.3%~80.0%,较CK相比,发芽率提高了18.8%~50.1.5%,ZGSJ-2、ZGSJ-3发芽率最高,均为80.0%,显著高于除ZGSJ-5外的其他菌株。浸种培养5 d,CK的发芽率为63.3%,试验组发芽率在66.7%~96.7%,比CK提高5.4%~52.8%,菌株ZGSJ-5处理雍菜种子发芽率最高,为96.7%。综合评价发现,假单胞菌菌液的使用可显著提高雍菜种子萌发,提高其发芽率,在第3 天、第5 天时ZGSJ-3、ZGSJ-5发芽率高。
表 5 菌株对雍菜发芽率的影响Table 5. Effect of isolates on I. aquatica seed germination rate菌株 Strain 第3 天 The 3rd day/% 第5 天 The 5th day/% CK 53.3±5.77d 63.3±5.77d ZGSI-1 63.3±23.09c 66.7±11.55d ZGSI-2 80.0±20.00a 80.0±20.00ab ZGSI-3 80.0±10.37a 80.0±10.00b ZGSI-4 70.0±10.00b 90.0±0.00ab ZGSI-5 76.7±20.81ab 96.7±5.80a ZGSI-6 66.7±5.77bc 76.7±15.3bc ZGSI-7 73.3±11.54b 86.7±11.5a 2.9 菌株对雍菜生长的影响
由表6可知,施用假单胞菌菌液可明显提高雍菜的茎长、鲜重、叶长、叶宽、主根长和须根数,其中ZGSJ-3处理的雍菜茎长比其他菌液处理有明显增加,其茎长为50.25 mm,比CK显著增加41.2%,各个处理茎长整体增量在8.1%~41.2%。施用假单胞菌菌液对鲜重增长不明显,ZGSJ-3、ZGSJ-6、ZGSJ-7菌株处理效果最好,其鲜重为0.22 g。ZGSJ-7的叶长较其他假单胞菌菌液处理增加明显,其叶长为20.23 mm,比CK相比显著增加29.9%。ZGSJ-3的叶宽较其他假单胞菌菌液处理增加明显,其叶宽为3.69 mm,比CK显著增加35.2%。ZGSJ-7处理的主根长最长,为18.36 mm,比CK增加36.3%,ZGSJ-3次之。ZGSJ-4的须根数较CK处理显著增加110.0%,ZGSJ-3次之。茎长、鲜重、叶长和主根长ZGSJ-3较ZGSJ-7处理,对雍菜的生长影响不显著,但较CK处理,促进效果较明显。由此可以看出,施用假单胞菌菌液可以促进雍菜生长,效果以ZGSJ-3、ZGSJ-7较好。
表 6 菌液处理对雍菜生长的影响Table 6. Effect of bacterial broth treatment on I. aquatica growth处理
Treatment茎长
Stem length/mm鲜重
Fresh weight/g叶长
Leaf length/mm叶宽
Blade width/mm主根长
Taproot length/mm须根数
Number of hairsCK 35.60±4.34c 0.21±0.04a 15.57±3.05bc 2.73±0.43c 13.47±3.03de 15.00±8.58d ZGSI-1 38.48±9.44bc 0.18±0.04b 15.79±2.94bc 2.48±0.47e 14.88±3.81d 24.83±7.08b ZGSI-2 48.39±5.52ab 0.20±0.03a 17.01±2.00b 3.08±0.63b 15.92±3.73c 25.00±7.32b ZGSI-3 50.25±7.15a 0.22±0.04a 19.88±3.05a 3.69±0.62a 18.23±3.15a 25.33±4.41ab ZGSI-4 39.23±6.49bc 0.21±0.04a 17.86±3.65ab 3.11±0.63b 14.30±2.76d 31.50±7.61a ZGSI-5 42.87±6.36b 0.17±0.04b 18.99±2.34a 3.67±0.79a 14.32±3.11d 23.17±10.19b ZGSI-6 44.92±3.07b 0.22±0.03a 14.60±3.51c 2.44±0.51de 17.05±4.90b 21.67±7.76c ZGSI-7 46.54±10.76ab 0.22±0.03a 20.23±2.25a 3.25±0.44b 18.36±7.48a 17.50±6.47d 3. 讨论与结论
3.1 讨论
根际促生菌具有解磷、解钾、分泌生长激素的特性,研究其特性对于揭示植物根际微生态调控过程、土壤微生物功能及促进农作物增产等方面具有重要的意义[19−20]。大量研究表明,假单胞菌为根际促生菌的优势菌株:邱睿等[21]从烟草根际土中分离出2株优势细菌,均为假单胞菌;杨彬彬等[22]从高原荒漠灌木霸王和室内盆栽植物的根际土中分离假单胞菌株BP16,具有固氮、解磷、产 IAA、产铁载体等功能,同时显著提高了小麦的株高、根长、叶绿素含量以及干重等多种植物性状。本研究中所得的根际促生菌菌株经生理生化与分子鉴定,筛选出7株假单胞菌属菌菌,均展示了不同的溶磷、解钾、固氮、降解纤维素和促生能力,与上述研究结果一致。
研究表明,不同的假单胞菌解磷、解钾、固氮效果不同[23]。初旭等[24]从杉木人工林根际土壤中筛选到10株溶磷菌,其中CX-7菌株有机磷溶解量最大,达13.5 μg·mL−1,本试验ZGSJ-5菌株有机磷溶解量为25.41 μg·mL−1,明显高于菌株CX-7。彭帅等[25]从番茄根际土壤中筛选到1株解磷荧光假单胞菌LAD6,其最大磷溶解量达24.5 μg·mL−1,与本研究结果相似。本研究7株菌株的解钾量在5.07~14.33 μg·mL−1,不同假单胞菌解钾功能存在差异。解钾量最大的为ZGSJ-3,解钾量为14.33 μg·mL−1,解钾量最小的为ZGSJ-6,解钾量为5.07 μg·mL−1。中国沙棘根际菌解钾能力存在这种巨大差异的现象与张成省等[26]和Sugumaran等[27]研究结果基本一致。这可能是由于菌株生长过程中本身需要消耗的钾离子具有差异,也有可能是因为消煮过程中各个菌株的钾元素分解有所损耗导致的[28,29]。本试验测得降解纤维素的透明圈直径在4.61~10.22 mm,效果最好的为ZGSJ-6,尹国云等[30]从农田土壤中分离出的降解纤维素细菌,其透明圈在10~15 mm,略高于菌株ZGSJ-6,可能的原因是农田生境与高寒草原生境差异明显,农田生境因秸秆大量还田,土壤中纤维素含量明显多于高寒草原生境,因此农田生境中降解纤维素菌株数量多且能力强。
同时,本试验研究发现从沙棘根际土壤中分离出来的假单胞菌菌株可以通过固氮、解磷、解钾和降解纤维素多种作用模式来改良土壤的特性,以提高种子发芽率并促进植物的生长,与王奎萍等[31]、李利坤[32]等和吴菊艳[33]等研究结果一致。杨晓帆等[12]通过对从桃树根区土壤中分离出来的荧光假单胞菌进行促生特性的研究,探索对桃树生长的影响,发现荧光假单胞菌可以通过分泌有机酸、降低pH,提高根区土壤有效磷,在盐碱地生物修复中具有良好应用潜力。本研究中分离出高效假单胞细菌ZGSJ-3和ZGSJ-7,可利用上述高效菌株制成多功能混合菌剂,在生物防治和农业生产领域进行推广应用,以提高农作物的产量和品质。本研究结果为高效生物菌肥的制作提供了理想候选菌株,也为野生中国沙棘多功能根际促生菌株的分离鉴定提供了理论依据。
3.2 结论
本研究从青海野生中国沙棘根际土中分离出7株具有解磷解钾固氮降解纤维素和促生能力的假单胞菌菌株,通过定性和定量测定其解磷解钾固氮降解纤维素能力,结果显示ZGSJ-3解钾能力最强,在改良解钾培养基上培养3 d,解钾黄色光圈最大,直径为21.85 mm,在硅酸盐液体培养基下测得解钾量为14.33 μg·mL−1,比CK增加274.5 %。ZGSJ-3固氮能力最强,培养3 d,D/d最大为1.86,较ZGSJ-6显著提高39.8%。使用假单胞菌菌液可促进雍菜种子的萌发,发芽率较CK显著增加;同时,使用假单胞菌菌液有助于雍菜幼苗鲜重增加,有效促进其生长,其幼苗的茎长、叶长、叶宽和须根数均较CK显著增加,以ZGSJ-3和ZGSJ-7菌株促生效果最明显。通过生理生化和16S rDNA分子鉴定,两株菌分别属于莫尔氏假单胞菌和孟氏假单胞菌,可将其制作成混合菌剂,为后续的菌肥开发与利用提供理想候选菌株。
-
表 1 外源MT对铝胁迫下番茄生长特性的影响
Table 1 Effect of MT on growth of tomato plants under Al-stress
品种
Varieties处理组
Treatments株高
Plant height/cm叶面积
leaf area/cm2根长
Root length/cm千禧 Qianxi CK 64.25±1.35 b 49.16±2.60 a 9.75±0.76 a Al 59.32±1.44 c 33.09±2.24 b 4.33±2.35 b MT 69.16±2.07 a 60.76±3.14 a 11.59±1.35 a Al+MT 65.92±3.12 b 55.40±1.47 a 10.47±1.32 a 普罗旺斯 Puluowangsi CK 59.37±1.21 b 37.95±1.24 a 12.64±1.84 a Al 51.31±2.74 c 25.88±3.27 b 8.24±2.46 b MT 62.81±2.68 a 41.84±1.55 a 16.05±1.27 a Al+MT 60.44±1.67 ab 39.62±2.47 a 14.18±0.55 a 表内数据为平均值±标准误差,同项同列数据后相同字母表示无显著差异(P > 0.05),下同。
Datas are mean ± standard error; those with same letter on same line indicate no significant difference ( P>0.05). Same for below. 表 2 外源MT对铝胁迫下番茄抗氧化酶的影响
Table 2 Effects of MT on antioxidant enzymes of tomato plants under Al-stress
测量指标
Measured indicators处理
Treatment千禧 Qianxi 普罗旺斯 Puluowangsi 10 d 20 d 30 d 10 d 20 d 30 d SOD/(U·g−1) CK 3902.26±334.93 b 950.64±36.19 c 675.79±15.47 a 4457.17±75.413 a 906.62±17.75 d 583.64±12.05 b AI 6536.58±237.21 a 1288.10±16.24 ab 529.74±5.01 b 5609.25±138.00 a 1139.10±25.28 b 472.19±7.09 c MT 4421.31±299.02 b 1142.93±41.86 bc 694.85±33.19 a 4712.67±180.63 a 1041.19±24.62 c 595.65±29.14 b AI+MT 8008.05±193.70 a 1407.24±34.62 a 629.48±11.85 a 6600.04±281.52 a 1314.23±32.45 a 813.36±28.87 a POD/
(△OD470·min−1·g−1)CK 58.25±2.72 a 75.33±2.21 b 163.72±7.11 c 110.56±12.98 bc 113.50±8.86 b 118.62±10.85 c AI 55.01±14.66 c 95.76±11.25 b 97.96±13.18 d 42.86±8.97 bc 138.95±9.53 ab 95.42±4.70 d MT 64.88±7.39 ab 80.43±11.95 b 192.96±3.54 b 93.16±6.10 bc 124.86±8.80 ab 171.23±6.18 b AI+MT 73.31±3.57 a 184.41±26.62 a 238.29±9.09 a 114.05±7.30 ab 152.73±5.39 a 193.36±10.77 a CAT/
(μmol·min−1·g−1)CK 5.89±1.53 c 18.36±3.04 b 58.60±1.42 b 9.06±0.99 d 18.50±3.72 d 73.77±1.31 b AI 24.54±3.74 b 32.18±2.51 b 53.00±0.98 c 69.52±2.06 c 60.60±0.92 c 52.53±1.32 c MT 12.03±3.40 c 21.47±4.46 b 29.31±1.43 b 63.31±1.43 b 73.77±0.49 b 83.63±1.89 a AI+MT 61.12±1.96 a 77.17±1.21 a 74.67±1.39 a 74.67±1.39 a 89.77±2.03 a 82.17±1.88 a 表 3 外源MT对铝胁迫下番茄内源性抗氧化物的影响
Table 3 Effect of MT on antioxidants in tomato plants under Al-stress
测量指标
Measured indicators处理
Treatment千禧 Qianxi 普罗旺斯 Puluowangsi 10 d 20 d 30 d 10 d 20 d 30 d GSH含量
GSH content/(μmol·g−1)CK 0.44±0.01 d 1.07±0.043 a 1.06±0.05 c 0.66±0.01 d 1.11±0.02 b 1.10±0.02 b AI 1.14±0.01 b 0.86±0.03 a 0.89±0.03 d 1.09±0.02 b 1.06±0.02 c 0.66±0.02 c MT 0.61±0.01 c 1.20±0.02 a 1.69±0.02 a 0.71±0.01 c 1.26±0.01 b 1.30±0.04 a AI+MT 1.20±0.02 a 1.65±0.09 a 1.49±0.05 b 1.13±0.02 a 1.57±0.01 a 1.39±0.02 a AsA含量
AsA content/(mg·g−1)CK 0.03±0.01 d 0.18±0.02 c 0.22±0.03 b 0.14±0.01 d 0.12±0.01 d 0.20±0.02 b AI 0.36±0.01 b 0.39±0.01 b 0.11±0.02 c 0.30±0.05 b 0.28±0.05 b 0.13±0.02 c MT 0.36±0.01 c 0.41±0.02 ab 0.37±0.02 a 0.16±0.03 c 0.16±0.04 c 0.22±0.02 b AI+MT 0.40±0.02 a 0.44±0.02 a 0.36±0.03 a 0.31±0.03 a 0.29±0.03 a 0.26±0.04 a 表 4 外源MT对铝胁迫下番茄脯氨酸和MDA含量的影响
Table 4 Effects of MT on Pro and MDA contents in tomato plants under Al-stress
测量指标
Measured indicators处理
Treatment千禧 Qianxi 普罗旺斯 Puluowangsi 10 d 20 d 30 d 10 d 20 d 30 d MDA含量
MDA content/(nmol·g−1)CK 8.08±0.71 b 6.98±0.40 b 6.19±0.49 c 6.41±0.24 b 6.27±0.72 ab 7.77±0.65 c AI 9.47±0.65 a 8.03±0.47 a 8.01±0.48 a 7.49±0.73 a 7.11±0.70 a 10.17±0.93 a MT 3.43±0.95 ab 4.12±1.15 b 5.83±0.68 c 2.36±0.46 c 5.49±0.52 b 6.95±0.80 c AI+MT 8.75±0.63 c 6.76±0.65 c 6.82±0.62 b 7.20±0.22 a 6.52±0.85 ab 8.72±0.38 b 脯氨酸含量
Proline content/(mg·g−1)CK 4.94±1.33 c 6.39±1.16 c 16.47±1.90 d 2.24±0.97 c 5.10±1.91 b 13.12±1.20 b AI 5.54±1.63 c 9.63±1.43 b 20.23±1.20 c 3.77±0.99 c 8.26±1.82 b 14.43±2.09 b MT 9.64±1.15 b 14.39±1.23 a 34.06±1.06 b 6.48±1.54 b 12.34±2.00 a 25.86±2.03 a AI+MT 12.64±1.20 a 15.34±2.21 a 45.53±2.08 a 13.25±2.86 a 13.89±3.00 a 28.16±3.06 a 表 5 外源MT对铝胁迫下番茄光合特性的影响
Table 5 Effects of MT on photosynthetic characteristics of tomato plants under Al-stress
测量指标
Measured indicators处理
Treatment千禧 Qianxi 普罗旺斯 Puluowangsi 10 d 20 d 30 d 10 d 20 d 30 d SPAD值
SPAD valueCK 28.17±0.37 a 28.60±0.12 b 35.30±0.32 b 31.37±0.62 b 35.87±0.47 b 35.00±0.38 b AI 24.97±0.32 b 25.67±0.26 c 27.30±0.32 c 28.93±0.77 b 29.67±0.23 c 30.27±0.43 c MT 28.23±0.38 a 30.43±0.32 a 37.03±0.08 a 36.10±0.98 a 40.37±0.27 a 38.73±0.68 a AI+MT 27.03±0.46 a 28.93±0.20 b 34.53±0.55 b 31.40±1.36 b 36.27±0.45 b 34.40±0.10 b 初始荧光
FoCK 0.10±0.03 a 0.11±0.04 b 0.11±0.02 c 0.10±0.03 b 0.10±0.07 d 0.11±0.06 c AI 0.09±0.01 a 0.13±0.04 a 0.13±0.07 a 0.12±0.04 a 0.16±0.01 a 0.18±0.05 a MT 0.06±0.03 c 0.07±0.06 d 0.09±0.05 d 0.09±0.06 c 0.11±0.07 c 0.11±0.04 c AI+MT 0.08±0.02 b 0.09±0.05 c 0.11±0.05 b 0.11±0.03 b 0.12±0.04 b 0.14±0.03 b PSII 最大光化学量子产量
Fv /F mCK 0.92±0.03 b 0.93±0.02 a 0.93±0.04 a 0.82±0.03 d 0.81±0.02 b 0.82±0.03 b AI 0.84±0.02 d 0.73±0.03 d 0.69±0.02 c 0.72±0.03 b 0.65±0.03 d 0.61±0.02 d MT 1.04±0.01 a 1.00±0.01 a 0.94±0.02 a 0.94±0.02 a 0.93±0.03 a 0.95±0.03 a AI+MT 0.88±0.01 c 0.78±0.03 c 0.75±0.01 b 0.79±0.01 c 0.71±0.01 c 0.70±0.02 c 表 6 外源MT对铝胁迫下番茄铝富集效能的影响
Table 6 Effect of MT on Al-accumulation of tomato plants under Al-stress
品种 处理 Al含量 Al content/(mg·kg-1) Al富集系数 Al enrichment factor 转运系数
Coefficient of transshipment根
Root茎
Stem叶
Leaf土壤
Soil根
Root茎
Stem叶
Leaf千禧 Qianxi CK 0.13±0.00 c 0.10±0.00 b 0.07±0.01 c 0.83±0.03 bc 0.16±0.01 b 0.12±0.01 b 0.08±0.01 ab 1.29±0.005 a Al 0.22±0.02 a 0.14±0.00 a 0.10±0.02 ab 1.02±0.01 a 0.21±0.02 a 0.14±0.01 a 0.10±0.01 a 1.16±0.003 b MT 0.12±0.02 c 0.07±0.01 b 0.06±0.01 b 0.86±0.02 c 0.15±0.02 b 0.09±0.01 c 0.07±0.02 b 1.09±0.002 c Al+MT 0.18±0.01 b 0.13±0.01 a 0.09±0.01 ab 1.11±0.03 ab 0.17±0.01 b 0.12±0.02 b 0.08±0.01 b 1.20±0.002 b 普罗旺斯 Puluo wangsi CK 0.11±0.01 b 0.09±0.01 b 0.05±0.01 b 0.82±0.06 c 0.13±0.01 a 0.11±0.02 ab 0.06±0.01 b 1.37±0.003 b Al 0.15±0.01 a 0.13±0.01 a 0.09±0.001 a 1.02±0.01 ab 0.15±0.03 a 0.13±0.01 a 0.09±0.01 a 1.47±0.004 a MT 0.10±0.01 b 0.08±0.01 b 0.05±0.006 b 0.85±0.03 bc 0.12±0.01 a 0.10±0.01 b 0.06±0.01 b 1.38±0.002 b Al+MT 0.14±0.01 a 0.12±0.01 a 0.08±0.002 a 1.10±0.01 a 0.14±0.01 a 0.11±0.01 b 0.07±0.01 ab 1.32±0.001 c -
[1] KIMMEL K, FUREY G N, HOBBIE S E, et al. Diversity-dependent soil acidification under nitrogen enrichment constrains biomass productivity [J]. Global Change Biology, 2020, 26(11): 6594−6603. DOI: 10.1111/gcb.15329
[2] RIAZ M, YAN L, WU X W, et al. Boron reduces aluminum-induced growth inhibition, oxidative damage and alterations in the cell wall components in the roots of trifoliate orange [J]. Ecotoxicology and Environmental Safety, 2018, 153: 107−115. DOI: 10.1016/j.ecoenv.2018.02.002
[3] YANG Y, MA L, ZENG H, et al. iTRAQ-based proteomics screen for potential regulators of wheat (Triticum aestivum L. ) root cell wall component response to Al stress [J]. Gene, 2018, 675: 301−311. DOI: 10.1016/j.gene.2018.07.008
[4] 黄凯, 张红宇, 张菡倩, 等. 植物应答铝毒的分子机制研究进展 [J]. 生物技术通报, 2021, 37(3):125−135. HUANG K, ZHANG H Y, ZHANG H Q, et al. Research progress on the molecular mechanism of plants response to aluminum toxicity [J]. Biotechnology Bulletin, 2021, 37(3): 125−135.(in Chinese)
[5] GATSIOS A, NTATSI G, YFANTOPOULOS D, et al. Effects of different organic soil amendments on nitrogen nutrition and yield of organic greenhouse tomato crop [J]. Nitrogen, 2021, 2(3): 347−358. DOI: 10.3390/nitrogen2030024
[6] YANG Q A, PENG Z P, MA W N, et al. Melatonin functions in priming of stomatal immunity in Panax notoginseng and Arabidopsis thaliana [J]. Plant Physiology, 2021, 187(4): 2837−2851. DOI: 10.1093/plphys/kiab419
[7] ZAHEDI S M, HOSSEINI M S, FAHADI H N, et al. Exogenous melatonin mitigates salinity-induced damage in olive seedlings by modulating ion homeostasis, antioxidant defense, and phytohormone balance [J]. Physiologia Plantarum, 2021, 173(4): 1682−1694. DOI: 10.1111/ppl.13589
[8] SAMI A, SHAH F A, ABDULLAH M, et al. Melatonin mitigates cadmium and aluminium toxicity through modulation of antioxidant potential in Brassica napus L [J]. Plant Biology, 2020, 22(4): 679−690. DOI: 10.1111/plb.13093
[9] POSMYK M M, KURAN H N, MARCINIAK K, et al. Presowing seed treatment with melatonin protects red cabbage seedlings against toxic copper ion concentrations [J]. Journal of Pineal Research, 2008, 45(1): 24−31. DOI: 10.1111/j.1600-079X.2007.00552.x
[10] 赵海亮, 左璐, 马长恩, 等. 果实膨大期叶面喷施褪黑素对番茄品质的影响 [J]. 北方园艺, 2021(17):15−21. ZHAO H L, ZUO L, MA C E, et al. Effects of foliar spraying melatonin on fruit quality of tomato during fruit expansion [J]. Northern Horticulture, 2021(17): 15−21.(in Chinese)
[11] 许秋怡, 陈兆晖, 季富宴, 等. 褪黑素增强盐害条件下水稻幼苗对稻瘟病的抗病能力 [J]. 安徽农业科学, 2018, 46(9):126−128. XU Q Y, CHEN Z H, JI F Y, et al. Melatonin enhancing resistance of rice seedlings to rice blast under salt stress [J]. Journal of Anhui Agricultural Sciences, 2018, 46(9): 126−128.(in Chinese)
[12] ZHAO C F, YANG M, WU X, et al. Physiological and transcriptomic analyses of the effects of exogenous melatonin on drought tolerance in maize (Zea mays L. ) [J]. Plant Physiology and Biochemistry, 2021, 168: 128−142. DOI: 10.1016/j.plaphy.2021.09.044
[13] 李阳, 陈静, 刘绍东, 等. 外源褪黑素对盐胁迫下棉花幼苗生长及光合特性的影响 [J]. 新疆农业科学, 2021, 58(8):1418−1426. LI Y, CHEN J, LIU S D, et al. Effects of exogenous melatonin on growth and photosynthetic characteristics of cotton seedlings under salt stress [J]. Xinjiang Agricultural Sciences, 2021, 58(8): 1418−1426.(in Chinese)
[14] 李方一, 黄璜, 官春云. 作物叶面积测量的研究进展 [J]. 湖南农业大学学报(自然科学版), 2021, 47(3):274−282. LI F Y, HUANG H, GUAN C Y. Review on measurement of crop leaf area [J]. Journal of Hunan Agricultural University (Natural Sciences), 2021, 47(3): 274−282.(in Chinese)
[15] SHIBAEVA T G, MAMAEV A V, SHERUDILO E G. Evaluation of a SPAD-502 plus chlorophyll meter to estimate chlorophyll content in leaves with interveinal chlorosis [J]. Russian Journal of Plant Physiology, 2020, 67(4): 690−696. DOI: 10.1134/S1021443720040160
[16] 努尔凯麦尔·木拉提, 杨亚杰, 帕尔哈提·阿布都克日木, 等. 小麦叶绿素含量测定方法比较 [J]. 江苏农业科学, 2021, 49(9):156−159. NURKHEIMER M, YANG Y J, PARHATI A, et al. Comparative study on determination methods of chlorophyll content in wheat [J]. Jiangsu Agricultural Sciences, 2021, 49(9): 156−159.(in Chinese)
[17] LIU Y, ZHANG J M. Lanthanum promotes bahiagrass (Paspalum notatum) roots growth by improving root activity, photosynthesis and respiration [J]. Plants, 2022, 11(3): 382. DOI: 10.3390/plants11030382
[18] 王敏, 宁秋燕, 石元值. 茶树幼苗对不同浓度铝的生理响应差异研究 [J]. 茶叶科学, 2017, 37(4):356−362. WANG M, NING Q Y, SHI Y Z. Study on physiological response of tea plant(Camellia sinensis) seedlings to different aluminum concentrations [J]. Journal of Tea Science, 2017, 37(4): 356−362.(in Chinese)
[19] ARNAO M B, HERNÁNDEZ-RUIZ J. Melatonin: A new plant hormone and/or a plant master regulator? [J]. Trends in Plant Science, 2019, 24(1): 38−48. DOI: 10.1016/j.tplants.2018.10.010
[20] 李格, 孟小庆, 蔡敬, 等. 活性氧在植物非生物胁迫响应中功能的研究进展 [J]. 植物生理学报, 2018, 54(6):951−959. LI G, MENG X Q, CAI J, et al. Advances in the function of reactive oxygen species in plant responses to abiotic stresses [J]. Plant Physiology Journal, 2018, 54(6): 951−959.(in Chinese)
[21] JIAO C J, LAN G P, SUN Y H, et al. Dopamine alleviates chilling stress in watermelon seedlings via modulation of proline content, antioxidant enzyme activity, and polyamine metabolism [J]. Journal of Plant Growth Regulation, 2021, 40(1): 277−292. DOI: 10.1007/s00344-020-10096-2
[22] 蒋希瑶, 黄俊杰, 周英杰, 等. 不同浓度外源褪黑素对NaHCO3胁迫下番茄幼苗生长和生理指标的影响 [J]. 北方园艺, 2022(9):1−9. JIANG X Y, HUANG J J, ZHOU Y J, et al. Effects of exogenous melatonin on growth and physiological indexes of tomato seedlings under NaHCO3 stress [J]. Northern Horticulture, 2022(9): 1−9.(in Chinese)
[23] 杜昕, 李博, 毛鲁枭, 等. 褪黑素对干旱胁迫下大豆产量及AsA-GSH循环的影响 [J]. 作物杂志, 2022(1):174−178. DU X, LI B, MAO L X, et al. Effects of melatonin on yield and AsA-GSH cycle in soybean under drought stress [J]. Crops, 2022(1): 174−178.(in Chinese)
[24] 陈奋奇, 方鹏, 白明兴, 等. 外源脯氨酸缓解玉米幼苗盐胁迫的效应 [J]. 草业科学, 2022, 39(4):747−755. CHEN F Q, FANG P, BAI M X, et al. Mitigation of salt stress in maize seedlings by exogenous proline application [J]. Pratacultural Science, 2022, 39(4): 747−755.(in Chinese)
[25] GUO M X, ZHANG X T, LIU J J, et al. OsProDH negatively regulates thermotolerance in rice by modulating proline metabolism and reactive oxygen species scavenging [J]. Rice, 2020, 13(1): 61. DOI: 10.1186/s12284-020-00422-3
[26] 吕婷. 褪黑素对小麦铝毒的缓解作用及其机理研究[D]. 杭州: 浙江大学, 2018. LV T. The role of melatonin in alleviating aluminum toxicity in wheat(Triticum aestivum L. )genotypes differing in aluminum tolerance[D]. Hangzhou: Zhejiang University, 2018. (in Chinese)
[27] HOU X L, HAN H, CAI L P, et al. Pb stress effects on leaf chlorophyll fluorescence, antioxidative enzyme activities, and organic acid contents of Pogonatherum crinitum seedlings [J]. Flora, 2018, 240: 82−88. DOI: 10.1016/j.flora.2018.01.006
[28] 尹赜鹏, 王珍琪, 齐明芳, 等. 外施褪黑素对盐胁迫下番茄幼苗光合功能的影响 [J]. 生态学杂志, 2019, 38(2):467−475. DOI: 10.13292/j.1000-4890.201902.023 YIN Z P, WANG Z Q, QI M F, et al. Effects of melatonin application on photosynthetic function in tomato seedlings under salt stress [J]. Chinese Journal of Ecology, 2019, 38(2): 467−475.(in Chinese) DOI: 10.13292/j.1000-4890.201902.023
[29] HOSSEIN P A, ÖZKAN G, BALPINAR N Ö, et al. Estimation of genomic instability and DNA methylation due to aluminum (Al) stress in wheat (Triticum aestivum L. ) using iPBS and CRED-iPBS analyses [J]. Turkish Journal of Botany, 2019, 43(1): 27−37. DOI: 10.3906/bot-1804-23
[30] ACHARY V M M, PARINANDI N L, PANDA B B. Calcium channel blockers protect against aluminium-induced DNA damage and block adaptive response to genotoxic stress in plant cells [J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2013, 751(2): 130−138. DOI: 10.1016/j.mrgentox.2012.12.008
[31] HE S J, HU Y J, WANG H B, et al. Effects of indole-3-acetic acid on arsenic uptake and antioxidative enzymes in Pteris cretica var. nervosa and Pteris ensiformis [J]. International Journal of Phytoremediation, 2017, 19(3): 231−238. DOI: 10.1080/15226514.2016.1207609
[32] NAZIR H, ASGHAR H N, AHMAD Z Z, et al. Judicious use of kinetin to improve growth and yield of rice in nickel contaminated soil [J]. International Journal of Phytoremediation, 2016, 18(7): 651−655. DOI: 10.1080/15226514.2015.1094444





 下载:
下载: