Effects of Cd Stress on Biomass and Photosynthesis Fluorescence Characteristics of Magnolia officinalis
-
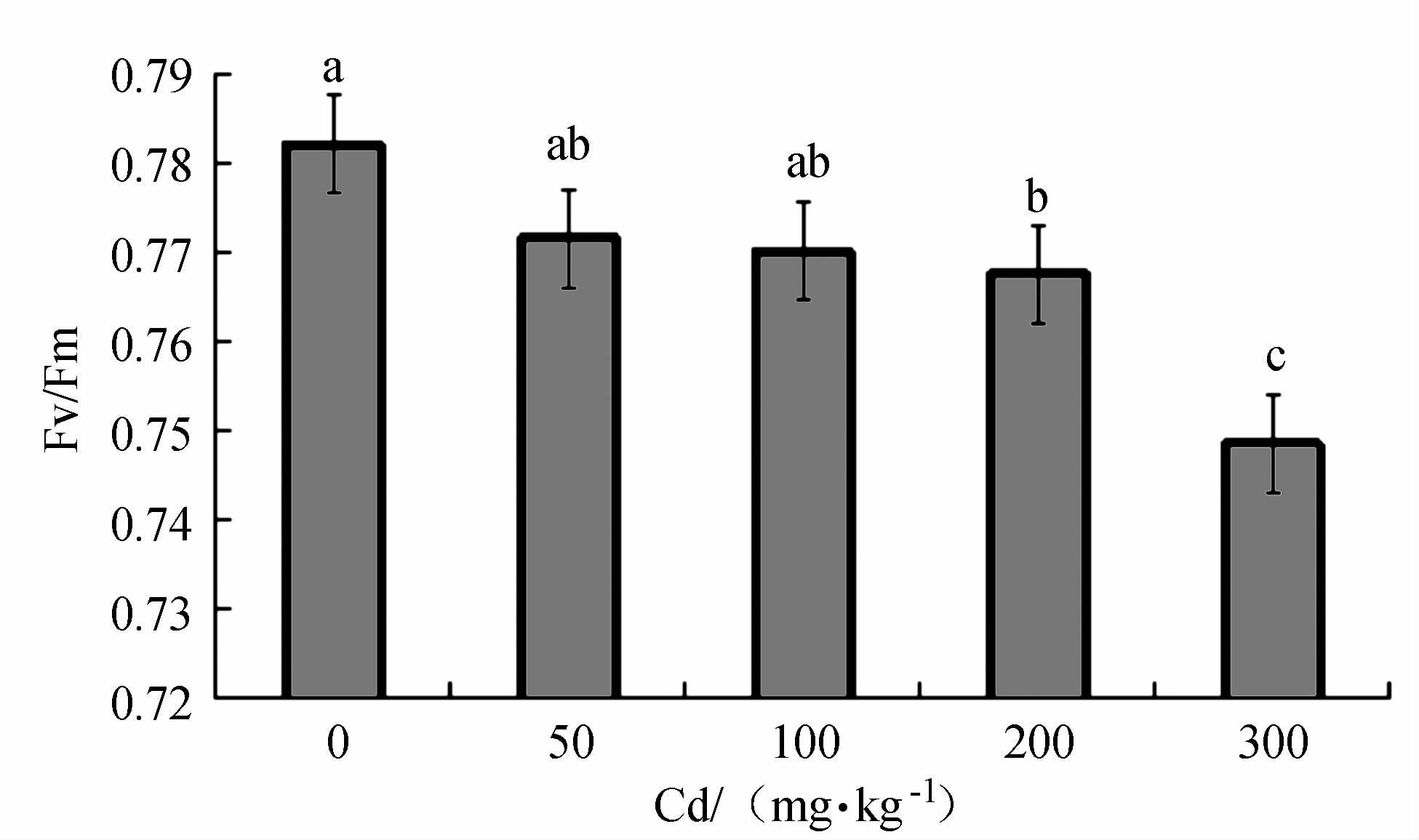
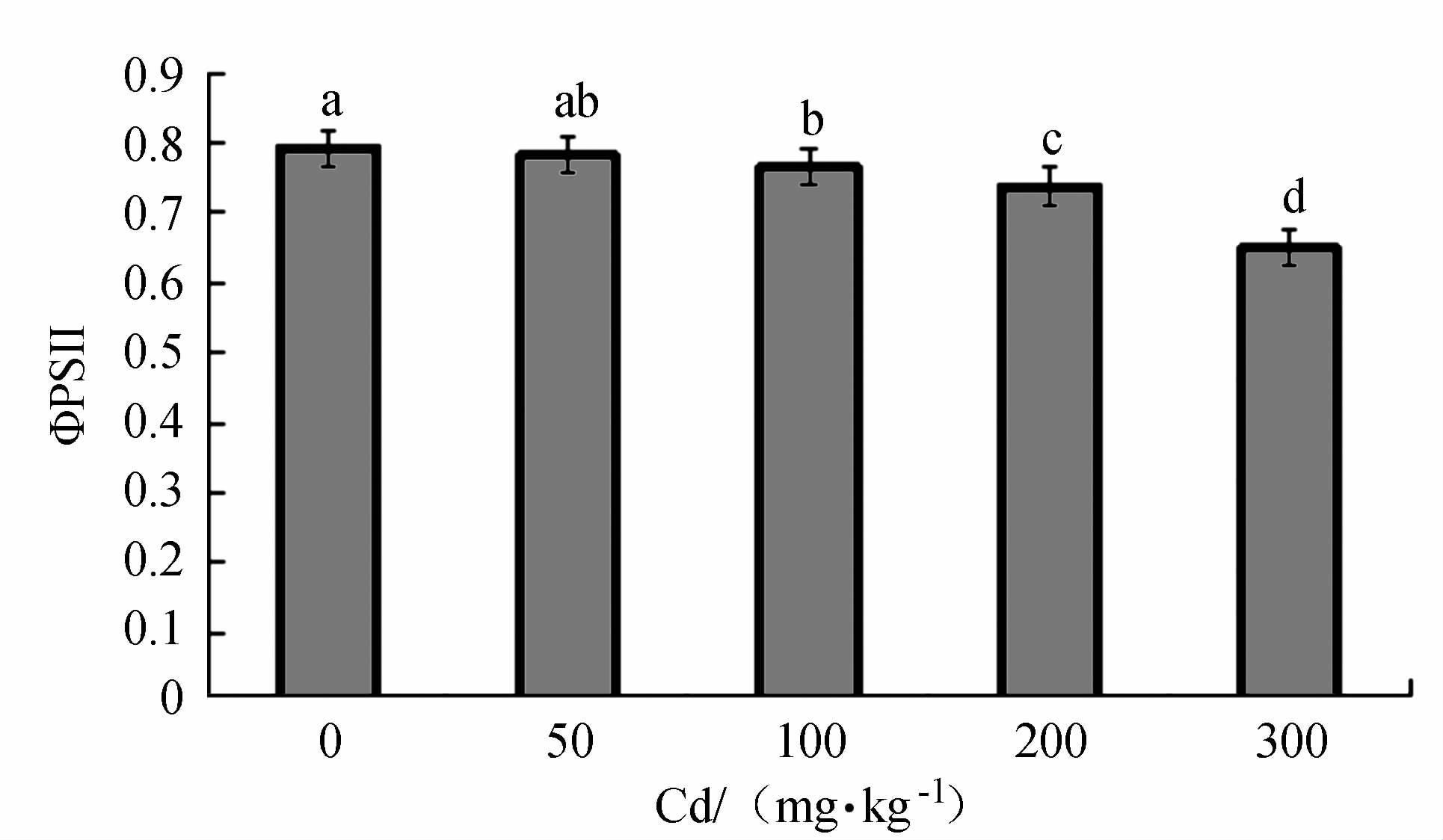
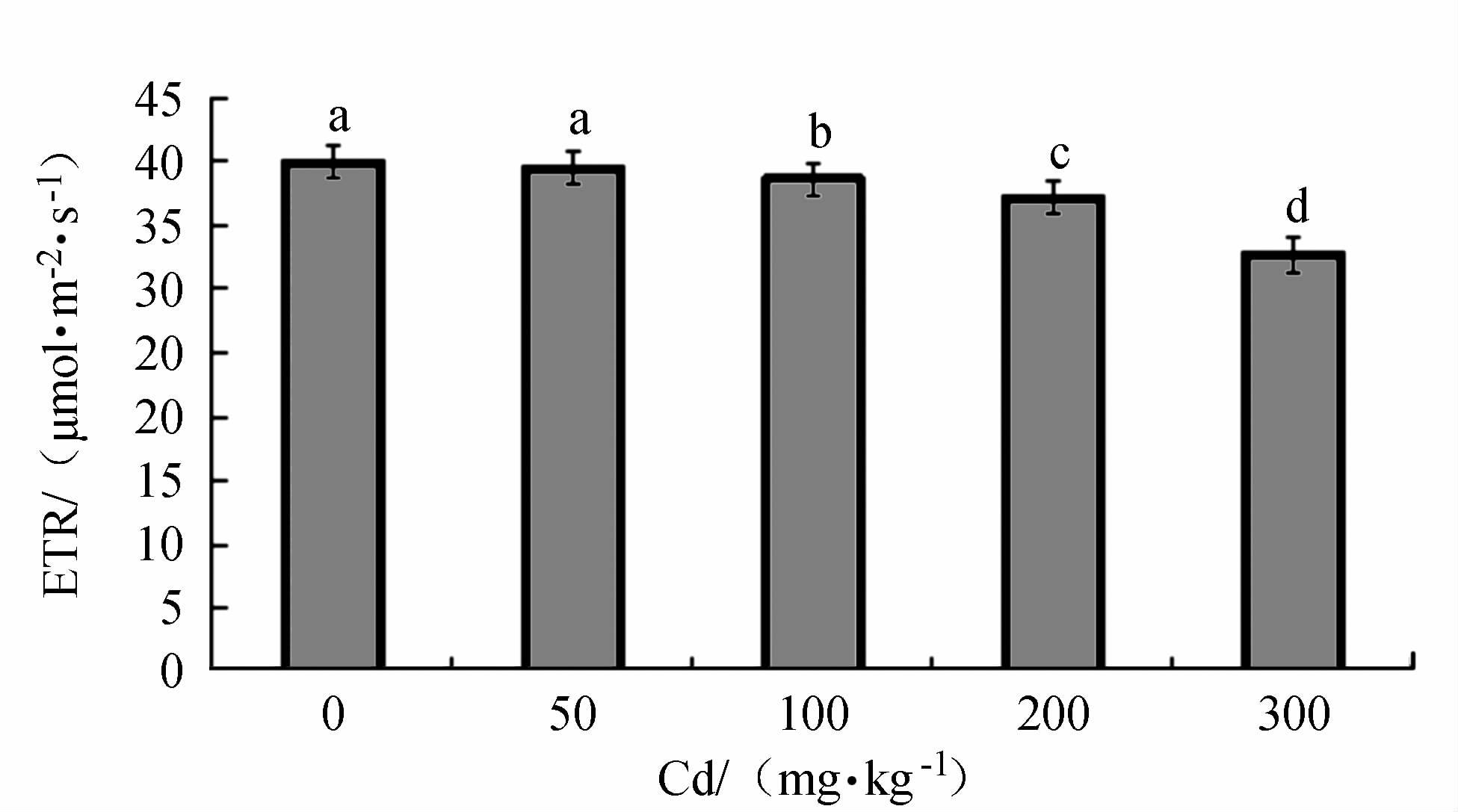
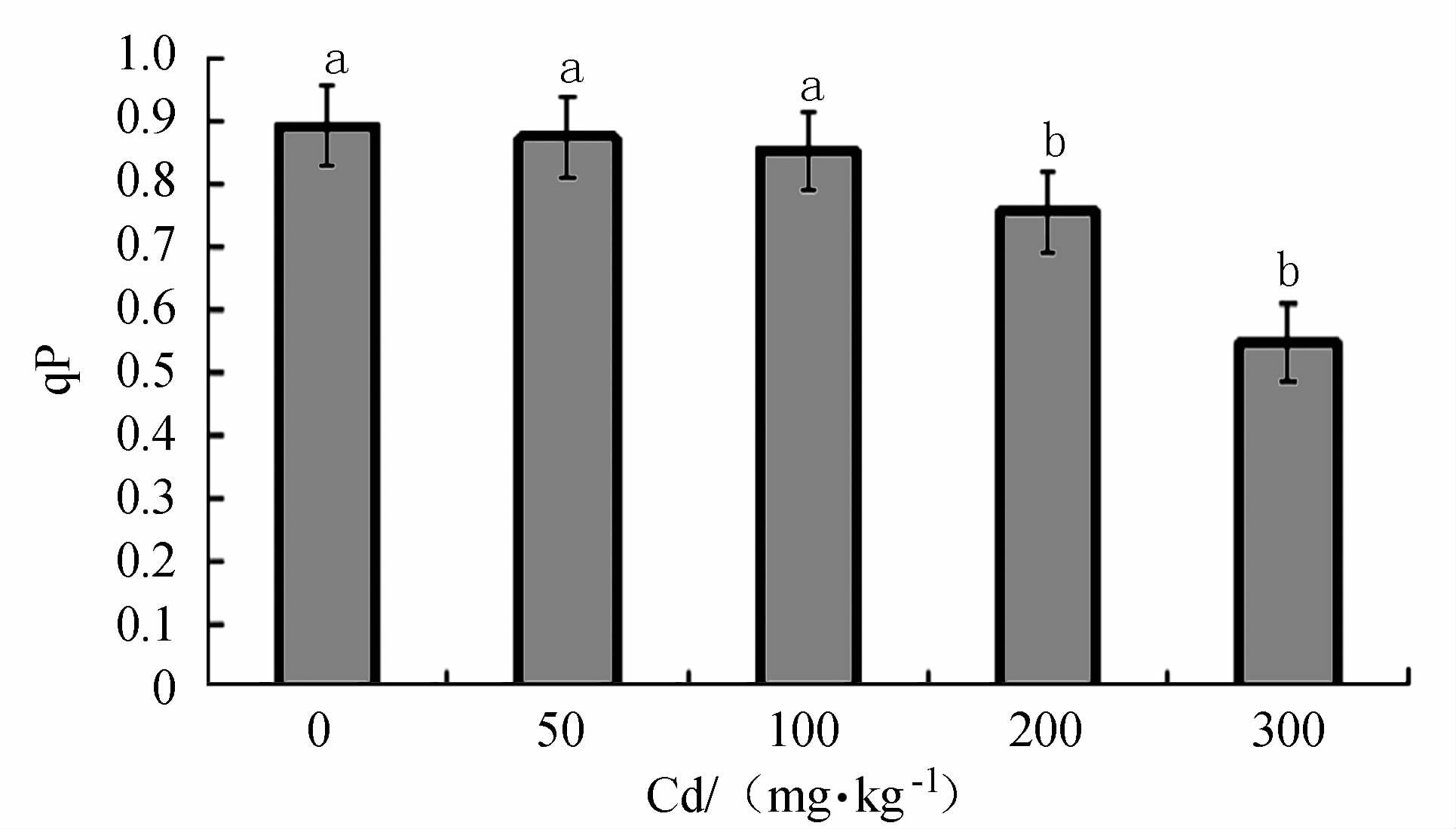
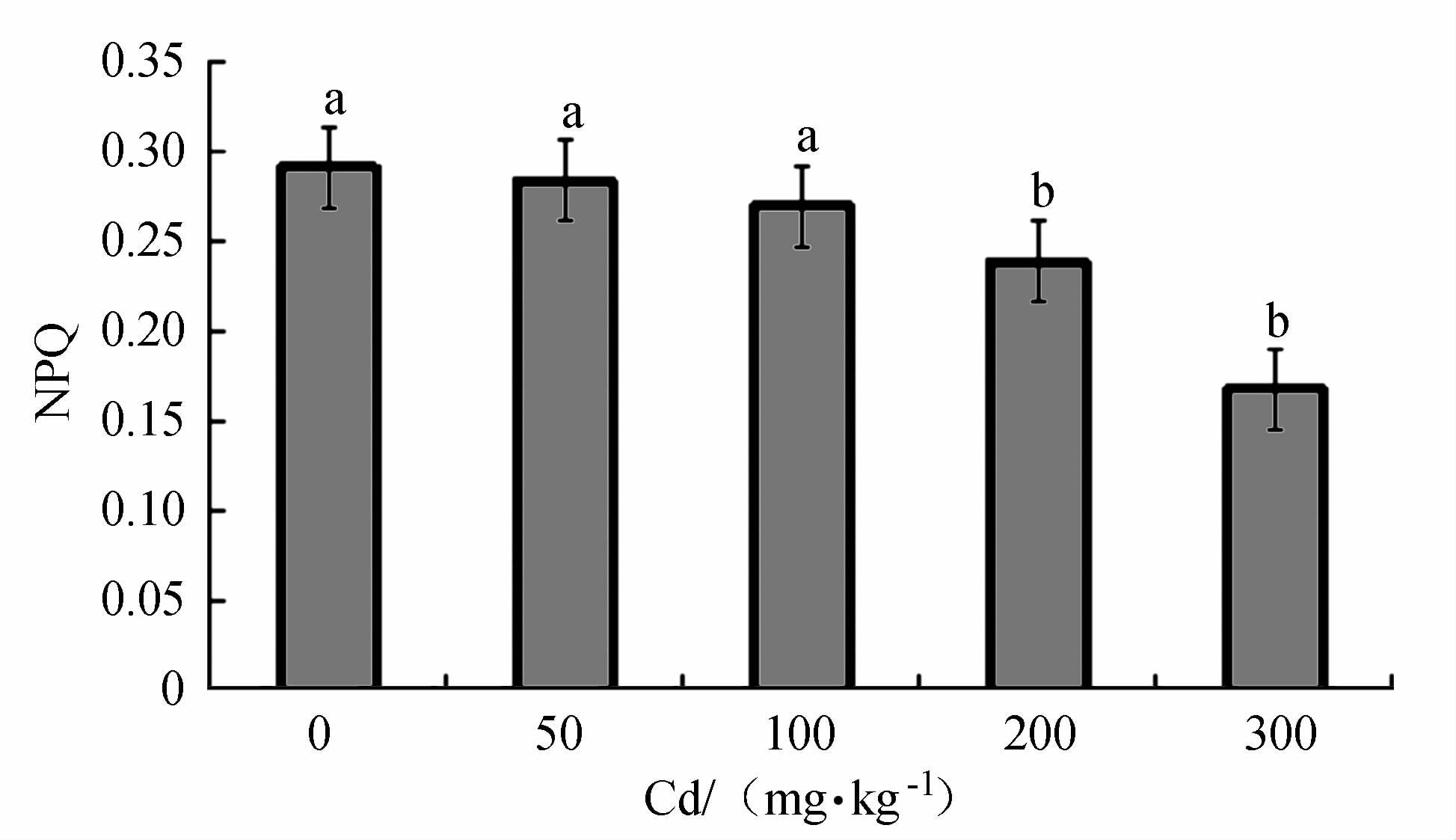
摘要: 以2年生的凹叶厚朴幼苗为试验对象,设置0(CK)、50、100、200和300 mg·kg-1等5个梯度,研究Cd胁迫对厚朴幼苗生物量、叶绿素SPAD值、各组织部分Cd含量和叶绿素荧光合特性的影响。厚朴幼苗根干质量Cd积累最高达325.76 mg·kg-1,地上部分干质量Cd积累最高仅为13.56 mg·kg-1,而根部Cd积累量占到全株Cd积累量的95.71%~96.23%,其地下组织部分Cd含量高于地上组织部分,说明厚朴幼苗根吸收的镉主要积累在根部。厚朴幼苗株高增长量随Cd含量的增加而下降,在高Cd胁迫下,叶绿素SPAD值呈差异极显著变化,低Cd胁迫下厚朴仍能生长和代谢,说明厚朴有一定的适应性。4个Cd处理下厚朴幼苗的PSⅡ的最大量子产量(Fv/Fm)、实际的光化学有效量子产量(ΦPSⅡ)、化学淬灭(qP)、电子传递效率(ETR)与CK组相比均显著下降,说明Cd处理阻碍了凹叶厚朴叶片光合反应链中电子传递,进而影响PSⅡ反应中心活性,改变了对光能捕获与转换及电子传递效率,产生光抑制,进而造成对植物的损伤。Abstract: Two-year-old Magnolia officinalis seedlings were used in this experimentation. Effects of Cd stress on the biomass, chlorophyll SPAD value, and chlorophyll fluorescence characteristics, as well as Cd contents in various parts of the plant, under 5 gradients of Cd stress including 0 (CK), 50, 100, 200, and 300 mg·kg-1 were studied to unveil the underlying mechanism. In the seedling plants and parts, it was found that the highest accumulated Cd concentrations (dry weight) were 325.76 mg·kg-1 in the roots, and 13.56 mg·kg-1 in the aboveground parts. In general, 95.71%-96.23% of the total Cd accumulated on the plant were found in the roots. The seedling height decreased with increasing Cd concentration. Compared with CK, all treatment groups except 50 mg·kg-1, showed significant decreases on SPAD chlorophyll. When the Cd concentration was low, the plants appeared to adapt and continue to grow and metabolize. Nonetheless, the PSII maximum quantum yield (Fv/Fm), actual photochemical quantum yield (ΦPSⅡ), chemical quenching (qP), and electron transport efficiency (ETR) were significantly decreased due to high Cd stress as compared to CK indicating that the energy capture from the sunlight, ETR, PSII activity, and metabolism were all suppressed resulting in damage to the plant.
-
Cd是对生物体具有高度毒性的重金属元素,其中菜园土壤受Cd污染的问题日益严重。因Cd可在土壤中长期滞留,极易被蔬菜等作物吸收,一方面造成重金属胁迫逆境,影响作物产量和品质,另一方面造成Cd超标,危害人体健康。丛枝菌根Arbuscular mycorrhiza,AM真菌广泛存在于土壤中,可与宿主植物根系形成良好的共生关系,对促进植物生长和提高植物抗逆性均有重要作用。相关报道显示,黄瓜、番茄等蔬菜接种AM真菌后,对于盐胁迫[1]、低温胁迫[2]、Co胁迫[3]及As胁迫[4]的抗性增强;同时AM真菌也是目前应对土壤重金属污染的微生物修复剂的主要成分,对于缓解重金属胁迫伤害以及改善重金属土壤环境具有重要意义。
本试验以黄瓜为试材,采用基质栽培方式,以富含AM真菌的育苗基质进行育苗,研究受AM真菌侵染的黄瓜幼苗在Cd胁迫条件下的生长、叶片光合参数、叶绿素荧光以及活性氧代谢相关酶活性的变化,可对缓解重金属对蔬菜的危害、提高蔬菜产量及品质以及菌根基质的开发提供实践依据。
1. 材料和方法
1.1 试验材料
试验于2015年5月至2016年2月在河北农业大学农林教学基地内进行。供试品种为黄瓜“津优一号”,由天津黄瓜所提供。菌根基质购自江苏柴米河公司;进行生理指标测定的药剂均为分析纯试剂。
1.2 试验设计
选用50孔穴盘,分别采用普通育苗基质和富含AM真菌混合菌剂的育苗基质进行黄瓜幼苗的培养,播种30d后将已被AM真菌侵染的黄瓜幼苗定植于基质栽培槽中,栽培基质采用蛭石。试验设计如下:(1) CK:正常栽培,不添加Cd2+;(2) Cd1:定植普通基质育苗的黄瓜幼苗,栽培槽内Cd2+添加浓度为0.2 mmol·L-1;(3) Cd1+AM:定植菌根基质育苗的黄瓜幼苗,Cd2+添加浓度为0.2 mmol·L-1;(4) Cd2:定植普通基质育苗的黄瓜幼苗,栽培槽内Cd2+添加浓度为0.4 mmol·L-1;(5) Cd2+AM:定植菌根基质育苗的黄瓜幼苗,Cd2+添加浓度为0.4 mmol·L-1。
每处理定植40株,于定植后第30 d测定下列指标,重复3次。
1.3 指标测定
1.3.1 生长指标的测定
用直尺测定主枝高度作为株高;用数显游标卡尺测定茎基部2 cm处直径作为茎粗;用AM-350便携式叶面积仪测定顶数第二片叶的叶面积;采用TTC法测定根系活力[5]。整株取出幼苗,用去离子水清洗后吸干水分,从根茎部位剪开幼苗,用分析天平称量幼苗地下部和地上部鲜重;80℃烘干24 h后用分析天平称量干重;根冠比采用公式计算:地下部干重/地上部干重。
1.3.2 光合参数及叶绿素荧光参数的测定
采用便携式光合速率测定仪(L-iCor6400型, 美国L-iCor公司)测定生长点下第2片展开叶的净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳浓度(Ci)、蒸腾速率(Tr)[6]。采用Mini-Imaging-PAM调制叶绿素荧光成像系统(德国,WALZ公司)测定PSⅡ最大光化学效率(Fv/Fm)、光合电子传递速率(ETR)、PSⅡ实际量子效率(фPSII)、光化学猝灭系数(qP)、非光化学猝灭系数(NPQ)。测定条件参照罗黄颖等[7]方法。采用叶绿素测定仪(SPAD-502,美国)进行叶色指数测定。
1.3.3 抗氧化酶活性测定
超氧化物歧化酶(SOD)活性测定参考Giannopolitis等[8]测定;过氧化物酶(POD)活性测定采用曾韶西等[8]方法;过氧化氢酶(CAT)活性测定采用Dhindsa等[9]方法。
1.3.4 超氧阴离子(O⋅_2)产生速率和H2O2含量测定
O⋅_2产生速率测定采用王爱国[10]等的方法。
1.3.5 丙二醛(MDA)含量的测定
丙二醛(MDA)含量测定采用Heath[11]的方法。
1.4 统计分析
使用Microsoft Excel软件对数据进行处理,采用SAS 8.1软件Duncan多重比较法(α=0.05)进行方差分析。
2. 结果与分析
2.1 丛枝菌根对Cd胁迫下黄瓜幼苗生长的影响
由表 1可知,与对照相比,黄瓜幼苗在2个浓度的Cd胁迫下均表现为生长指标的显著下降,各指标出现随Cd浓度上升而下降的现象。经菌根基质育苗后的黄瓜苗根系活力较Cd胁迫处理均显著提高,同时Cd1+AM处理的叶面积也显著提高。对比菌根基质育苗对2个浓度Cd胁迫处理的效果,可以看出虽然Cd1+AM处理和Cd2+AM处理的各生长指标均较胁迫处理有一定提高,但受菌根侵染的幼苗对于较低浓度(0.2 mmol·L-1)的Cd胁迫的缓解作用更好,对于各指标的提高优于对较高浓度(0.4 mmol·L-1)的Cd胁迫处理的效果。
表 1 丛枝菌根基质对Cd胁迫下黄瓜幼苗生长的影响Table 1. Effect of substrates inoculated with arbuscular mycorrhizal on the growth of cumcuber seedling under Cadmium stress处理 株高/cm 茎粗/cm 叶面积/cm2 根系活力/
(μg·g-1·h-1)CK 65.52±2.92a 1.08±0.02a 47.22±1.55a 186.25±4.50a Cd1 52.46±0.90b 0.92±0.01b 39.26±0.74c 119.63±8.93c Cd1+AM 56.81±0.60b 0.95±0.01b 43.46±0.40b 151.79±4.42b Cd2 49.63±0.99b 0.89±0.11b 35.59±0.82b 117.11±6.78c Cd2+ AM 52.84±0.29b 0.92±0.01b 37.92±0.96b 141.43±3.47b 注:同列数据后不同小写字母表示差异达显著(P < 0.05)水平。表 2~5同。 2.2 丛枝菌根对Cd胁迫下黄瓜幼苗生长量的影响
从表 2可以看出,2个浓度的Cd胁迫下的黄瓜幼苗地上和地下干鲜重均显著低于对照处理,且0.2 mmol·L-1的Cd胁迫处理各指标均高于0.4 mmol·L-1处理。菌根基质育苗显著提高了0.2 mmol·L-1的Cd胁迫处理的黄瓜幼苗地上和地下干鲜重;同时显著提高了0.4 mmol·L-1的Cd胁迫处理的黄瓜幼苗地上鲜重和地下干鲜重。同时,菌根基质育苗处理均提高了黄瓜幼苗的根冠比。说明,AM菌根通过促进植株生长,提高幼苗的生长量,来应对Cd胁迫,但其对于较低浓度(0.2 mmol·L-1)的Cd胁迫作用更好。
表 2 丛枝菌根基质对Cd胁迫下黄瓜幼苗生长量的影响Table 2. Effect of substrate inoculated with arbuscular mycorrhizal on growth of cucumber seedlings under Cd-stress处理 地上部鲜重
/g地上部干重
/g地下部鲜重
/g地下部干重
/g根冠比 CK 96.38±1.86a 8.07±0.15a 10.18±0.17a 0.93±0.03a 0.115±0.0004a Cd1 81.56±3.16b 7.10±0.08c 8.06±0.09c 0.75±0.02c 0.106±0.0006c Cd1+ AM 91.33±0.65a 7.59±0.15b 8.75±0.17b 0.83±0.01b 0.109±0.0007b Cd2 73.96±1.11c 6.87±0.10b 7.16±0.09c 0.63±0.02c 0.092±0.0086b Cd2+ AM 81.66±0.48b 7.33±0.05b 8.03±0.05b 0.73±0.02b 0.010±0.0008ab 2.3 丛枝菌根对Cd胁迫下黄瓜幼苗光合作用的影响
如表 3所示,黄瓜幼苗叶片经Cd胁迫处理的后Pn、Gs、Tr显著降低,而Ci则显著上升。菌根基质育苗的幼苗则表现为显著提高了0.2 mmol·L-1的Cd胁迫处理的黄瓜幼苗叶片Tr指标,并显著降低了Ci,Pn、Gs也有了一定提高。菌根处理对于0.4 mmol·L-1的Cd胁迫处理的黄瓜幼苗叶片光合参数的改善效果优于对于0.2 mmol·L-1的Cd胁迫处理的效果,表现为Pn、Gs、Tr显著提高,而Ci显著下降。说明菌根处理可有效缓解Cd胁迫对于黄瓜叶片光合作用的抑制。
表 3 丛枝菌根基质对Cd胁迫下黄瓜幼苗光合参数的影响Table 3. Effect of substrates inoculated with arbuscular mycorrhizal on photosynthetic parameters in leaves of cumcuber seedling under Cadmium stress处理 净光合速率Pn
/(μmol·m-2·s-1)气孔导度Gs
/(μmol·m-2·s-1)蒸腾速率Tr
/(mmol·m-2·s-1)胞间CO2浓度Ci
/(μL·L-1)CK 14.91±0.34a 0.194±0.004a 8.250±0.22a 237.75±7.70c Cd1 12.19±0.18b 0.176±0.003b 5.460±0.29c 307.57±7.11a Cd1+ AM 13.20±0.34b 0.186±0.003ab 6.903±0.08b 269.13±6.28b Cd2 10.89±0.08c 0.167±0.003c 5.037±0.47c 336.29±3.91a Cd2+ AM 12.49±0.27b 0.180±0.001b 6.373±0.26b 276.51±1.44b 2.4 丛枝菌根对Cd胁迫下黄瓜幼苗叶绿素荧光参数的影响
与对照相比,Cd胁迫使叶片叶色指数和叶绿素荧光参数均发生显著变化,其中叶色指数显著降低,同时PSⅡ系统的活性也受到显著抑制,表现为Fv/Fm、ETR、qP、фPSⅡ的显著降低和NPQ的显著上升。菌根处理可显著提高Cd胁迫黄瓜叶片的Fv/Fm、ETR、qP、фPSⅡ及0.4 mmol·L-1的Cd胁迫处理的叶色指数。说明AM真菌可有效提高两个浓度Cd胁迫叶片的光合系统效率,从而减轻Cd胁迫对光合系统和细胞膜的伤害(表 4)。
表 4 丛枝菌根基质对Cd胁迫下黄瓜幼苗叶绿素荧光参数的影响Table 4. Effect of substrates inoculated with arbuscular mycorrhizal on chlorophyll fluorescence parameters in leaves of cumcuber seedling under Cadmium stress处理 叶色指数 PSⅡ的最大光
化学效率光合电子
传递速率PSⅡ实际
量子效率光化学
淬灭系数非光化学
淬灭系数CK 43.39±1.46a 0.824±0.004a 46.20±0.58a 0.583±0.010a 0.833±0.009a 0.247±0.009c Cd1 36.52±0.91b 0.779±0.009b 33.51±1.37c 0.473±0.050c 0.750±0.006c 0.343±0.009a Cd1+ AM 39.80±0.43b 0.805±0.002a 39.51±0.67b 0.530±0.006b 0.793±0.007b 0.283±0.009b Cd2 34.81±0.56c 0.750±0.009c 29.64±0.49c 0.417±0.009c 0.687±0.019c 0.400±0.015a Cd2+ AM 38.22±0.70b 0.789±0.006b 35.67±0.87b 0.487±0.012b 0.750±0.006b 0.343±0.007b 2.5 丛枝菌根对Cd胁迫下黄瓜幼苗叶片活性氧代谢的影响
如表 5所示,Cd胁迫处理的黄瓜幼苗叶片的抗氧化酶活性变化呈现两种趋势,SOD活性较对照显著降低,而POD、CAT活性显著提高;而MDA含量和O⋅_2产生速率也显著上升。2个浓度胁迫处理相比,随Cd添加浓度上升MDA含量和O⋅_2产生速率也上升。经菌根基质育苗后2个胁迫处理的叶片SOD、POD、CAT活性显著提高,并细胞内O⋅_2产生速率和MDA含量显著降低。说明菌根处理通过提高黄瓜叶片细胞内的抗氧化酶活性,降低细胞的活性氧含量,从而减轻Cd胁迫对于细胞的伤害。
表 5 丛枝菌根基质对Cd胁迫下黄瓜幼苗叶片活性氧代谢的影响Table 5. Effect of substrates inoculated with arbuscular mycorrhizal on metabolism of reactive oxygen species in leaves of cumcuber seedling under Cadmium stress处理 SOD
/(U·g-1FW)POD
/(U·g-1FW)CAT
/(U·g-1FW)O⋅_2
/(nmol·min-1 ·g-1 FW)MDA
/(μmol·g-1FW)CK 83.36±1.68b 208.29±4.29c 107.79±2.93c 0.70±0.01c 4.72±0.08b Cd1 51.71±4.85c 311.80±6.52b 146.79±4.40b 0.94±0.02a 6.52±0.37a Cd1+ AM 124.58±3.91a 367.80±11.17a 163.57±3.41a 0.83±0.02b 5.30±0.23b Cd2 44.95±1.83c 265.08±4.48b 139.04±1.84b 1.14±0.05a 7.45±0.32a Cd2+ AM 103.16±3.05a 301.44±1.53a 161.04±1.98a 0.89±0.01b 6.01±0.08b 3. 讨论与结论
近年来,随着工矿企业的粗放式增长,重金属已成为威胁耕地安全的污染源之一[12]。据统计,我国受重金属污染的耕地约10×106hm2, 占耕地总面积的8%以上,仅京津冀地区比例已超过10%[13]。而这种重金属积累不可降解,污染土壤的修复十分困难。因此,如何经济有效的修复重金属污染的土壤成为当前研究的热点。植物-微生物修复是近年来新兴的一种生物修复重金属污染土壤的手段,因其高效环保而被国内外学者广泛认可。大量研究表明,AM真菌侵染植物根系后可有效改善植物根际环境,影响植物对于重金属离子的吸收[14],增加植物对于重金属胁迫的适应性,达到缓解重金属胁迫伤害和修复重金属污染土壤的效果。因此,AM真菌在植物中的应用成为目前重金属胁迫研究以及修复污染土壤的常用手段之一。
黄瓜属我国栽培面积较广的蔬菜,根系抗性差,常作为多种逆境胁迫,尤其是重金属胁迫的研究材料。石爽等[15]以水培法研究了铅、砷污染对黄瓜种子萌发的影响,发现低浓度铅和砷溶液可促进种子的萌发和幼苗生长,高浓度则有抑制作用。Pb和NaCl复合胁迫对于黄瓜幼苗伤害机理的研究表明,叶片的叶绿素含量显著下降,而SOD、POD活性和MDA含量显著提高[16]。黄瓜水培条件下对于镉胁迫的响应表现为随胁迫时间延长,叶片光合作用及光合系统参数均显著下降[17]。本试验中采用基质栽培法,模拟重金属胁迫条件,在基质中添加了0.2 mmol·L-1和0.4 mmol·L-1两种浓度的Cd2+,比较了菌根育苗基质培育的幼苗和普通育苗基质培育的幼苗在Cd胁迫下的生长和生理特性。结果表明黄瓜幼苗生长、光合参数、叶绿素荧光参数和活性氧代谢指标均发生显著变化。Cd胁迫显著降低了黄瓜幼苗株高、茎粗、叶面积、根系活力、地上和地下干鲜重等生长指标,且表现为浓度效应,即较高浓度(0.4 mmol·L-1) Cd对于植株生长的抑制作用更明显。Verma等[18]认为Cd胁迫影响Fe的吸收,会引起植株Fe缺乏,且在高浓度镉处理中更明显,这可能也是Cd胁迫导致植物生长不良的原因之一。
黄瓜幼苗外观表现为生长不良现象的主要原因在于幼苗内部生理特性的变化。试验中发现Cd胁迫直接导致幼苗光合作用的减低和光合系统反应中心活性的下降。直接反映光合作用的指标,如Pn、Gs、Tr显著下降,而反映光合受抑制程度的Ci显著上升;表明光合系统受胁迫程度的Fv/Fm、ETR、фPSII等指标均显著下降,而NPQ较对照显著上升,说明Cd胁迫通过降低PSII系统的光化学效率,抑制光合系统电子传递效率,增加了光合系统产量的非光散失,导致光合系统活性降低,光合效率下降,从而抑制了植株光合作用,最终导致植株生长的减缓。活性氧代谢是反映生物体受胁迫程度的另一重要指标,Cd胁迫处理的黄瓜幼苗叶片的SOD活性显著降低,而POD、CAT、MDA含量和O⋅_2产生速率则显著上升,且出现细胞活性氧含量随Cd浓度上升而增加的现象。这与石爽等[15]结果一致。主要原因为植物在逆境下启动自我保护反应,机体通过提高抗氧化酶活性而降低有害于细胞的活性氧含量,从而减轻自身在逆境中所受伤害。
蔬菜由于其栽培位置靠近市郊,是当前受重金属污染最严重的作物之一。现有丛枝菌根真菌对于植物重金属胁迫的缓解作用的报道,主要集中于大田作物或林木[19-23],而对于蔬菜的研究较少[3-4];且采用的多为实验室接种和外源添加的手段,尚未见应用商品化菌根育苗基质进行生产研究的报道。黄瓜等瓜类蔬菜,根系与AM真菌共生状态好,由于其需经育苗移栽且育苗期长达3~4周,因此,应用富含AM真菌的菌根基质育苗除简化试验程序外,还可在提高抗逆性的同时,促进幼苗生长。采用的菌根基质育苗可经育苗过程令AM菌株活化,直接侵染黄瓜幼苗根系,育苗过程与普通穴盘育苗无异,操作简单,成本低,接近生产实践,且便于推广应用。本试验中菌根基质培育的幼苗对于不同浓度Cd胁迫处理的耐受性好于普通基质培育的幼苗。表现为幼苗根系活力、叶面积和地下干鲜重的显著提高,叶片光合参数和叶绿素荧光参数的改善以及POD、CAT氧化酶等抗氧化酶活性提高。这与已有的对于其他作物的研究结果一致。但本试验结果还表明,菌根处理对于不同浓度Cd胁迫处理幼苗的生长和生理特性改善效果存在一定差异,虽然均表现为促进植株生长和优化各生理相关参数,但AM菌根对于较低浓度的Cd胁迫处理(0.2 mmol·L-1)黄瓜幼苗各项生长和生理指标的改善效果好于对于较高浓度的Cd胁迫处理(0.4 mmol·L-1)的效果,说明针对较高浓度的重金属胁迫,还需进一步调整AM菌根基质的菌种成分和比例,使之更适用于缓解较严重Cd胁迫伤害,更大限度发挥其生物修复重金属污染土壤的效果。
-
表 1 福建省农林大学林学院苗圃试验地土壤基本理化性质
Table 1 Physio-chemical properties of soils in nursery experiment at Fujian Agriculture and Forestry University
pH值 有机质/% 全氮/(g·kg-1) 全磷/(g·kg-1) 全钾/(g·kg-1) 水解氮 有效磷(P2O5) /(g·kg-1) 速效钾(k2O) /(g·kg-1) 7.03 2.15 1.388 1.103 16.604 30.73 30.63 127.53 表 2 不同Cd胁迫下厚朴幼苗生物量及各组织部分Cd含量(x±s)
Table 2 Biomass and Cd content of tissues of seedlings under varied Cd stresses
Cd胁迫/(mg·kg-1) 根 地上部分 株高增长量/(cm·株-1) 干质量/(g·株-1) Cd含量/(mg·kg-1) 干质量/(g·株-1) Cd含量/(mg·kg-1) 0(CK) 12.8075±0.2443a 0 20.3625±0.2572a 0 29.6625±0.0625a 50(Cd1) 12.35±0.1335a 210.8925±0.8071a 16.845±0.2796b 9.265±0.0556a 30.295±0.2706a 100(Cd2) 11.2825±0.2643b 241.405±0.6018b 13.095±0.0633c 9.4525±0.0417b 28.25±0.3109b 200(Cd3) 9.9075±0.3456c 279.7675±0.569c 11.3375±0.2445d 12.5525±0.1191c 25.9025±0.3398c 300(Cd4) 7.27±0.3603d 312.1875±0.632d 8.8075±0.3924e 13.575±0.0854c 24.375±0.0328d 注:同列数据后不同小写字母代表0.05水平差异显著。下表同。 表 3 不同Cd胁迫对厚朴幼苗叶片鲜叶绿素SPAD含量的变化
Table 3 Changes on SPAD content of young leaves of magnolia Officinalis under Cd stress
Cd胁迫/(mg·kg-1) 叶绿素SPAD值 0 41.9833±0.92a 50 39.8833±0.7986ab 100 38.1667±0.9672ab 200 36.6833±1.6655b 300 35.85±1.1882b -
[1] MORENO-CASEI LES J,MORAL. A,PEREZ-ESPLNOSA R.Cadmium accumulation and distribution in cucumber plant[J]. Journal of Plant Nutrition, 2000,23(2):243-350. DOI: 10.1080/01904160009382011
[2] VASSILEV A, TSONEV T, YORDANOV I. Physiological response of barley plants(hordeum vulgare)to cadmium contamination in soil during ontogcncsis[J]. Environmental Pollution, 1998,103(2/3):287-293. http://cn.bing.com/academic/profile?id=2139429339&encoded=0&v=paper_preview&mkt=zh-cn
[3] LUX A, MARTINKA M, VACULIK M, et al. Root responses to cadmium in the rhizospherc:a rcvicw[J]. Journal of Expcrimcntal Botany,2011,62(1):21-37. DOI: 10.1093/jxb/erq281
[4] DALCORSO G. Heavy Metal Toxicity in Plants[M]. Furini A.Plants and Heavy Metals.New York:Springer Press,2012:1-26.
[5] 张鑫,李昆伟,陈康健,等. 镉胁迫对丹参生长及有效成分积累的影响研究[J]. 植物科学学报,2013,(6):583-589. http://www.cnki.com.cn/Article/CJFDTOTAL-WZXY201306010.htm [6] GENTY B,BRIANTAIS J M,BAKER N R.The relationship between quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J]. Biochimica and Biophysica Acta,1989,990(1):87-92. DOI: 10.1016/S0304-4165(89)80016-9
[7] BDEMMIG-ADAMS,WW ADAMS. XanthophyⅡ cycle and light stress in nature; uniform response to excess direct sunlight among higher plant species[J]. Planta, 1996,198(3):160-170. http://cn.bing.com/academic/profile?id=2027115096&encoded=0&v=paper_preview&mkt=zh-cn
[8] NMAXWELL K,JOHNSON G N.Chlorophyll fluorescence-a practical quide[J]. Journal of Experimental Botany,2000,51(315):659-668. http://cn.bing.com/academic/profile?id=2132527497&encoded=0&v=paper_preview&mkt=zh-cn
[9] 国家药典委员会.中华人民共和国药典:一部[M]. 北京:化学化工出版社,2005. [10] LIANG Q H,HUANG W H,JARIS P. Use of a SPAD meter to measure leaf chlorphy 2 concentration in Arabidopsis thaliana[J]. Photosynth Res,2011,107:209. DOI: 10.1007/s11120-010-9606-0
[11] 朱宇林,曹福亮,汪贵斌,等. Cd、Pb胁迫对银杏光合特性的影响[J]. 西北林学院学报,2006,(1):47-50. http://www.cnki.com.cn/Article/CJFDTOTAL-XBLX200601009.htm [12] 贾中民,程华,魏虹,等. 三峡库区岸生植物秋华柳对镉胁迫的光合响应[J]. 林业科学,2012,(6):152-158. http://www.cnki.com.cn/Article/CJFDTOTAL-LYKE201206026.htm [13] PRASAD M N V.Heavy metal stress in plants:from biomolecules to ecosystems[M]. Second Edition.Berlin:Springer Press,2004:48-170.
[14] DAHMANI-MULLER H, et al. Strategies of heavy metal uptake by three plant species growing near a metal smelter[J]. Environmental Pollution, 2000. 109(2):p. 231-238. DOI: 10.1016/S0269-7491(99)00262-6
[15] STOLTZ E,GREGER M. Accumulation properties of As,Cd,Cu,Pb and Zn by four wetland plant species growing on submerged mine tailings[J]. Environmental and experimental botany,200247(3):271-280. DOI: 10.1016/S0098-8472(02)00002-3
[16] 宋波,高定,陈同斌,等. 北京市菜地土壤和蔬菜铬含量及其健康风险评估[J]. 环境科学学报,2006,(10):1707-1715. http://www.cnki.com.cn/Article/CJFDTOTAL-HJXX200610024.htm [17] 郭燕梅,王昌全,李冰.重金属镉对植物的毒害研究进展[J]. 陕西农业科学,2008,(3):122-125. http://www.cnki.com.cn/Article/CJFDTOTAL-SNKX200803048.htm [18] CHUTZENDUBEL A,SCHWANZ P,MATYSIK J,et al. Cadmium induced changes in antioxidative systems, hydrogen peroxide content and differentiation in,scots pine roots[J]. Plant Physiology, 2001,127:887-898. DOI: 10.1104/pp.010318
[19] RUONG P N V,CLARIDGE J.Effects of heavy metals toxicities on vetiver growth[J]. Vetiver Newsletter,1996. 1532-36.
[20] 孙赛初,王焕校,李启任. 水生维管束植物受镉污染后的生理变化及受害机制初探[J]. 植物生理学报,1985,(2):113-121. http://www.cnki.com.cn/Article/CJFDTOTAL-ZWSI198502000.htm [21] KAZNINA N M, LAIDINEN G F,TITOV A F, et al.Effect of lead on the photosynthetic apparatus of annual grasses[J]. Biol Bull,2005,32(2):147. DOI: 10.1007/s10525-005-0022-5
[22] BARCELO J, POSCHENRIEDER CH, ANDREU I, et al. Cadmium Induced Decrease of Water Stress Resistance in Bush Bean Plants(Phaseolus vulgaris L,cv.Contender).1:Effects of Cd on Water Potential,Relative Water Content,and Cell Wall Elasticity[J].Journal of Plant Physiology, 1986,125(1/2):17-25.
[23] 万雪琴,张帆,夏新莉,等. 镉胁迫对杨树矿质营养吸收和分配的影响[J]. 林业科学,2009,(7):45-51. http://www.cnki.com.cn/Article/CJFDTOTAL-LYKE200907009.htm [24] 蒋文智,黎继岚. 镉对烟草光合特性的影响[J]. 植物生理学通讯,1989,(6):27-31. http://www.cnki.com.cn/Article/CJFDTOTAL-ZWSL198906007.htm [25] 蒋文智,黎继岚. 镉对光合器膜系统结构的影响[J]. 云南大学学报:自然科学版,1992,(3):318-323. http://www.cnki.com.cn/Article/CJFDTOTAL-YNDZ199203018.htm -
期刊类型引用(6)
1. 余泽岑,晏梅静,补春兰,沈谦,刘刚,董廷发,胥晓. 不同AMF菌肥对桑树“嘉陵30”生长和叶品质的影响. 西华师范大学学报(自然科学版). 2024(03): 246-253 .  百度学术
百度学术
2. 段文艳,李鑫,李晴,景若楠,盛敏. 黄土高原草地和刺槐根际AM真菌对刺槐和侧柏生长、土壤性质及叶片光合特性的影响. 西北农业学报. 2023(09): 1422-1436 .  百度学术
百度学术
3. 谭明曦,文旺先,林宇岚,张林平,吴斐,张扬,梁戊殿. AM真菌和无机磷处理对油茶幼苗生长和光合作用的影响. 经济林研究. 2022(01): 36-44 .  百度学术
百度学术
4. 林宇岚,王琳,楼玫娟,李正昀,张林平,吴斐,张扬. AM真菌与有机磷配施对油茶光合特性的影响. 江西农业大学学报. 2021(01): 136-143 .  百度学术
百度学术
5. 林宇岚,李正昀,张林平,吴斐,杨滢,谭明曦,胡冬南. 有机磷和AM真菌对油茶生长、根系形态和光合作用的影响. 经济林研究. 2021(01): 121-128+210 .  百度学术
百度学术
6. 葛诗蓓,姜小春,王羚羽,喻景权,周艳虹. 园艺植物丛枝菌根抗非生物胁迫的作用机制研究进展. 园艺学报. 2020(09): 1752-1776 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载: