A Molecular Epidemiological Study on Mycoplasma Pneumonia of Sheep and Goats in Fujian
-
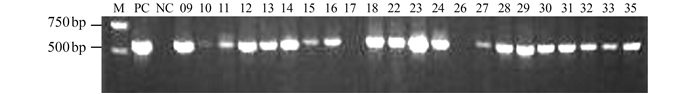
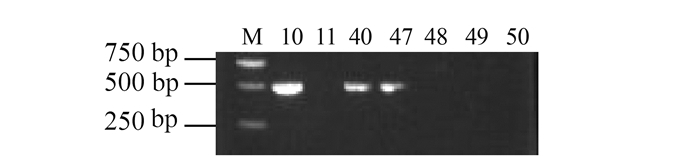
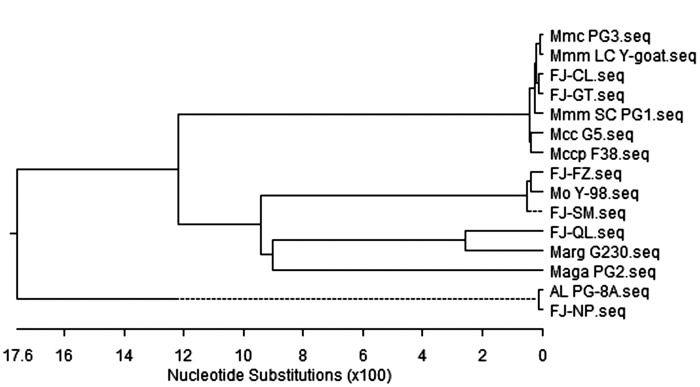
摘要: 为了解福建羊支原体性肺炎和山羊传染性胸膜肺炎的分子流行情况,于2014-2016年从福建省6个市采集到疑似羊支原体性肺炎或山羊传染性胸膜肺炎病料61份,用支原体目引物、绵羊肺炎支原体、丝状支原体山羊亚种、山羊支原体山羊肺炎亚种、山羊支原体山羊亚种、精氨酸支原体、莱氏无胆甾原体和无乳支原体的特异引物,通过PCR方法进行检测。挑取部分PCR阳性病料进行支原体分离和纯化,用16S rRNA基因通用引物进行克隆测序。结果显示61份样品中检出绵羊肺炎支原体45份(73.77%),检出丝状支原体山羊亚种4份(6.56%),检出莱氏无胆甾原体4份(6.56%),检出精氨酸支原体2份(3.28%)。该研究结果表明福建省发生的类传染性胸膜肺炎是以绵羊肺炎支原体为主的羊支原体性肺炎,为福建省羊支原体性肺炎的有效防治提供了科学依据。Abstract: The molecular epidemiology on the mycoplasma pneumonia of sheep and the contagious caprine pleuropneumonia of goats in Fujian were investigated. A total of 61 samples from the goats with suspected infection of the diseases were collected from 6 regions in the province during 2014-2016. PCR with the mycoplasmatales primer as well as the specific primers for Mycoplasma ovipneumoniae, Mycoplasma mycoides subsp.capri, Mycoplasma capricolum Subsp. Capripneumonia, Mycoplasma capricolum subsp.capri, Mycoplasma arginin, Acholeplasma laidlawii and Mycoplasma agalactiae were applied for the detection.Part of the PCR positive clinical samples were selected to isolate Mycoplasma for subsequent cloning and sequencing based on their 16S rRNA. The detection rates on M. ovipneumoniae, M. mycoides subsp.capri, A. laidlawii and M. arginine were 73.77%(45/61), 6.56%(4/61), 6.56%(4/61) and 3.28%(2/61), respectively. The results suggested that the suspected contagious caprine pleuropneumonia in the province were mycoplasma pneumonia of sheep and goats caused mainly by M.ovipneumoniae. The finding would lead to effective prevention and treatment measures for the diseases.
-
双孢蘑菇Agaricus bisporus是世界上栽培最为广泛的食用菌, 具有非常重要的经济价值。2015年, 我国双孢蘑菇的鲜菇年产量达340万t左右, 已成为我国农业重要的支撑产业[1]。然而, 有限的高产优质双孢蘑菇品种严重地阻碍了双孢蘑菇生产的发展, 虽然菌类遗传育种专家作出了巨大的努力, 但是采用常规的杂交育种技术还是很难获得新的优良菌种, 这主要是由于双孢蘑菇属二极性次级同宗结合的单因子交配型系统, 大多数担孢子是异核可育的, 不能用于杂交, 只有同核不育孢子才能用于杂交。此外, 双孢蘑菇菌丝细胞呈多核状态, 缺乏锁状联合[2-3]。这就造成了鉴定单核体或同核体间杂交的困难, 常常盲目地进行杂交, 严重阻碍了杂交育种工作的进行。
目前, 我们的研究团队能够应用同工酶标记, 在菌丝阶段可以对异核体和同核体进行区分和鉴定, 大大提高了双孢蘑菇杂交育种效率[4]。但不同的同核体菌株仍存在相同或不同的交配型, 只有具不同交配型因子的同核体之间才有可能配对成功, 随机配对获得杂交子的成功率仍然很低。前人研究表明, 双孢蘑菇是单因子交配型系统, 由单个A位点控制(A+/A-)且交配型基因A因子与mip基因紧密连锁, 但A因子的序列尚未见报道[5-6]。为了更有效地开展育种工作, 必须开展对双孢蘑菇交配型A因子的研究。本研究对课题组长期以来获得的双孢蘑菇不育单孢菌株进行杂交配对, 对不同交配型的不育单孢进行分组, 并构建基因组文库, 为下一步进一步克隆交配型A因子基因鉴定基础。
1. 材料和方法
1.1 菌株
供试菌株及来源见表 1。
表 1 供试菌株编号及来源Table 1. Strains tested number and Origin编号 菌株 来源 1 9601 分离自 As2796 2 9602 分离自 As2796 3 9603 分离自 As2796 4 9604 分离自 As2796 5 9605 分离自 As2796 6 9606 分离自 As2796 7 9607 分离自 As2796 8 9608 分离自 As2796 9 9609 分离自 As2796 10 9612 分离自 As2796 11 AgQG841-1 分离自野生菌株 AgQG841 12 AgQG841-3 分离自野生菌株 AgQG841 13 AgQG841-9 分离自野生菌株 AgQG841 14 Ag2k811-1 分离自野生菌株 Ag2k811 15 Ag2k811-3 分离自野生菌株 Ag2k811 16 AgLH830-4 分离自野生菌株 AgLH830 17 AgLH830-6 分离自野生菌株 AgLH830 18 AgLH830-7 分离自野生菌株 AgLH830 19 AgQL8125-3 分离自野生菌株 AgQL8125 20 AgQL8125-5 分离自野生菌株 AgQL8125 21 M7206-1 分离自 M7206 22 M7206-2 分离自 M7206 23 M7206-11 分离自 M7206 24 M7206-13 分离自 M7206 1.2 试验方法
1.2.1 同核不育株间配对杂交
不同菌株分离的同核不育体配对接种在PDA平板上, 置24℃条件下进行培养, 观察配对菌丝间的接触点是否有融合, 把菌丝接触点间恢复正常生长的菌丝体转接到PDA试管中进行纯化培养。
1.2.2 同核不育菌株同工酶谱的电泳分析
按王贤樵等的方法进行[4]。
1.3 DNA提取方法
参照参考文献[7]的方法。
1.4 基因组文库的构建
采用上述方法所提的50 μg DNA溶解在500 μL的SalⅠ的酶切缓冲液中, 加入0.25 U SalⅠ, 在30℃下酶切30 min。0.4%低熔点琼脂糖(1 ×TAE缓冲液)电泳分离DNA片段, 回收9~23 kb基因组片段。将基因组DNA片段(3 μg)与BamHⅠ消化的λ载体(5 μg)用T4 DNA连接酶在25℃连接4 h。取连接产物与包装蛋白混和, 22℃反应4 h。包装产物梯度稀释后侵染感受态E.coli C600hfl。铺平板培养进行文库的滴度测定。以上详细步骤参照文献[8-9]。
2. 结果与分析
2.1 同核不育单孢菌株的生物学鉴定
同核不育单孢菌株通常是生长速度慢、紧贴培养基表面生长的甸旬型, 菌丝弱细, 部分菌株会分泌出褐色色素, 在PDA培养基的生长情况见图 1~3。
2.2 同核不育单孢菌株的酯酶同工酶谱鉴定
同核不育单孢在酯酶同工酶的带型上表现为特殊的S型(图 4)。
![]() 图 4 同核不育单孢的酯酶同工酶带型注:泳道1为对照菌株As2796, 泳道2~10为表 1中对应的1~9号菌株。Figure 4. Esterase isoenzyme patterns of monokaryons
图 4 同核不育单孢的酯酶同工酶带型注:泳道1为对照菌株As2796, 泳道2~10为表 1中对应的1~9号菌株。Figure 4. Esterase isoenzyme patterns of monokaryons2.2 同核不育单孢间的杂交配对
将表 1中的24个不育单孢菌株进行两两间的杂交配对, 再根据同种交配型因子交配不亲和性原理, 将获得的不育单孢进行分组。部分杂交配对结果如图 5所示。两两间杂交配对的结果见表 2。
表 2 供试菌株两两配对杂交Table 2. Two-pair hybridization of the tested strains1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 1 + + + 2 + + 3 + + 4 + + + + + 5 + 6 7 + + 8 + + + + + 9 + + 10 + + + 11 + 12 + 13 14 + + 15 + 16 + 17 + + 18 19 20 + 21 + + + + 22 + 23 + 24 + 注:“+”表示菌株间可以杂交配对。 从配对结果可以看出来自不同的菌株的分离的不育单孢可杂交的概率也是不一样, 其中菌株编号4号、8号, 21号可杂交的概率较高, 其他的不育单孢可杂交的概率较低。其中以8号菌株为例, 菌株2号、4号、7号、21号、22号可以与8号菌株杂交, 根据同种交配型因子杂交不亲和性, 将8号菌株定为菌株A+, 那么菌株2号、4号、7号、21号、22号为A-。其余的菌株, 根据不同交配型可性亲和原则, 可将上述的供试菌株分为A+:1、8、9、10、11、16、17、20。对应菌株编号为:9601、9608、9609、9612、AgQG841-1、AgLH830-4、AgLH830-6、AgQL8125-5。A-:2、3、4、7、14、21、22、23、24。对应菌株编号为:9602、9603、9604、9607、Ag2k811-1、M7206-1、M7206-2、M7206-11、M7206-13。
2.3 基因组文库的构建
将上述获得的A+菌株:9601、9608、9609、9612、AgQG841-1、AgLH830-4、AgLH830-6、AgQL8125-5行基因组DNA的提取, 并将这些DNA混合成A+ DNA池。同样将A-菌株:9602、9603、9604、9607、Ag2k811-1、M7206-1、M7206-2、M7206-11、M7206-13进行基因组DNA的提取, 并混合A-DNA池。
将A+DNA池和A-DNA池进行酶切, 用SalⅠ酶切, 电泳。酶切前和酶切后的电泳图谱见图 6。
参照上述基因组文库的构建方法, 将酶切后的基因组DNA和酶切后的噬菌体λDNA, 进行连接、包装、侵染、铺平板及滴度测定。从平板上随机挑取分隔良好的几个噬菌斑, 提取重组后的噬菌体λDNA, 并进行酶切验证(图 7)。
结果可以看出, 经SalⅠ酶切, 可切出20 kb、14 kb和9 kb 3个片段, 其中20 kb和9 kb为λ载体的左右臂, 插入片段为14 kb, 与预期相符, 说明文库的质量较高。
3. 结果与讨论
3.1
高分子质量的DNA对构建基因组文库尤为重要。如果小片段多, 会导致DNA转化噬菌体的效率低。在研究中发现, 在高浓度钾离子存在下, SDS与多糖或蛋白质结合生成复合物, 能有效除去多糖, 所得DNA易溶解。DNA提取过程中只使用SDS, 而不使用CTAB, 减少了对DNA的损害。另外我们用30%乙醇溶解DNA后, 于4℃放置过夜, 能进一步去除多糖和其他杂质, 提高所提取的DNA纯度。
3.2
本研究中所提的双孢蘑菇大片段DNA经SalⅠ部分酶切, 低熔点琼脂糖电泳回收9~23 kb的片段, 回收的DNA片段与BamHⅠ消化的λ载体连接, 获得了2×105个转化子。在真菌的基因组为107~108 bp, 当重组转化子为2×103~2×104时, 可保证99 %的基因存在于基因组文库中, 说明了构建的文库基因覆盖率较全。
3.3
本研究通过单孢菌株间的两两配对杂交, 获得了2种不同交配型的双孢蘑菇不育单孢菌株, 并构建了这2种不同交配型的不育单孢的基因组文库, 这为下一步克隆双孢蘑菇的交配型基因以及研究不同交配型的不育单孢的基因组成差异奠定了基础。
-
表 1 参比序列
Table 1 Reference sequence
支原体种类 缩写名称 基因库
序列号Acholeplasma laidlawiistrain
PG-8AAL PG8 NR_074448.1 Mycoplasma mycoidessubsp.
capri strain PG3Mmc PG3 NR_044772.1 Mycoplasma mycoides mycoides
LC type,Y-goatMmmLC Y-goat U26044.1 Mycoplasma capricolum
capricolumG5Mcc G5 U26041.1 Mycoplasma capricolumsubsp.
capripneumoniae strain F38Mccp F38 NR_037061.1 Mycoplasma ovipneumoniae
strain Y-98Mo Y98 NR_025989.1 Mycoplasma agalactiae strain PG2 Maga PG2 NR_118811.1 Mycoplasma arginini strain G230 Marg G230 NR_041743.1 -
[1] MACOWAN K J. Role of mycoplasma strain F38 in contagious caprine pleuropneumonia[J]. Israel journal of medical sciences, 1984, 20(10):979-981. https://www.ncbi.nlm.nih.gov/pubmed/6511324
[2] 储岳峰.我国山羊 (接触) 传染性胸膜肺炎病原学、流行病学研究及灭活疫苗的研制[D].北京:中国农业科学院, 2011. http://cdmd.cnki.com.cn/Article/CDMD-82101-1011159132.htm [3] HOTZEL H, SACHSE K. Improvement and acceleration of the diagnosis of contagious bovine pleuropneumonia by direct detection of the microbe using polymerase chain reaction (PCR)[J]. Bed Munch Tierarztl Wochenschr, 1998, 111(7-8):268-272. https://www.researchgate.net/publication/13545037_Improvement_and_acceleration_of_the_diagnosis_of_contagious_bovine_pleuropneumonia_by_direct_detection_of_the_microbe_using_polymerase_chain_reaction_PCR
[4] TIMENETSKY J, SANTOS L M, BUZINHAI M, et al.Detection of multiple mycoplasma infection in cell cultures by PCR[J]. Brazilian Journal of Medical and Biological Research, 2006, 39(7):907-914. http://www.oalib.com/paper/938499
[5] BASCUNANA C R, MATTSSON J G, BOLSKE G, et al. Characterization of the 16S rRNA genes from Mycoplasma sp. strain F38 and development of an identification system based on the polymerase chain reaction[J]. Journal of bacteriology, 1994, 176(9):2577-2586. DOI: 10.1128/jb.176.9.2577-2586.1994
[6] 宋勤叶, 李潭清, 刘兰亚, 等.绵羊肺炎支原体和丝状支原体双重PCR检测方法的建立[J].中国兽医杂志, 2010, 46(1):64-66. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGXJ200910002177.htm [7] WOUBIT S, LORENZON S, PEYRAUD A, et al. A specific PCR for the identification of Mycoplasma capricolum subsp. capripneumoniae, the causative agent of contagious caprine pleuropneumonia (CCPP)[J]. Veterinary Microbiology, 2004, 104:125-132. DOI: 10.1016/j.vetmic.2004.08.006
[8] MONNERAT M P, THIAUCOURT F, NICOLET J, et al. Comparative analysis of the lppA locus in Mycoplasma capricolum subsp.capricolum and Mycoplasma capricolum subsp. capripneumoniae[J].Veterinary Microbiology, 1999, 69(3):157-172. DOI: 10.1016/S0378-1135(99)00105-4
[9] SUBRAMANIAM S, BERGONIER D, POUMARAT F, et al. Species identification of Mycoplasma bovis and Mycoplasma agalactiae based on the uvrC genes by PCR[J]. Mol Cell Probe, 1998, 12:161-169. DOI: 10.1006/mcpr.1998.0160
[10] 江锦秀, 林甦, 林裕胜, 等.绵羊肺炎支原体FJ01-CL株的分离和鉴定[J].福建农业学报, 2015, 30(5):430-434. http://www.fjnyxb.cn/CN/abstract/abstract2678.shtml [11] 江锦秀.一种支原体培养装置:中国, 201520298818.6[P].2015-09-16. [12] 石磊, 龚瑞, 尹争艳, 等.肉牛传染性牛支原体肺炎流行的诊断[J].华中农业大学学报, 2008, 27(5):629-633. http://www.cnki.com.cn/Article/CJFDTOTAL-HZNY200805011.htm [13] 王华, 杨发龙, 王永, 等.山羊支原体性肺炎流行病学调查[J].中国畜牧兽医, 2011, 38(1):210-214. http://www.cnki.com.cn/Article/CJFDTOTAL-GWXK201101058.htm [14] ALLEY, M R, IONAS, G, CLARKE J K. Chronic non-progressive pneumonia of sheep in New Zealand-A review of the role of Mycoplasma ovipneumoniae[J]. New Zealand Veterinary Journal, 1999, 47, 155-160. DOI: 10.1080/00480169.1999.36135
[15] NICHOLAS, R A J, AYLING R D, LORIA G R. Ovine Mycoplasmal infections[J]. Small Ruminant Research, 2008, 76:92-98. DOI: 10.1016/j.smallrumres.2007.12.014
-
期刊类型引用(22)
1. 黄春苗. 羊支原体肺炎的流行病学调查及综合防治. 中国动物保健. 2024(01): 131-132 .  百度学术
百度学术
2. 江锦秀,张靖鹏,林裕胜,刘维巍,胡奇林,万春和. 基于Hsp70基因的绵羊肺炎支原体TaqMan检测方法的建立及其遗传演化分析. 畜牧兽医学报. 2024(04): 1684-1695 .  百度学术
百度学术
3. 汤琳波,李富祥,邵庆勇,王金萍,樊月圆,高华峰. 绵羊肺炎支原体云南分离株鉴定及其TU/HSP70基因特征分析. 中国动物检疫. 2022(02): 103-108+113 .  百度学术
百度学术
4. 杨鹏,吴燕,岳筠,陈静,李梅,王慧,张双翔,文明,程振涛. 绵羊肺炎支原体P113蛋白C末端基因真核表达载体的构建及其小鼠免疫应答. 中国兽医学报. 2022(03): 496-501+521 .  百度学术
百度学术
5. 王紫阳,努尔比亚·艾克木,屈勇刚,党瑞莹,赵玉,常军帅,李岩. 新疆某规模化羊场羊支原体肺炎的分子流行病学调查. 现代畜牧兽医. 2022(05): 58-62 .  百度学术
百度学术
6. 吴仲武. 屏南县放牧山羊绵羊肺炎支原体流行病学调查. 中国动物保健. 2022(12): 34-35 .  百度学术
百度学术
7. 张莹. 一例山羊支原体性肺炎的诊治. 福建畜牧兽医. 2021(04): 46-47 .  百度学术
百度学术
8. 姜新基,孟柯其其格,付登胜,郭学峰,红梅. 羊支原体肺炎诊断及治疗. 畜牧兽医科技信息. 2021(06): 94 .  百度学术
百度学术
9. 王岩,贺英,王炜. 绵羊支原体肺炎研究进展. 中国兽医杂志. 2021(07): 80-83 .  百度学术
百度学术
10. 海拉提江·赛依提汗,哈德力别克·吾特开,乌那尔汗·吉斯汗. 马传染性胸膜肺炎防治. 畜牧兽医科学(电子版). 2020(08): 106-107 .  百度学术
百度学术
11. 陈上永. 一例羊支原体性肺炎的诊治与体会. 畜牧兽医科技信息. 2020(06): 121 .  百度学术
百度学术
12. 袁婷,郝华芳,马丽娜,陈胜利,颜新敏,吴娅琴,蔡亚婷,孙延鸣,储岳峰. 绵羊肺炎支原体人工感染SPF鸡胚的研究. 中国畜牧兽医. 2020(09): 2988-2996 .  百度学术
百度学术
13. 林裕胜,李莎莎,江锦秀,张靖鹏,游伟,胡奇林. 绵羊肺炎支原体和丝状支原体山羊亚种双重TaqMan探针荧光定量PCR检测方法的建立及应用. 农业生物技术学报. 2019(05): 943-950 .  百度学术
百度学术
14. 陈清香. 一例山羊支原体性肺炎的诊治及防控措施. 福建畜牧兽医. 2019(05): 58-59 .  百度学术
百度学术
15. 杜奕州,郗宇,赵金玉,武军元. 新疆南疆部分地区绵羊支原体感染的分子流行病学调查. 中国兽医科学. 2019(11): 1427-1433 .  百度学术
百度学术
16. 郭慧瑜,林裕胜,毛坤明,胡奇林. 福清市福清山羊绵羊肺炎支原体血清学调查. 福建畜牧兽医. 2019(06): 10-11 .  百度学术
百度学术
17. 张靖鹏,江锦秀,林裕胜,游伟,胡奇林. 丝状支原体山羊亚种特异性蛋白基因Mmc-3740的克隆表达和免疫原性分析. 福建农业学报. 2019(10): 1124-1128 .  本站查看
本站查看
18. 江锦秀,林裕胜,张靖鹏,游伟,黄丽丽,胡奇林. 绵羊肺炎支原体感染的诊断和防治技术研究进展. 福建农业学报. 2019(12): 1463-1470 .  本站查看
本站查看
19. 阿比克哈莫,马艳君,罗雪,汤承. 山羊源精氨酸支原体的分离鉴定与药感试验. 草学. 2018(03): 64-68 .  百度学术
百度学术
20. 林裕胜,江锦秀,张靖鹏,游伟,胡奇林. 绵羊肺炎支原体TaqMan荧光定量PCR检测方法的建立. 中国预防兽医学报. 2018(04): 316-320 .  百度学术
百度学术
21. 林裕胜,江锦秀,张靖鹏,游伟,胡奇林. 绵羊肺炎支原体SYBR Green Ⅰ实时荧光定量PCR检测方法的建立. 福建农业学报. 2018(10): 1054-1058 .  本站查看
本站查看
22. 彭艳伶,阿比克哈莫,马艳君,余琼,李建,李昊,汤承. 四川省凉山州山羊支原体的病原学检测. 草学. 2017(04): 64-68 .  百度学术
百度学术
其他类型引用(9)




 下载:
下载: