Purification of Polysaccharide Extract from Agaricus bisporus Using Macroporous Resins
-
摘要: 对HZ830和D303两种大孔树脂串联纯化双孢蘑菇多糖的工艺进行了研究,考察体积流速、上样量和洗脱剂用量对双孢蘑菇多糖色素脱除率、蛋白脱除率和多糖保留率的影响。结果表明在以HZ830树脂为前柱,D303树脂为后柱,2种树脂等体积装柱,上样质量浓度为20 mg·mL-1(pH 8),上样体积5倍树脂柱床体积(5 BV,260 mL),体积流速为1.73 mL·min-1,上样结束后以1倍树脂柱床体积(1 BV,52 mL)纯水洗脱的工艺条件下,对蘑菇预煮液浓缩液中提取的双孢蘑菇粗多糖的蛋白质和色素杂质的脱除率分别为91.57%和94.14%,多糖保留率为73.49%。Abstract: Macroporous resins, HZ830 and D303, were used for the purification of polysaccharide extractfrom Agaricus bisporus. The evaluation criteria for the process included there movalrates of pigment and protein as well as the retention of polysaccharides in the filtrate under varied flow rates, feeding volumes and eluent flushing on the macroporous resin filtration system.The resin columns were assembled in series with either a HZ830 column in front or behind a D303 column. It was found that the best results could be achievedusing a HZ830 column followed by a D303 column andby feeding through themat a flow rate of 1.73 mL·min-1 of 5 times of the bed volume (BV, 260 mL) of a 20 mg·mL-1 polysaccharide extractat pH 8.0, the bed volume of colum were 52 mL, then flushing with 1 BV (52 mL) of water at the end. The resulting decolorization, deproteinization and polysaccharide retention rates of the filtration on thehot water mushroom extractreached 94.14%, 91.57% and 73.49%, respectively.
-
Keywords:
- Agaricus bisporus /
- macroporous resin /
- polysaccharides /
- decolorization /
- deproteinization
-
蘑菇罐头生产企业将蘑菇杀青水回收后通过浓缩10倍后得到蘑菇预煮浓缩液,该浓缩液密度为1.4 g·mL-1左右, 偏酸。通过冷冻结晶、过滤、醇沉和热醇过滤等方法可以从双孢蘑菇预煮液的10倍浓缩液中分离出蘑菇粗多糖,但通过该方法获得的双孢蘑菇粗多糖中还含有大量的蛋白质、氨基酸和色素杂质,色泽黑褐色,黏度大,易吸湿。需要进一步的纯化精制,以便加以利用。
传统的多糖脱蛋白、脱色素方法,多数费时繁琐,且易损失破坏多糖,抑或使用有毒溶剂容易形成残留,在实际生产应用中的弊端明显[1]。近年来,吸附树脂逐渐被研究用于粗多糖中色素和蛋白的脱除[2],其中的大孔树脂具有物理化学稳定性高、处理能力大、选择性好、吸附速度快、条件温和、使用周期长、成本低等诸多优点[3],运用大孔吸附树脂和大孔离子交换树脂对菌物粗多糖进行纯化精制具有条件温和、杂质去除率和多糖保留率高、安全便捷的优点,应用前景广阔。双孢蘑菇多糖的纯化过程中需要去除的杂质主要有2类,一是蛋白质和氨基酸,另外就是影响产品品质的色素杂质,因此本试验以脱色率、蛋白脱除率及多糖的保留率为指标考察大孔树脂对双孢蘑菇粗多糖纯化的效果。
1. 材料与方法
1.1 材料、试剂与仪器
试验材料:双孢蘑菇预煮浓缩液为漳州同发生物科技有限公司提供。试验试剂均为国产分析纯;试验用水为超纯水。
主要仪器:日立U1900紫外扫描分光光度计 (日本Hitachi公司);L535-1台式低速离心机 (湖南湘仪实验仪器开发有限公司);Centrifuge 5804 R离心机 (德国艾本德);超纯水器Milli-Q plus (Millipore公司);恒温振荡器 (上海至诚)。
1.2 试验方法
1.2.1 指标测定
多糖含量测定:用蒽酮-硫酸法[4]测定绣球菌多糖脱色前后的多糖含量,并计算多糖保留率。多糖保留率/%=处理后多糖含量/处理前多糖含量×100%
脱色率测定:以460 nm为检测波长,测定溶液的吸光度[5],并计算脱色率。脱色率/%=(处理前吸光度-处理后吸光度)/脱色前吸光度×100%
蛋白质含量测定:蛋白质含量测定采用考马斯亮蓝G-250法测定[6]。蛋白质脱除率/%=处理后蛋白含量/处理前蛋白含量×100%。
1.2.2 双孢蘑菇粗多糖制备
(1) 将浓缩液4℃冷藏24 h后,过滤去除结晶沉淀物,回收滤液备用,结晶物主要为甘露醇、氨基酸和无机盐类的混合物。
(2) 往浓缩液中加入3倍体积的95%乙醇,沉淀24 h,水浴加热醇沉液至50℃后,趁热过滤取沉淀物,沉淀物挥去乙醇即得到蘑菇粗多糖。粗多糖称量后用去离子水复溶为20 mg·mL-1的双孢蘑菇粗多糖溶液,备用。
1.2.3 树脂的预处理
HZ830树脂的预处理:用95%乙醇溶液浸泡4 h,用蒸馏水洗至无醇味,重复3次乙醇处理,最后保存于蒸馏水中备用[7]。
D303碱性离子交换树脂的预处理:用2%NaOH溶液浸泡4 h,用蒸馏水洗至pH呈中性,再用4%HCl溶液浸泡4 h,用蒸馏水洗至pH呈中性,最后用2%NaOH溶液浸泡4 h,用蒸馏水洗至pH呈中性,备用[8]。
1.2.4 静态吸附动力学试验
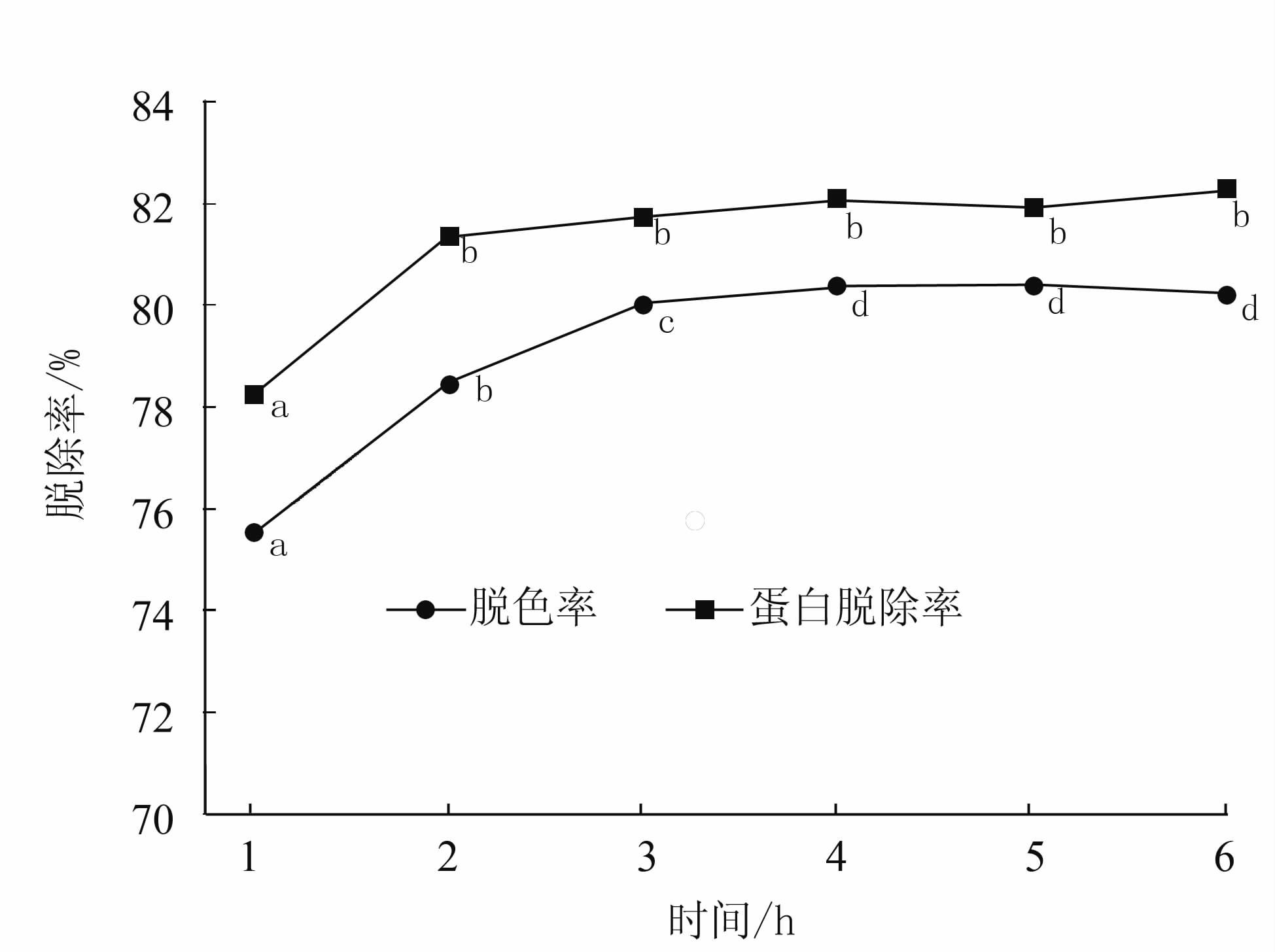
准确称取处理好的HZ830、D303树脂1 g,加入15 mL浓度为20 mg·mL-1的多糖粗提物,置于摇床中,120 r·min-1,pH 7,20℃,吸附处理,每种树脂各设3个重复。每隔1 h取1次上清液,持续6 h,取上清液于A460测定吸光值、蛋白质含量,计算脱色率和蛋白脱除率。
1.2.5 体积流速对脱色率和蛋白脱除率的影响
HZ830树脂30 g,D303树脂25 g装柱 (φ1.5 cm×17 mm),通过计算,其柱体积约为30.03 mL,按动态吸附试验方法,上样质量浓度为20 mg·mL-1(pH 8) 多糖溶液100 mL,分别控制体积流速为0.5、1.0、1.5、2.0 mL·min-1,并用1倍柱体积的纯化水进行洗脱,合并洗脱液,测定回收液的脱色率、蛋白脱除率和糖保留率。
1.2.6 动态吸附试验测定树脂最大上样量
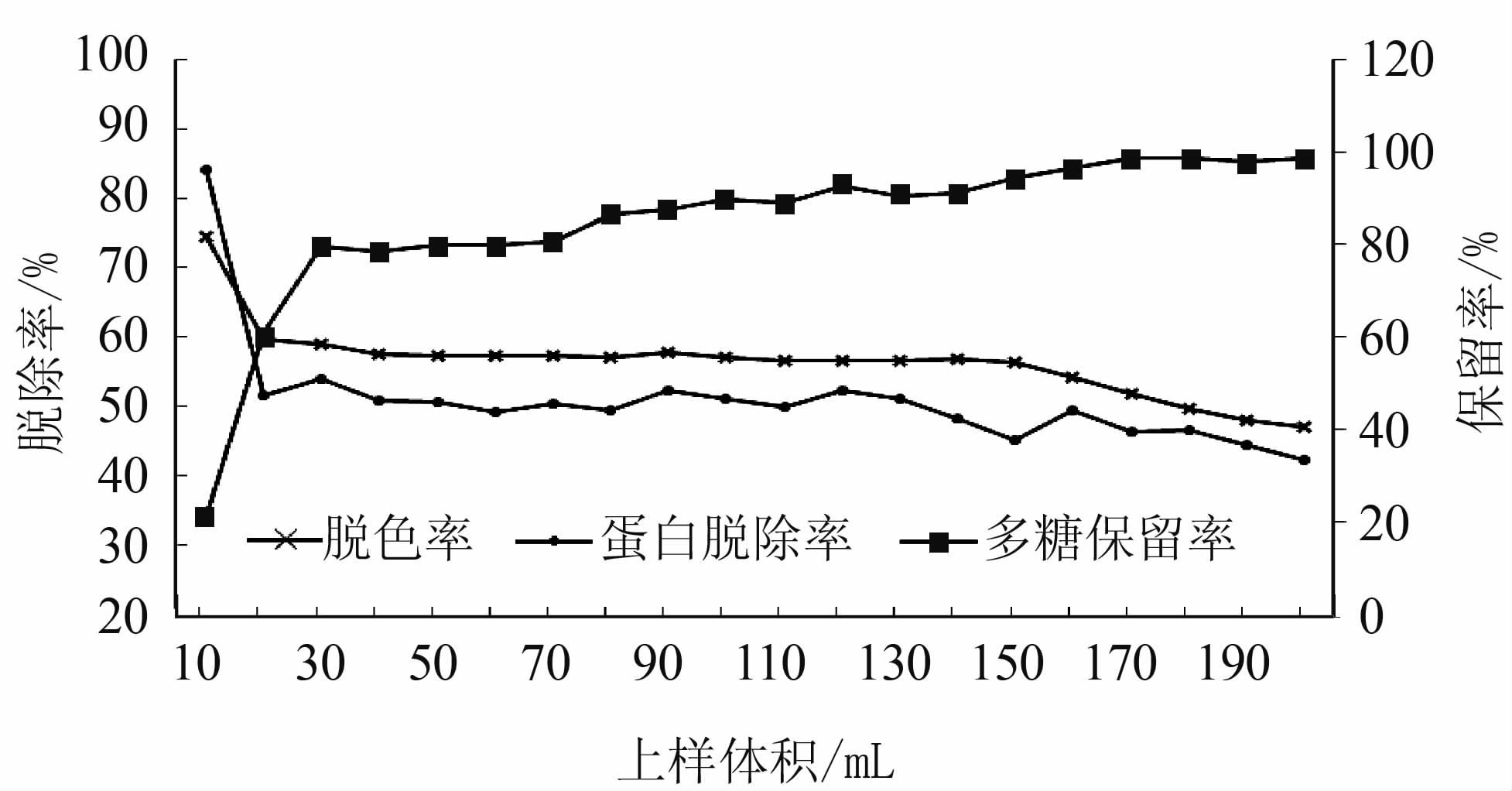
取预处理好的HZ830树脂25 g湿法装住 (φ1.5 cm×12 cm),柱体积为21.2 mL。取预处理好的D303树脂30 g湿法装柱 (φ1.5 cm×22 cm),柱体积为38 mL。质量浓度为20 mg·mL-1(pH 8) 的蘑菇粗多糖溶液分别以0.7、1.27 mL·min-1的流速经过HZ830和D303树脂层析柱,弃去前段1BV后每5 mL一份分段收集流出液,收集流出液200 mL,试验结束后隔管测定各部分流份的脱色率、蛋白脱除率和多糖保留率。绘制流出液中脱色率、蛋白脱除率和多糖保留率与上样量的关系曲线。
1.2.7 动态吸附试验测定最佳洗脱剂用量
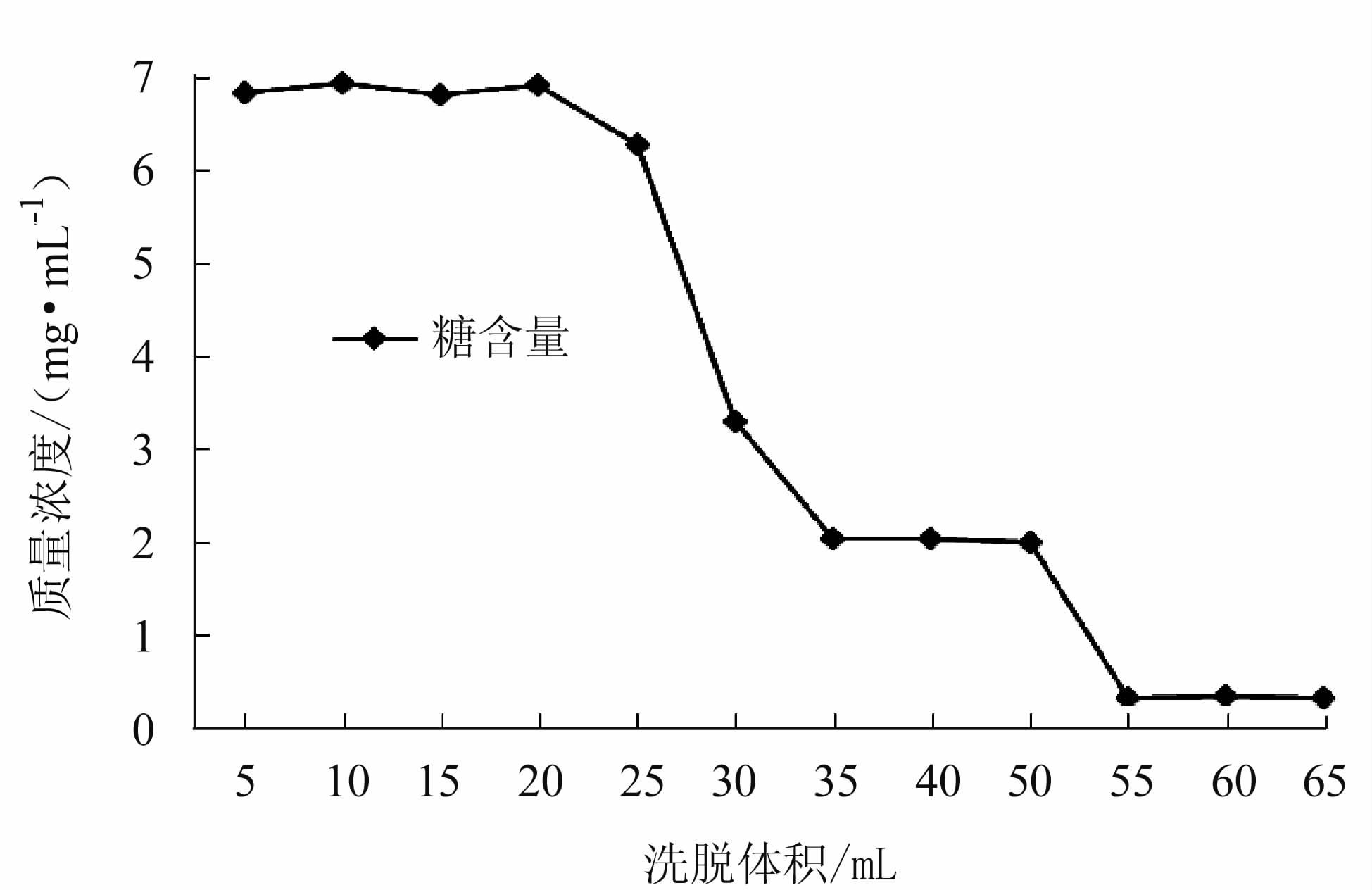
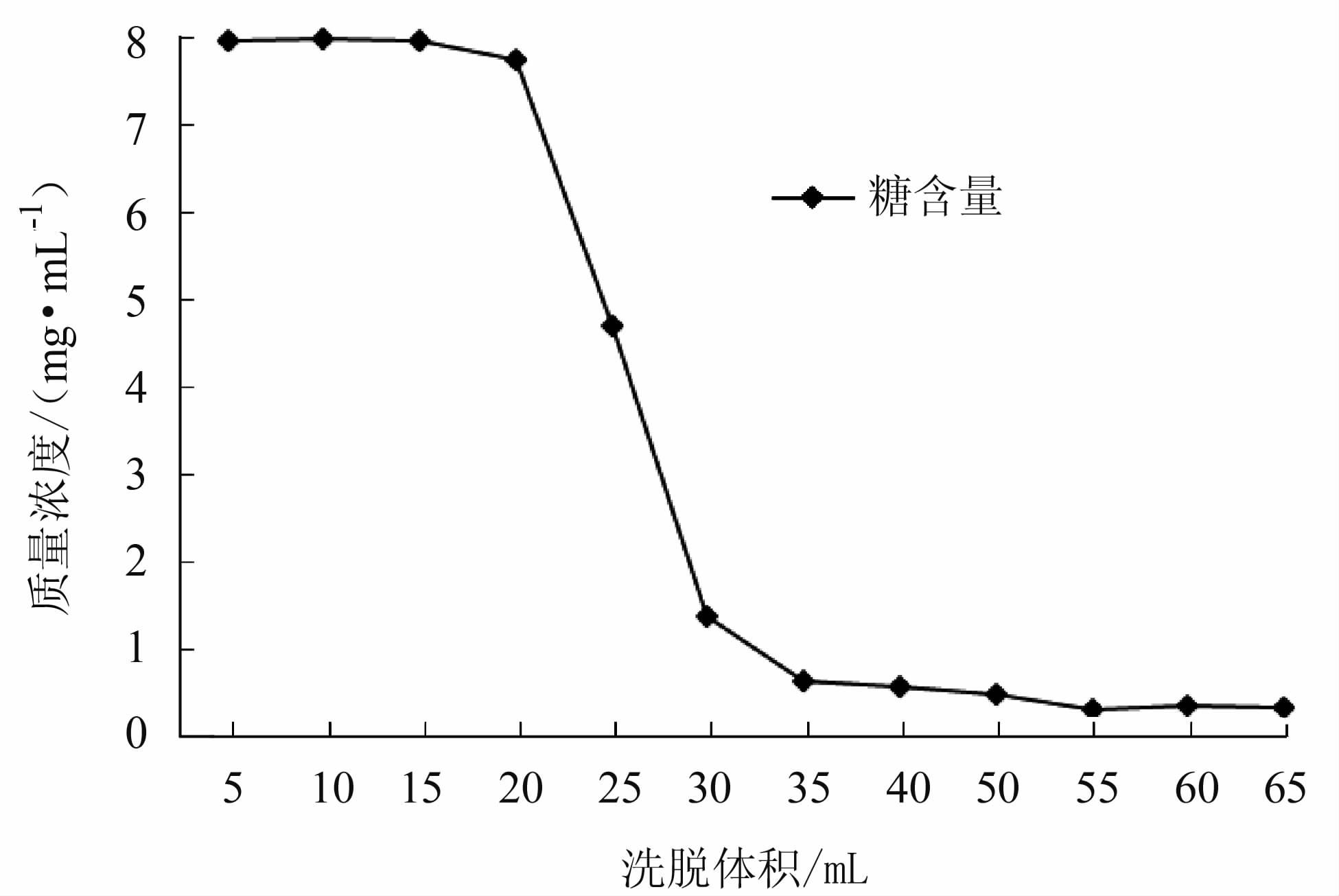
HZ-830,D303树脂各30 g装柱 (φ1.5 cm),通过计算,其HZ830柱体积为30.03 mL,D303树脂柱体积为38 mL。按动态吸附试验方法,上样质量浓度为20 mg·mL-1(pH 8) 多糖溶液100 mL,HZ830控制体积流速为1 mL·min-1,D303控制体积流速为1.27 mL·min-1,上样完成后用纯化水进行洗脱,进行分段收集,每管5 mL。试验结束后测定各管的多糖含量。
1.2.8 HZ830和D303树脂柱串联纯化蘑菇粗多糖验证试验
取处理好的HZ830、D303等体积树脂装柱 (φ1.5 cm×30 cm),试验中HZ830树脂为前柱,D303阴离子交换树脂为后柱,通过计算其柱体积为52 mL,串联总体积为104 mL。按动态吸附试验方法,上样质量浓度为20 mg·mL-1(pH 8) 多糖溶液260 mL约合5 BV,控制体积流速为1.73 mL·min-1,弃去前端无糖流份后,对流出液进行收集,上样结束后用1 BV纯水洗脱。试验结束后测定收集的流出液的总体积以及A460吸光度和蛋白含量、多糖含量,计算色素脱除率和蛋白脱除率以及多糖保留率。
色素脱除率/%=(A460原液×260-A460处理×V处理)/A460原液×260 ×100%
蛋白脱除率/%=(C蛋白原液×260-C蛋白处理×V处理)/C蛋白原液×260 ×100%
多糖保留率/%=C糖处理×V处理/C糖原液×260 ×100%
1.3 数据统计与分析
试验数据以Excel软件建立数据库,采用SPSS 17.0软件进行统计分析,采用单因素方差分析法,以α=0.05作为显著性水平,进行组间均值比较。
2. 结果与分析
2.1 静态吸附动力学过程
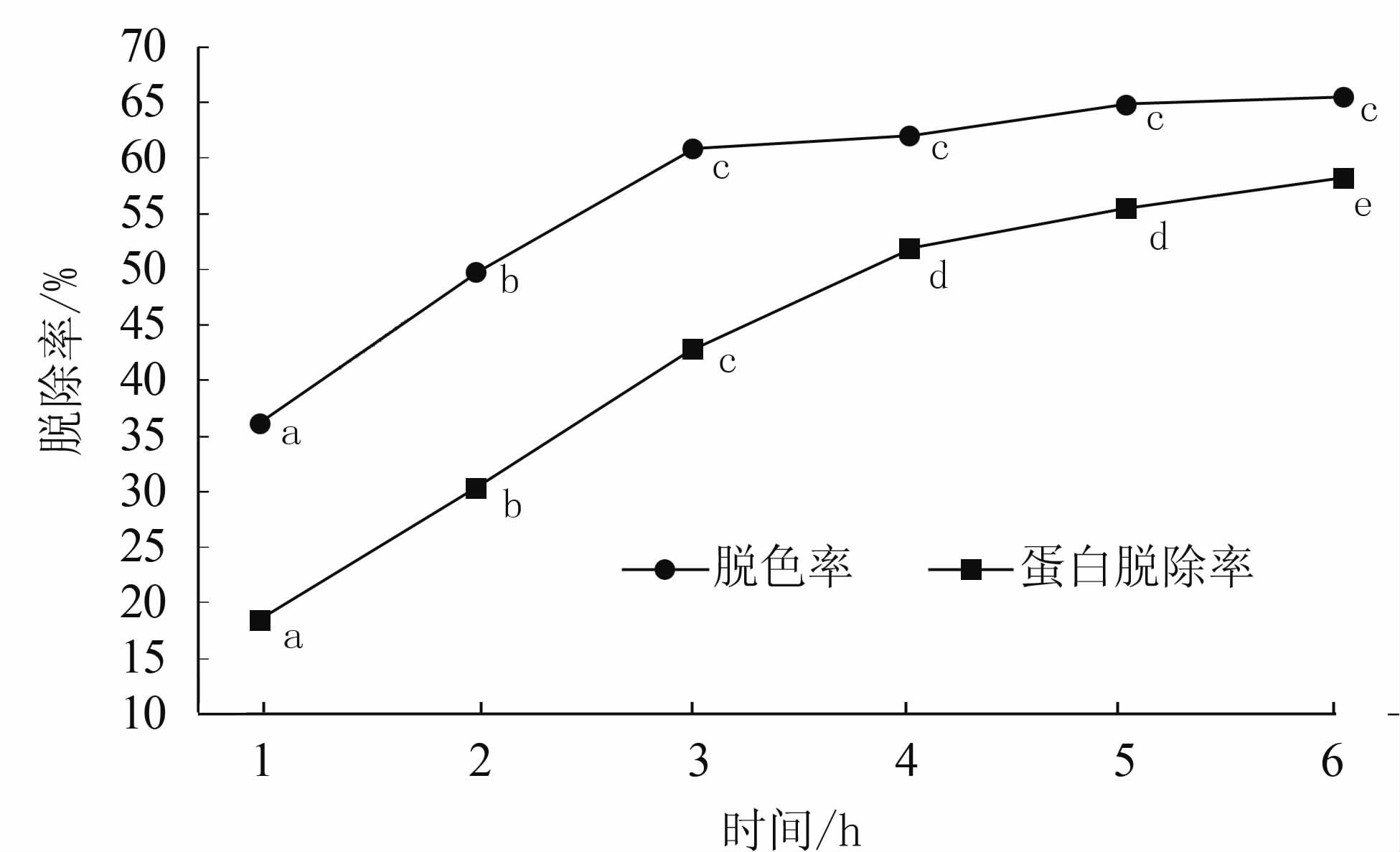
由图 1可知,随着脱色时间的延长,HZ830树脂对色素的吸附在前3 h脱色效果逐渐增强,3 h过后则脱色率趋于平缓;而其对蛋白质的吸附则更为迅速,在2 h左右基本达到平衡。由图 2可知,D303对色素和蛋白的吸附效果随着时间的延长平稳上升,至4 h后,上升速度减缓。
2.2 体积流速对脱色率和蛋白脱除率的影响
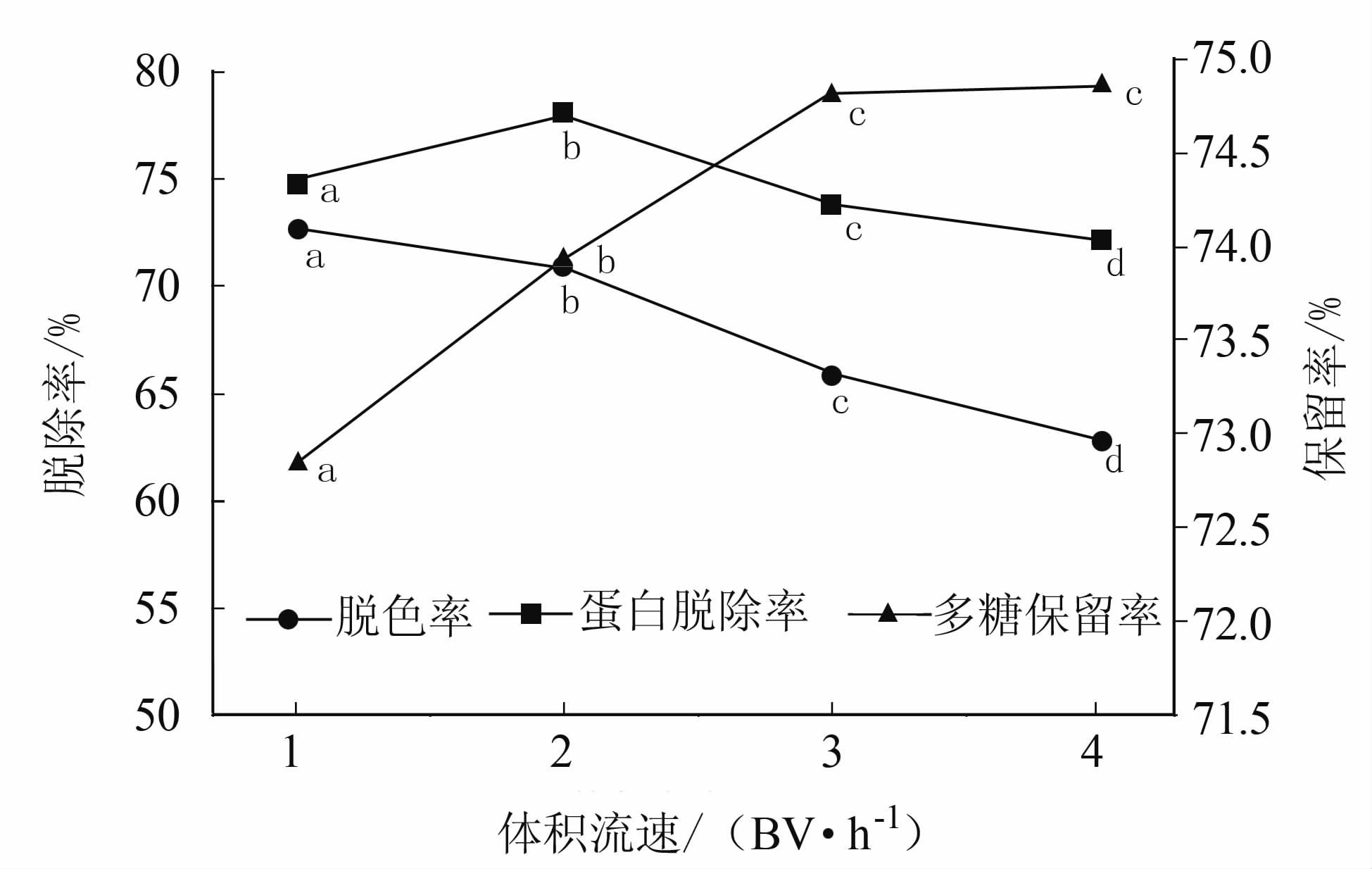
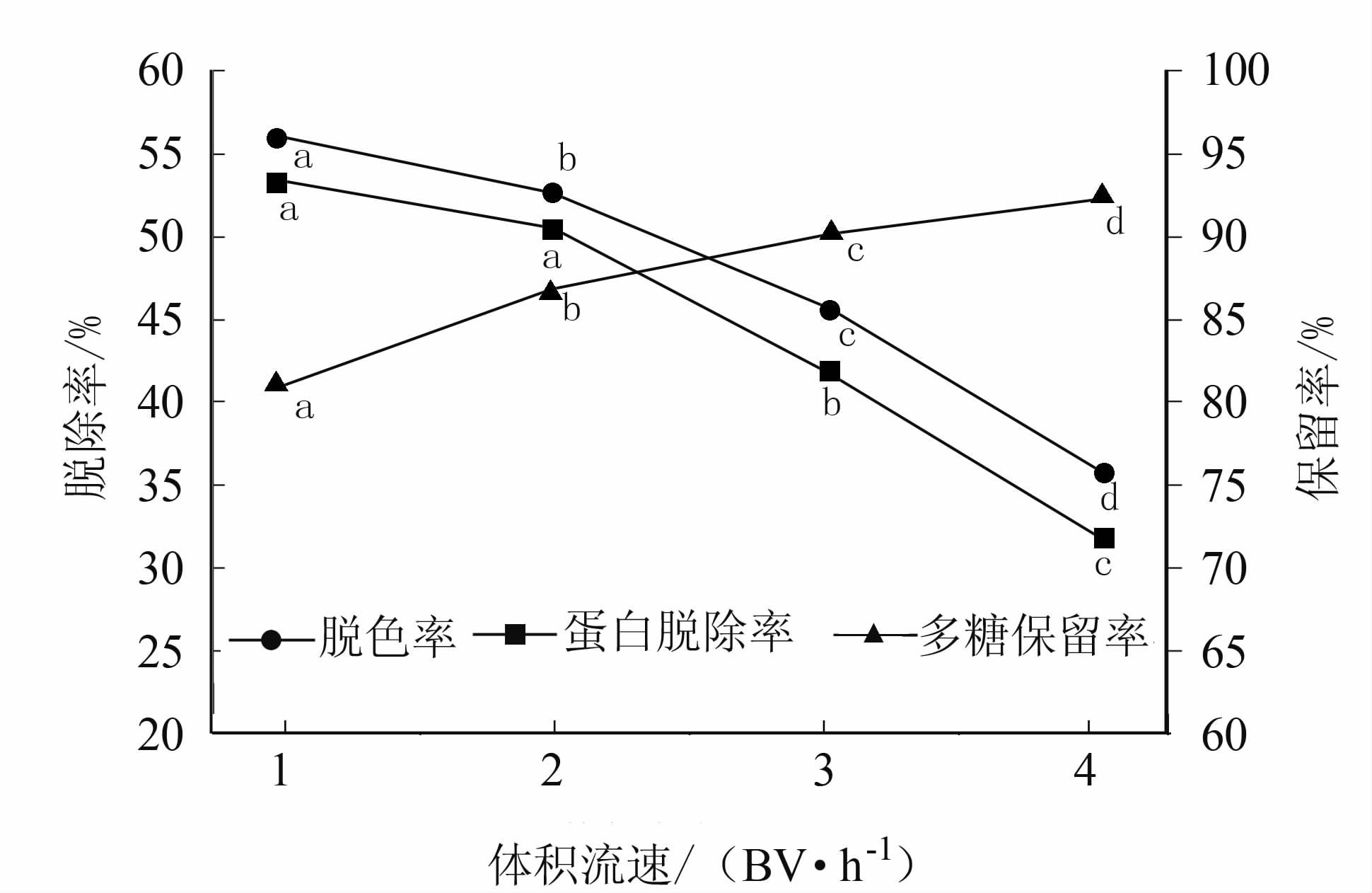
通过测定对比回收洗脱液的脱色率、蛋白脱除率和糖保留率,不同体积流速下2种树脂处理结果见图 3和图 4,结果表明树脂对蛋白和色素的脱除率随着体积流速的增大而减小,多糖保留率则相反,但总体变化不大。由于树脂与糖液间的接触时间太小就会导致脱色和脱蛋白的效果下降;反之则会造成处理操作时间过长,不利于提高生产效率。因此,结合试验数据综合考虑串联纯化效果和实际的生产需求,选择体积流量为每小时2柱床体积较为合适。
2.3 树脂最大上样量的确定
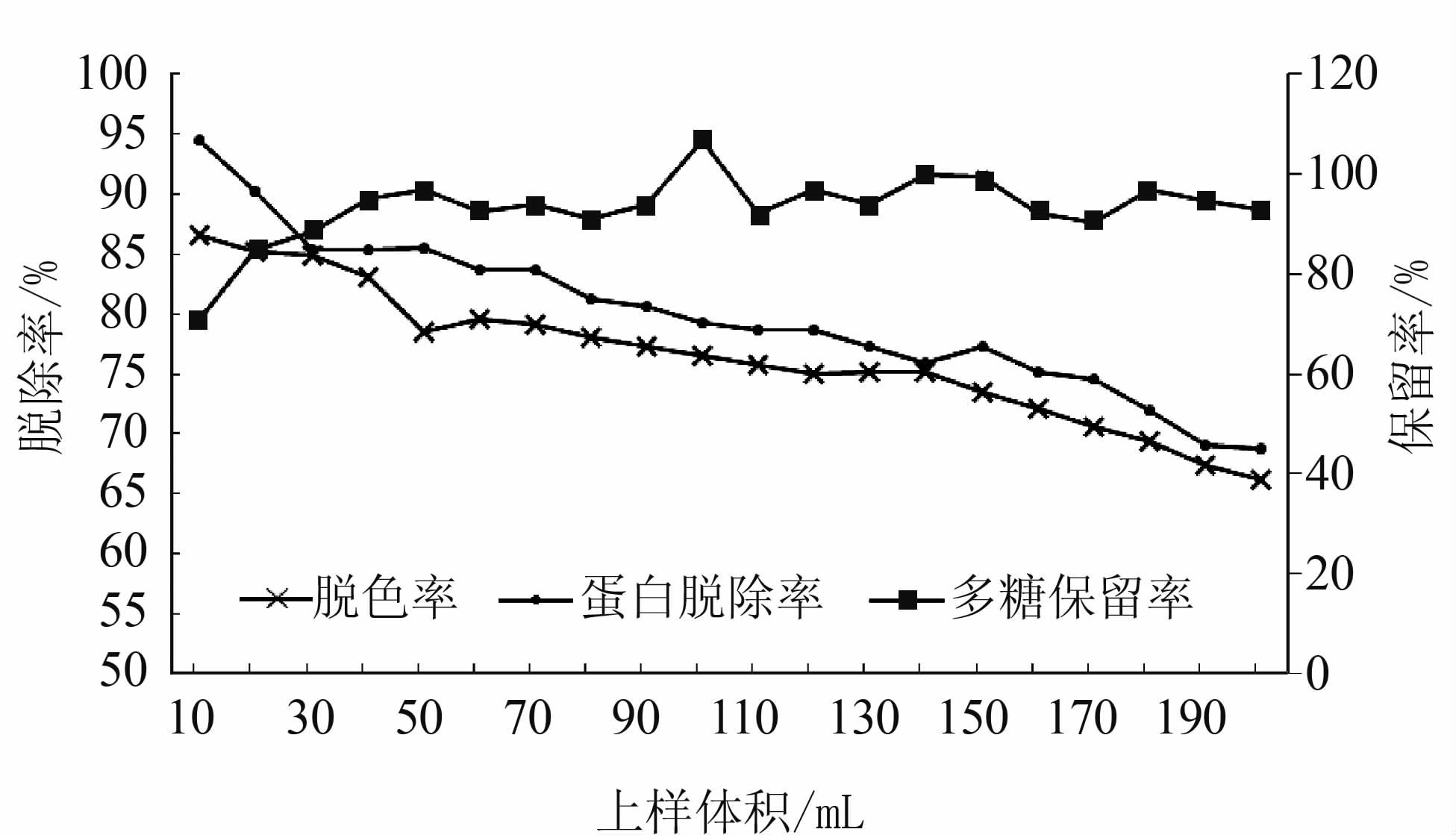
如图 5、图 6所示,随着上样量的增大,树脂对色素和蛋白质的脱除率逐渐降低。HZ830树脂对多糖的保留率受上样量影响不大,始终维持在较高水平,D303树脂对多糖的保留率初期较低但随着上样量的加大,逐渐提高,总体都在80%以上。HZ830树脂的上样量大于60 mL后出现蛋白和色素脱除率的开始缓慢下降,但至试验结束其对蛋白和色素的脱除率始终稳定在60%以上。D303树脂上样量在150 mL以内对色素的吸附率维持在较稳定的水平,而对蛋白的吸附率在120 mL后出现了下降,其最佳上样量应在150 mL左右。
2.4 最佳洗脱剂用量的测定
结果如图 7和图 8,HZ830树脂柱当洗脱剂用量至35 mL左右药液已基本流出树脂柱床。对于D303树脂柱当洗脱液体积达到20 mL时,柱子中的多糖样品已基本流出柱床。增加洗脱体积会稀释回收液并增大回收液的体积,因此,2种树脂柱的洗脱体积都应控制在1 BV (试验中HZ830为30.03 mL,D303为38 mL) 较为合适。
2.5 HZ830和D303树脂柱串联纯化蘑菇粗多糖验证试验
通过HZ830和D303树脂柱串联纯化蘑菇粗多糖的验证试验结果 (表 1) 表明,该方法可以快速高效地去除蘑菇粗多糖中的蛋白质和色素杂质,两类杂质的最终脱除率都大于90%。同时,该方法还具有较高的多糖保留率,最终多糖保留率达到73.49%。
表 1 HZ830和D303树脂柱串联处理前后脱色率、蛋白脱除率和多糖保留率测定结果Table 1. Rates of decolorization, deproteinization and polysaccharides retention on infeed solutionbefore and after HZ830-D303 resin column treatment项目 A460 A595 C蛋白/(μg·mL-1) A620 C糖/(μg·mL-1) 体积/mL 蛋白脱除率/% 色素脱除率/% 糖保留率/% 原液 1.721 1.801 43.4 0.787 99.15 260 - - - 中间取样 0.176 0.728 1.08 0.627 77.77 - 97.32 89.77 78.44 处理 0.13 0.736 2.12 0.534 65.38 290 94.14 91.57 73.49 注:考马斯法测定蛋白时样品稀释10倍;蒽酮法测定糖含量时样品稀释100倍;测定色素含量时不稀释。 3. 讨论与结论
静态吸附动力学表明,在试验范围内D303树脂对色素和蛋白质杂质的吸附速度和吸附率都低于HZ830树脂,但在前期试验中发现D303阴离子交换树脂和HZ830树脂串联使用可以吸附其中带负电荷的杂质进一步提高杂质脱除率,同时D303树脂在参与筛选的树脂中又具有较高的多糖保留率。因而,最终选择HZ830和D303树脂用于双孢蘑菇粗多糖的纯化精制。
在动态吸附法分析2种树脂的吸附容量时发现,HZ830树脂上样200 mL (6.6 BV) 后其仍能保持60%以上的色素与蛋白的脱除率,然而D303树脂上样量超过4 BV后色素与蛋白的脱除率开始急速下降,其吸附容量和速率在串联使用中应为工艺条件的主要限制因素。设计2种树脂需等体积串联使用,而D303串联在HZ830后使用,工作负担较小。故综合考虑在串联使用中,20 mg·mL-1上样质量浓度下,应控制上样量为D303柱体积的5倍左右较合适,折合每克D303树脂的双孢蘑菇粗多糖上样量为126.7 mg。
HZ830树脂为前柱,D303阴离子交换树脂为后柱,柱床体积为52 mL,2种树脂等体积装柱,上样质量浓度为20 mg·mL-1多糖溶液 (pH 8),上样体积260 mL,控制体积流速为1.73 mL·min-1,上样结束后用1BV纯水洗脱,在此工艺条件下双孢蘑菇粗多糖的蛋白质和色素杂质的脱除率均可达90%以上,多糖保留率可达70%以上。同时,该方法操作简单快速,蛋白和色素杂质同时脱除,整个过程除乙醇以外不使用其他有机溶剂,具有安全高效和环保的优点。
-
表 1 HZ830和D303树脂柱串联处理前后脱色率、蛋白脱除率和多糖保留率测定结果
Table 1 Rates of decolorization, deproteinization and polysaccharides retention on infeed solutionbefore and after HZ830-D303 resin column treatment
项目 A460 A595 C蛋白/(μg·mL-1) A620 C糖/(μg·mL-1) 体积/mL 蛋白脱除率/% 色素脱除率/% 糖保留率/% 原液 1.721 1.801 43.4 0.787 99.15 260 - - - 中间取样 0.176 0.728 1.08 0.627 77.77 - 97.32 89.77 78.44 处理 0.13 0.736 2.12 0.534 65.38 290 94.14 91.57 73.49 注:考马斯法测定蛋白时样品稀释10倍;蒽酮法测定糖含量时样品稀释100倍;测定色素含量时不稀释。 -
[1] 朱越雄, 孙海一, 曹广力.野生糙皮侧耳子实体多糖的脱色素效果比较[J].光谱实验室, 2005, 22(5): 1070-1073. http://www.cnki.com.cn/Article/CJFDTOTAL-GPSS200505048.htm [2] 李崇瑛, 王安, 杨涛, 等.食用天然色素的纯化与研究进展[J].中国调味品, 2007, 32(9): 18-22. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGTW200709001.htm [3] 王一敏, 任晓蕾.大孔树脂的应用研究[J].中医药信息, 2008, 25(4):26-28. http://www.cnki.com.cn/Article/CJFDTOTAL-GDQG200502004.htm [4] 杨润亚, 李维焕, 吕芳芳.秀珍菇子实体多糖的提取工艺优化及体外抗氧化性[J].食品与生物技术学报, 2012, (10):1093-1099. DOI: 10.3969/j.issn.1673-1689.2012.10.014 [5] 王惠英, 孙涛, 周冬香, 等.L-赖氨酸与葡萄糖美拉德反应及其产物的抗氧化性能研究[J].食品与发酵工业, 2007, 33 (9): 54-55. http://www.cnki.com.cn/Article/CJFDTOTAL-SPFX200709019.htm [6] 陈毓荃.生物化学实验方法和技术[M].北京:科学出版社, 2009. http://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201603027.htm [7] 袁红波, 张劲松, 贾薇, 等.利用大孔树脂对低分子量灵芝多糖脱色的研究[J].食品工业科技, 2009, 30(3): 204-206. http://www.cnki.com.cn/Article/CJFDTOTAL-SPKJ200903070.htm [8] 罗玺, 唐庆久, 张劲松, 等.灵芝多糖树脂法脱色工艺优化[J].食品科学, 2011, 32 (16):5-10. http://www.cnki.com.cn/Article/CJFDTOTAL-SPKX201116003.htm [9] 吴谋成.食品分析与感官评定[M].北京:中国农业出版社, 2002. http://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201603027.htm -
期刊类型引用(7)
1. 靳铁柱. 响应面法优化桑葚多糖纯化工艺及不同产物的抗运动疲劳活性比较. 保鲜与加工. 2022(04): 67-73 .  百度学术
百度学术
2. 江学斌,成雪鸿,马苗鹏,戴周燕,陈舒瑶,马俊声. 裂褶菌多糖的固体发酵与纯化. 生物技术. 2022(06): 731-736 .  百度学术
百度学术
3. 高渊,杨亚茹,常明昌,孟俊龙,刘靖宇,冯翠萍. 基于代谢组学研究绣球菌多糖对高脂血症大鼠的降血脂作用. 食品科学. 2021(11): 168-175 .  百度学术
百度学术
4. 叶润,陈颐辉,蔡静,李尽哲,孙伟,潘岩. 信阳大别山区云芝多糖的纯化工艺及其抗氧化活性. 食品工业. 2020(11): 70-73 .  百度学术
百度学术
5. 蔺蓓蓓,郑红星,刘祥,周天华,胡红忠,陈琛. 天麻中总多酚的大孔树脂纯化工艺优化. 中国药房. 2019(14): 1965-1969 .  百度学术
百度学术
6. 孙伟,贾凯,叶润,蔡静,赵丽平. 信阳绿茶中多糖的纯化工艺研究. 中国食品添加剂. 2019(08): 92-96 .  百度学术
百度学术
7. 陈琛,李鑫鑫,魏唯,刘祥,田慧玲,冯振斌,胡红忠,郑红星. 大孔树脂纯化天麻多糖的工艺研究. 四川大学学报(自然科学版). 2018(05): 1109-1115 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载: