Identification and Sequencing of Duck Hepatitis A Virus 1 Subtype a Isolated from Mule Ducklings
-
摘要: 自胰腺泛黄的雏半番鸭中分离获得1株病毒(命名为FJ1605株),经RT-PCR检测为鸭1型甲肝病毒,通过鸭胚中和试验发现该株病毒可被鸭1型甲肝病毒亚型(DHAV-1a)高免血清特异性中和,确定该株病毒为鸭1型甲肝病毒亚型。对该株病毒VP1基因进行分子特征分析,发现其核苷酸大小为714 bp,与GenBank登录的DHAV-1a同源性为98.1%~99.7%,与DHAV-1 FJ1220毒株同源性最高达99.7%;而与鸭2型甲肝病毒(DHAV-2)、鸭3型甲肝病毒(DHAV-3)VP1基因的核苷酸同源性仅分别为65.7%和68.3%左右。基于VP1基因的遗传进化分析表明,FJ1605分离株属鸭1型甲肝病毒亚型谱系。以该株病毒对7日龄雏半番鸭进行人工感染试验,可完全复制出同于临床病例的病变。以上结果显示,雏半番鸭也可感染DHAV-1a,且表现为胰腺泛黄。Abstract: A strain of duck hepatitis A virus 1 subtype a (DHAV-1a), coded as FJ1605, was isolated from the mule ducklings with pancreatitis. It was identified by RT-PCR analysis and a neutralization test in duck embryos that showed the strain specifically being neutralized by the anti-DHAV-1a hyperimmune serum. Molecular characteristics of VP1 gene of the virus was analyzed to indicate the nucleotide to be 714 bp in length with a homology with those of other DHAV-1a isolates ranging from 98.1% to 99.7% and sharing the greatest similarity to strain FJ1220.On the other hand, the homology between FJ1605 and DHAV-2 was merely 65.7%; and, that between FJ1605 and DHAV-3, approximately 68.3%. Phylogenetic analysis on the VP1 gene also showed FJ1605 to be in the viral lineage of DHAV-1a. Furthermore, an animal infection test clearly displayed the same clinical symptoms as those shown inclinical cases. Thus, it was concluded that the pancreatitis in the mule ducklings was caused by DHAV-1a.
-
Keywords:
- DHAV-1a /
- mule duckling /
- VP1 gene
-
肌肉生成抑制素(myostatin,MSTN)是一种负向调节骨骼肌的分泌型蛋白,决定肌肉纤维的最终数量[1]。MSTN基因在牛[2]、人[3]以及鼠[1, 4]中的试验表明,该基因的突变会引起肌肉异常发达。皮埃蒙特牛和比利时蓝牛的双肌现象正是MSTN突变导致的[5]。MSTN作为肌肉生长的负调控因子,在家畜家禽中普遍存在,其活性的降低或丧失,会使得肌肉与其他组织的比例大大提高[6-13]。家兔是节粮型草食动物,对我国畜牧业产业结构的调整起着重要的作用。家兔品种的优劣直接影响到养殖的效益,良种问题已成为家兔产业持续健康快速发展的重要因素。随着标记辅助选育的应用,对家兔肌肉生成抑制素基因的研究显得尤为重要。
福建白兔属福建省优良小型肉兔品种,具有耐粗饲、抗病力强、繁殖性能良好、肉质优异等优点,但其存在一个显著的缺点:体重小,生长速度慢,胴体瘦肉率低,影响养殖效益,严重制约其产业化发展。所以选育出既有地方优良特性,又生长速度快、胴体瘦肉率高的福建白兔,对产业的发展至关重要。目前对地方肉兔MSTN基因的研究未见报道。因此本研究以福建白兔肌肉总RNA为模板,用RT-PCR和RACE技术确定福建白兔MSTN基因全长cDNA序列,为进一步开展肉兔MSTN基因的结构、表达以及肉兔品种的繁育等相关研究提供基础数据。
1. 材料与方法
1.1 试验材料
试验兔为武平县武东乡袁田村福建白兔保种场90日龄健康福建白兔。
T-Vector pMDTM20,大肠杆菌感受态细胞JM109,TaKaRa TaqTM酶,M-MLV RTase cDNA合成试剂盒,RACE试剂盒,均购自大连TaKaRa公司。Trizol试剂,购自Invitrogen公司。质粒提取试剂盒购自OMEGA公司。
1.2 试验方法
1.2.1 福建白兔肌肉总RNA的提取
无菌采取福建白兔肌肉组织,迅速置于液氮中,用Trizol试剂按说明书提取总RNA,并检测其纯度和完整性。
1.2.2 引物合成及测序
根据NCBI Genbank中已知的哺乳动物MSTN基因全长cDNA序列及RACE试验,使用Primer Premier 5.0软件设计引物(表 1)。
表 1 设计的引物Table 1. Primer sequence名称 序列(5′-3′) 长度/(mers) F1(已知序列) GTTTATGCTGATCGTGGCTG 20 R1(已知序列) CACCCACAGCGGTCTACTAC 20 F2(已知序列) CTGTGTAATGCATGCACTTG 20 F3(3′RACE) AGCAGGTCCTTGCTGTACTC 20 F4(3′RACE) CCAATTACTGCTCTGGAGAC 20 F5(3′RACE) GAGCACTCAACAGAATCACG 20 R4(5′RACE) CTTCCAAAGAGCCATCACTG 20 R6(5′RACE) CTGAACGTCGTACTGATC 18 YZF1(序列验证) CTCAAGCTGTTCATGCAT 18 YZR1(序列验证) CCAACCATTGCATGTATTC 19 1.2.3 MSTN基因已知同源CDS序列扩增
以福建白兔肌肉cDNA为模板,用引物F1- R1,采用RT-PCR方法进行扩增。使用PrimeScript 1st Strand cDNA试剂盒合成cDNA。反应体系如下:总RNA 1 μL,Oligo dT引物(50 μmol·L-1)1 μL,Random 6 mers(20 μmol·L-1)1 μL,dNTP混合物(10 mmol·L-1) 1 μL,3′RACE接头(5 μmol·L-1)1 μL,DEPC处理水加至7.5 μL;反应条件为:56℃ 5 min,立即冰上放置2 min。PCR扩增,使用Tks Gflex DNA聚合酶进行PCR扩增。第一轮PCR反应体系:上述cDNA反应液1 μL, 2×Gflex PCR缓冲液(Mg2+, dNTP plus)25 μL,Tks Gflex DNA聚合酶(1.25 U·μL-1),F1(20 μmol·L-1)1 μL, R1(20 μmol·L-1)1 μL,加ddH2O至50 μL。反应条件为:94℃ 1 min;98℃ 10 s,55℃ 15 s,68℃ 1 min,30个循环。第二轮反应体系:第一轮的PCR反应液1 μL,其他组分与第一轮一样。反应条件与第一轮相同。取5 μL进行1%琼脂糖凝胶电泳检测PCR结果。利用DNA胶回收试剂盒对PCR产物进行胶回收,使用引物F2、R1进行测序。
1.2.4 3′RACE
引物设计与合成见表 1中的F5、F4。按照3′-Full RACE Core Set with PrimeScript RTase试剂盒进行扩增。电泳,切胶回收,连接,转化,培养,提取质粒,用引物F3对质粒进行测序。
1.2.5 5′RACE
引物设计与合成见表 1中的R4、R6。5′RACE使用TaKaRa 5′-Full RACE Kit with TAP试剂盒进行。其他步骤同3′RACE。
1.2.6 Race序列验证
引物设计与合成见表 1中的YZF1、YZR1。PCR扩增使用Tks GflexTM DNA聚合酶进行PCR扩增。PCR反应体系:已知序列验证的cDNA反应液2 μL,2×Gflex PCR缓冲液(Mg2+, dNTP plus)25 μL,Tks Gflex DNA聚合酶(1.25 U·μL-1) 1 μL, YZF1(20 μmol·L-1)1 μL, YZR1(20 μmol·L-1)1 μL,加ddH2O至50 μL。反应条件为:94℃ 1 min;98℃ 10 s,55℃ 30 s,68℃ 2 min,35个循环。取5 μL进行1%琼脂糖凝胶电泳。
1.2.7 扩增片段的克隆、测序和序列分析
使用琼脂凝胶DNA提取试剂盒进行PCR产物的胶回收,使用DNA连接酶,将已纯化的3′和5′产物与T-Vector pMDTM 20连接,热转化至大肠杆菌感受态细胞JM109中,培养,提取质粒测序。采用DNAStar和在线蛋白质分析软件对序列进行分析。
2. 结果与分析
2.1 总RNA
提取的总RNA经分光光度计检测的OD260 nm/OD280 nm值在1.8~2.0,说明总RNA无蛋白质和其他杂质污染,电泳检测结果显示有5S、18S和28S等3条清晰的条带(图 1-A),表明总RNA完整无降解。
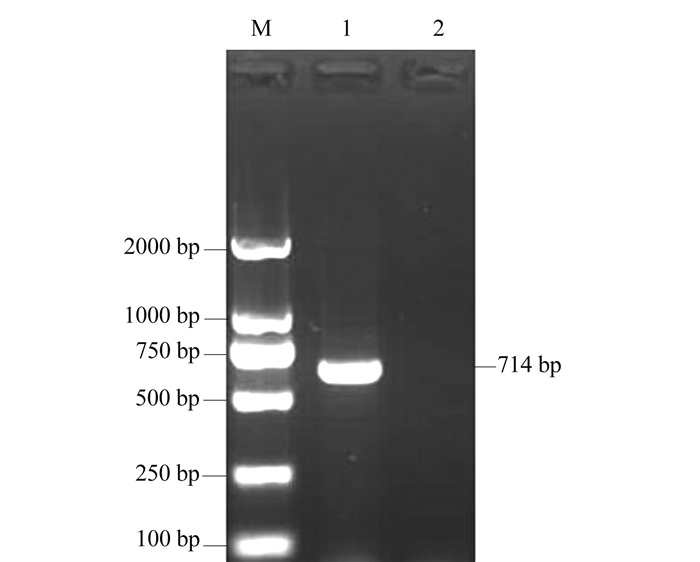
2.2 福建白兔MSTN基因RT-PCR扩增
以福建白兔肌肉cDNA为模板,用引物F1- R1,采用RT-PCR方法分别扩增出1条特异带,长度约为1 100 bp(图 1-B),经测序为1 128bp。3′端未知序列为287 bp(图 1-C);5′端未知序列为136 bp(图 1-D);经PCR验证,得到的RACE序列是根据已知序列得到的,片段约为1 100 bp,与已知序列吻合(图 1-E)。
2.3 序列分析
福建白兔MSTN基因信息。通过对测序所得到的福建白兔MSTN基因全长cDNA序列(GenBank登录号:KX084386)进行分析发现,该基因的全长为1 551 bp,其中5′非翻译区136 bp,3′非翻译区287 bp,开放阅读框(ORF)1 128 bp,共编码375个氨基酸,起始密码子为ATG,终止密码子为TGA。采用DNASTAR软件分析MSTN基因序列中的碱基含量,分别为A 33.16%、T 21.28%、G 25.53%、C 20.04%,G+C的含量(41.34%)低于A+T的含量(58.69%)(图 2)。
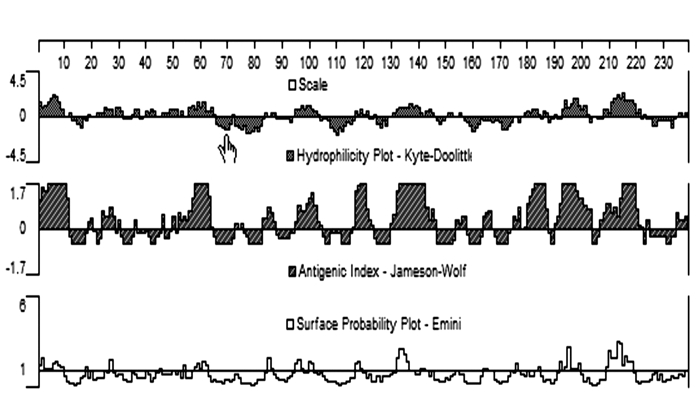
通过在线SignalP 4.1软件预测MSTN蛋白在第20和21氨基酸之间存在信号肽的切割位点(D=0.492,D-cutoff=0.450),整个蛋白包括20个氨基酸的信号肽和355个氨基酸的成熟肽(图 3)。
利用NCBI数据库在线工具Conserved Domain Search Service软件分析发现,MSTN蛋白在第97~768核苷酸处编码的氨基酸存在1个TGF-β前肽超家族结构域,在第841~1 125核苷酸处编码的氨基酸存在1个TGF-β家族结构域(图 4)。
2.4 福建白兔与其他动物MSTN核苷酸序列同源性分析与进化树构建
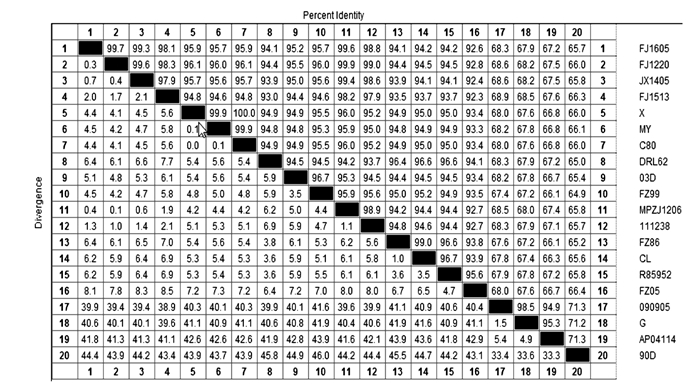
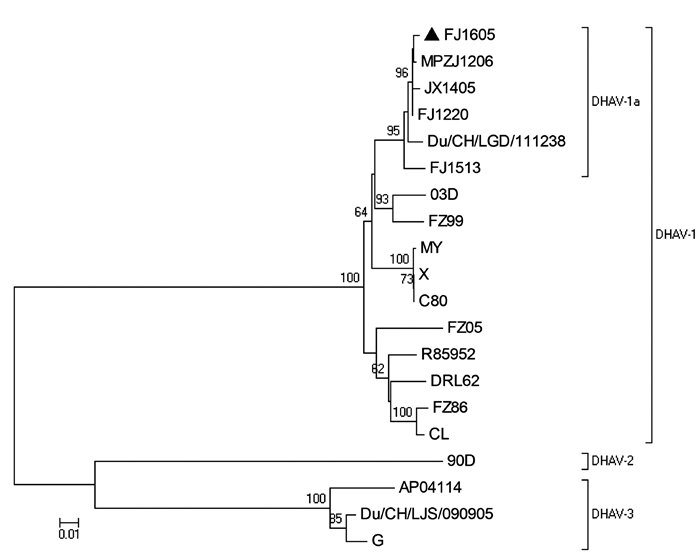
福建白兔与穴兔(NM_001109821.1)、人(NM_005259.2)、猪(HM241657.1)、家鼠(BC103677.1)、马(NM_001081817.1)、牛(NM_001001525.2)、绵羊(AM992883.1)、鹿(EF629535.1)、狒狒(AF019619.1)、猩猩(NM_001079919.1)、猴(NM_001080119.1)的MSTN核苷酸序列同源性分别为99.9%、92.8%、94.4%、86.9%、95.2%、89.1%、91.0%、90.3%、95.9%、96.4%、95.9%(图 5)。根据猪和人以及其他哺乳动物MSTN核苷酸序列绘制进化树,结果显示福建白兔与穴兔的同源性最高,其次为与人、狒狒、猩猩、猴的同源性(图 6)。
3. 讨论与结论
随着对MSTN的作用机制及其调控机制的深入了解,MSTN基因得到遗传育种学家、医学家等的青睐,在医药界以及畜牧业具有很好的应用前景。McPherron等[1]发现小鼠Myostatin cDNA序列编码376个氨基酸,具有TGF-β超家族的典型结构,由于与其他TGF-β家族成员的同源性很低(最高为45%),所以另归新的一类并命名为GDF-8。猪MSTN基因的cDNA序列1 756 bp,编码375个氨基酸,猪MSTN基因核苷酸序列和氨基酸序列与人、马、黑猩猩、小鼠、狗等同源性较高,均在95%以上,最高达98%[14]。西藏小型猪MSTN基因同样编码375个氨基酸,推导的氨基酸序列与其他物种相比同源性高,与版纳微型猪相似性高达99%[15]。辽育白牛[16]、天祝白牦牛[17]、牦牛[18]、山羊[19]MSTN基因编码区全长为1 128 bp,共编码375个氨基酸,其蛋白与其他哺乳动物相比,同源性较高。在人、猪、马、牛和羊等哺乳动物中MSTN基因结构和编码区高度保守,绵羊和牛编码区基本相同,只有1~3个碱基的差别[20]。MSTN基因利用RNAi技术进行干扰,在山羊的成纤维细胞[21]和肌细胞[22]、绵羊的胚胎[23]、鸡胚胎成纤维细胞[24]、转基因羊[25]中均使得MSTN表达下调或被抑制,促进细胞分化、增殖,转基因羊体重和肌纤维直径增加加快。通过锌指核酶技术分别敲除五指山小型猪[26]和鲁西黄牛[27]MSTN基因的成功,说明敲减或敲除MSTN基因能够安全有效地促进家畜肌肉生长。这将成为培育高产肉量家畜品种的技术手段。同时MSTN基因的变化对人体健康也至关重要,在动物模型中已经有用抗MSTN的疗法治疗肌肉萎缩症的报道,MSTN基因对人类肌肉萎缩、老化、糖尿病及其他相关疾病甚至癌症方面也有较深入的研究[28]。
家兔是节粮型草食动物,发展家兔养殖对我国畜牧业产业结构的调整起着重要的作用,家兔品种的优劣直接影响到养殖的效益,良种问题已成为家兔产业持续健康快速发展的重要因素。同时由于兔是研究人类疾病的动物模型,因此采用基因打靶的方法生产MSTN基因缺失兔,不但有助于在畜牧业生产上改良育种,提高胴体瘦肉率,也可以作为实验动物模型进行肌肉萎缩等相关疾病的研究。本研究利用RACE技术通过对福建白兔MSTN基因的cDNA序列进行克隆测序,结果发现该基因的全长为1 551 bp,其中5′非翻译区136 bp,3′非翻译区287 bp,1 128 bp的开放阅读框编码375个氨基酸,MSTN蛋白在第97~768核苷酸处编码的氨基酸存在1个TGF-β前肽超家族结构域,在第841~1 125核苷酸处编码的氨基酸存在1个TGF-β家族结构域。MSTN蛋白在第20和21氨基酸之间存在信号肽的切割位点,整个蛋白包括20个氨基酸的信号肽和355个氨基酸的成熟肽。与穴兔、人、猪、家鼠、马、牛、绵羊、鹿、狒狒、猩猩、猴的MSTN核苷酸序列同源性分别为99.9%、92.8%、94.4%、86.9%、95.2%、89.1%、91.0%、90.3%、95.9%、96.4%、95.9%,说明福建白兔的MSTN基因保守性较高,且与穴兔的同源性最高。
本研究初步掌握福建白兔MSTN基因的结构特点,为进一步开展家兔MSTN基因的结构、表达调控及其突变与肌肉等相关性状方面的研究奠定了理论基础。
-
表 1 参考毒株相关信息
Table 1 Information on reference viruses
登录号 名称 基因型 分离地 分离时间 KF924552 MPZJ1206 DHAV-1a 中国 2012 KC904272 FJ1220 DHAV-1a 中国 2012 KX507161 JX1405 DHAV-1a 中国 2014 KX507163 FJ1513 DHAV-1a 中国 2015 JQ804521 Du/CH/LGD/111238 DHAV-1a 中国 2011 DQ249299 03D DHAV-1 中国 2005* JX390984 FZ99 DHAV-1 中国 1999 GU9446771 MY DHAV-1 中国 2006 JQ316452 X DHAV-1 中国 2011* DQ864514 C80 DHAV-1 中国 2006* JX390983 FZ05 DHAV-1 中国 2005 DQ226541 R85952 DHAV-1 美国 2005* DQ219396 DRL62 DHAV-1 韩国 2005* JX390982 FZ86 DHAV-1 中国 1986 EF427899 CL DHAV-1 中国 2007* EF067924 90D DHAV-2 中国 2007* JF828996 Du/CH/LJS/090905 DHAV-3 中国 2009 EU755009 G DHAV-3 中国 1999 DQ812093 AP-04114 DHAV-3 韩国 2003 注:*表示基因序列提交时间。 -
[1] OWENS R A, DI S, LI S F, et al. Virus Taxonomy:Ninth Report of the International Committee on Taxonomy of Viruses[C]//Ninth Report of the International Committee on Taxonomy of Viruses, 2011:1221-1234.
[2] SAIF Y M. 禽病学[M]. 苏敬良, 高福, 索勋, 译. 11版. 北京: 中国农业出版社, 2005: 376-389. [3] 傅光华, 陈红梅, 黄瑜, 等.雏番鸭胰腺型鸭1型甲肝病毒分离鉴定及VP1基因分析[J].福建农业学报, 2012, 27(9):43-45. http://www.fjnyxb.cn/CN/abstract/abstract1994.shtml [4] 傅光华, 黄瑜, 傅秋玲, 等.致胰腺泛黄鸭1型甲肝病毒全基因组分子特征[J].微生物学报, 2014, 54(9):1082-1089. http://www.cnki.com.cn/Article/CJFDTOTAL-WSXB201409014.htm [5] 陈珍, 傅秋玲, 陈红梅, 等.胰腺型、经典型1型甲肝病毒对雏鸭的致病性差异[J].福建农业学报, 2013, 28(10):939-942. DOI: 10.3969/j.issn.1008-0384.2013.10.002 [6] 傅秋玲, 陈珍, 黄瑜, 等.鸭1型甲肝病毒亚型的鉴定[J].中国兽医杂志, 2015, 51(7):36-38. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGXJ201611001103.htm [7] 殷震, 刘景华.动物病毒学:第2版[M].北京:科学出版社, 1997:343-354. [8] 傅秋玲, 刘伟, 黄瑜, 等.鸭1型甲肝病毒亚型VP1蛋白单克隆抗体的研制及鉴定[J].中国畜牧兽医, 2017, 44(2):554-560. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGXJ201611001103.htm [9] 郭玉璞, 蒋金书.鸭病[M].北京:北京农业大学出版社, 1988:30-31. [10] 陈红梅, 施少华, 程龙飞, 等.鹅源鸭1型甲肝病毒的分离与鉴定[J].福建农业学报, 2012, 27(11):1165-1168. DOI: 10.3969/j.issn.1008-0384.2012.11.004 [11] DING C, ZHANG D. Molecular analysis of duck hepatitis virus 1[J]. Virology, 2007, 361:9-17. DOI: 10.1016/j.virol.2007.01.007
[12] KIM M C, KWON Y K, JOH S J, et al. Molecular analysis of duck hepatitis virus type 1 reveal s a novel lineage close to t he genus parechovirus in t he family Picornaviridae[J]. J Gen Virol, 2006, 87:3307-3316. DOI: 10.1099/vir.0.81804-0
[13] TSENG C H, KNOWLES N J, TSAI H J. Molecular analysis of duck hepatitis virus type 1 indicates t hat it should be assigned to a new genus[J]. Virus Res, 2007, 123:190-203. DOI: 10.1016/j.virusres.2006.09.007
[14] KIM M C, KWON Y K, JOH S J, et al. Recent Koren isolates of duck hepatitis virus revealed t he presence of a new geno2 and serotype when compared to duck hepatitis virus type 1 type strain[J]. Arch Virol, 2007, 152:2059-2072. DOI: 10.1007/s00705-007-1023-0
[15] FU Y, PAN M, WANG X Y, et al. Molecular detection and typing of duck hepatitis A virus directly from clinical specimens[J]. Vet Microbiol, 2008, 131(3/4):247-257. http://europepmc.org/abstract/med/18462894
-
期刊类型引用(6)
1. 贺彩霞,李长忠,保长虹,王丽楠,严青春,金文杰,赵娟,王国杰,简生龙,王振吉,陈艳霞. 花斑裸鲤MSTN-1基因克隆及表达特性分析. 华北农学报. 2024(01): 228-238 .  百度学术
百度学术
2. 宋兴超,孟金柱,赵园园,吴震洋,安清明. 贵州白山羊肌肉生长抑制素(MSTN)基因生物信息学预测与系统进化分析. 特产研究. 2023(05): 16-21 .  百度学术
百度学术
3. 杨鹏,黄涛,徐梦思. 肌肉生长抑制素基因在重要经济动物育种中的研究进展. 新疆农垦科技. 2023(05): 61-64 .  百度学术
百度学术
4. 陈冬金,桑雷,孙世坤,陈岩锋,王锦祥,谢喜平. 福建白兔与新西兰白兔生长和生化指标比较. 福建农业学报. 2019(04): 433-437 .  本站查看
本站查看
5. 王真,潘赟,毕谊,雷初朝,陈宏,蓝贤勇. 动物MSTN基因作用机制及突变研究. 中国牛业科学. 2019(04): 22-32 .  百度学术
百度学术
6. 张朝霞,杨林,丁海生,黄冬维,汪勇,程广龙,赵辉玲. 2018年国内外家兔遗传育种及繁殖研究进展. 中国畜牧兽医. 2019(11): 3307-3315 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载: