Establishment and Monitoring Analysis of Fluorescence RT-PCR for Detection of Bovine Viral Diarrhea Virus in Swine
-
摘要: 根据牛病毒性腹泻病毒(BVDV)5'-UTR保守序列建立的特异性荧光RT-PCR,对采自福州市周边屠宰场的359份屠宰猪血清进行BVDV感染的病原学检测。结果待检的359份血清样品BVDV阳性52份,阳性率为14.5%(52/359)。对其中13份BVDV阳性样品5'端UTR片段进行序列测定分析,发现所测13份BVDV阳性样品5'端UTR片段均与VEDEVAC进化谱系较为密切,均为基因Ⅰ型。以上结果表明以牛源BVDV建立的特异性荧光RT-PCR方法适用于猪源BVDV感染的监测,并揭示福州市屠宰猪存在BVDV感染。
-
关键词:
- 猪源牛病毒性腹泻病毒 /
- 荧光RT-PCR /
- 屠宰猪 /
- 病原学检测
Abstract: The study was aimed at developing a quantitative real-time fluorescence reverse transcriptase PCR(qRT-PCR) assay according to the conserved gene sequence of BVDV 5'-UTR for detection of bovine viral diarrhea virus(BVDV) obtained from 359 slaughtered swine serum samples of slaughterhouses in Fuzhou Prefecture. The results showed that the BVDV positive rate of slaughtered swines was 14.5%(52 positive samples out of 359 ones). Sequence analysis on 5'-UTR fragments of 13 BVDV positive samples showed that 5'-UTR fragments of all tested samples were closely related to VEDEVAC evolution lineages, all of which were genotype I. It was indicated that the specific qRT-PCR method established based on BVDV was suitable for detection of BVDV in swines. And the BVDV infection was common in slaughtered swines of Fuzhou Prefecture.-
Keywords:
- BVDV in swine /
- fluorescence RT-PCR /
- slaughtered swine /
- pathogenic detection
-
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)是一种从表现腹泻或胃肠道溃疡的发病牛分离获得重要传染病病原,与猪瘟病毒(Classical swine fever virus, CSFV)、边界病毒(Border disease virus, BDV)同属于黄病毒科瘟病毒属成员[1]。BVDV最早于1953年美国的发病牛,随后Fernelius等[2]证实该病毒可自然感染猪。该病毒除了可感染牛和猪外,还可感染羊、骆驼、鹿及许多野生动物[3]。世界各地均有BVDV自然感染猪的报道[2-6],我国最早由王新平等于1996年从疑似猪瘟病例中检测并分离获得该病毒[8],目前在我国吉林、辽宁、浙江、上海以及福建等地均有猪感染BVDV的报道[3, 7-10]。猪感染BVDV常不表现出临床症状或仅表现为亚临床症状,出现类似于感染温和型猪瘟的临床症状和病理变化[11],使得临床上难以区别BVDV与猪瘟病毒感染,另外BVDV和猪瘟病毒在免疫学上还存在着广泛的交叉性,给该病及猪瘟的诊断和有效防制带来极大困难。本研究通过建立检测猪源BVDV的荧光RT-PCR方法对福州市屠宰猪感染BVDV进行病原学检测,以期为深入开展猪源BVDV的研究奠定基础。
1. 材料与方法
1.1 细胞和病毒
牛病毒性腹泻病毒(BVDV)参考株Oregon C24V、猪瘟兔化弱毒株(HCLV)、猪繁殖与呼吸综合征病毒(PRRSV)CH-1R株、猪传染性胃肠炎病毒(TGEV)HB08株由福州大北农生物技术有限公司提供;牛肾传代细胞(MDBK)由天津出入境检验检疫局提供。
1.2 主要试剂和仪器
MEM营养液购自GIBCO公司;裂解液Trizol购自Invitrogen公司;AMV反转录酶、RNA酶抑制剂、dNTP Mixture、Taq DNA聚合酶、Random primer购自宝生物工程(大连)有限公司;CFX96型荧光定量PCR仪购自BioRad公司。
1.3 检测样品来源
待检的359份屠宰猪血清样品,采自福州市周边屠宰场。
1.4 引物设计合成
根据GenBank中BVDV参考毒株及其登录号:Oregon C24V(AF091605)、NADL(M31182)、ZM-95(AF526381)、New York′93(AF502399)、SD1(M96751) 等核苷酸序列,选取5′-UTR高度保守且特异核苷酸区域,设计1对用于检测BVDV特异性引物和荧光探针,上游引物:5 ′-CCA TGC CCT TAG TAG GAC TAG CA-3′,下游引物:5′-AAC CAC TGA CGA CTA CCC TGT ACT-3′,荧光探针:5′-FAM-CCA TCC AAC GAA CTC ACC ACT GTT GC -3′(TAMRA)。
病毒5′-UTR序列扩增引物:上游引物BVDVF104: 5′-CAT GCC CTT AGT AGG ACT AGC A-3′,下游引物BVDVR390:CAA CTC CAT DTG CCA TGT ACA-3′,预期扩增产物大小为297 bp,以上引物和探针均由生工生物工程(上海)股份有限公司合成。
1.5 样品处理与病毒RNA提取
1.5.1 样品处理
取2 mL屠宰猪血清,加5 mL预冷的PBS匀浆混匀,经4℃ 5 000 r·min-1离心10 min,取上清液备用。
1.5.2 参考病毒悬液和毒力测定
将BVDV参考毒株Oregon C24V用MDBK细胞进行常规培养,收获病毒冻融3次,5 000 r·min-1离心10 min,取上清液即为参考病毒悬液,置-70 ℃保存备用。
将参考病毒悬液用维持液作10-1至10-8倍比稀释,每个滴度加入96孔细胞培养板4个孔,每孔50 μL。将生长良好单层的细胞用细胞分散液消化后,用生长液配制成3×105·mL-1的细胞悬液加到细胞板各孔内,每孔100 μL。同时每板设4孔细胞对照。置37 ℃二氧化碳培养箱中培养观察至6 d,记录细胞病变,按Reed-muench方法计算细胞半数感染量(TCID50/50 μL)。
1.5.3 病毒RNA提取
取样品上清液200 μL,加入600 μL Trizol,轻混1 min,室温静止10 min;再加入200 μL氯仿,轻混1 min,室温静止10 min;于4℃ 12 000 r·min-1离心15 min,取离心上层液,加入1倍体积的异丙醇,于4℃ 12 000 r·min-1离心10 min,弃上清,加入600 (L 75%乙醇,于4℃ 10 000 r·min-1离心5 min,小心顷弃乙醇,置于超净台中晾干,用20 μL RNase-Free water溶解,立即进行反转录或者-75℃冻存待用;同时设立BVDV Oregon C24V毒株为阳性对照、MDBK细胞为阴性对照各1管。
1.6 荧光RT-PCR扩增
1.6.1 荧光RT-PCR反应条件
荧光RT-PCR反应体系25 μL,在0.2 mL PCR反应管中进行(表 1)。荧光RT-PCR扩增反应程序:42℃ 30 min(反转录);92℃ 3 min(预变性);92℃ 10 s,45℃ 30 s,72℃ 1 min,5个循环;92℃ 10 s,60℃ 30 s(荧光收集),35个循环。
表 1 荧光RT-PCR反应体系Table 1. The reaction system of Fluorescence RT-PCR成分 用量/μL 10×RT-PCR buffer solution 2.5 MgCl2(25 mmol·L-1) 5.0 dNTP(10 mmol·L-1) 2.5 RNasin(40 U·μL-1) 0.5 AMV reverse transcriptase (5 U·μL-1) 0.5 Taq DNA polymerase(5 U·μL-1) 0.5 upstream primers(10 μmol·L-1) 0.5 downstream primers(10 μmol·L-1) 0.5 TaqMan probe(5 μmol·L-1) 0.5 RNA 5.0 RNase-Free water 7.0 1.6.2 敏感性试验
参考病毒悬液10倍倍比稀释,分别取稀释病毒提取总RNA,按1.6.1中的反应体系及方法在相同条件下进行荧光RT-PCR检测,判断所能扩增的最大稀释度,以测定其敏感性。
1.6.3 特异性试验
按1.5.2中方法制备HCLV毒株、PRRS毒株、TGEV毒株的RNA模板各1管,设立MDBK细胞为阴性对照,以进行特异性试验。
1.6.4 重复性试验
将BVDV参考病毒悬液单一样品在相同条件下进行5次重复检测以确定组内重复性,单一样品分别经5次提取RNA进行重复检测以确定组间重复性。
1.6.5 荧光RT-PCR的应用检测
利用建立的荧光RT-PCR方法对359份屠宰猪血清样品进行应用性检测。
1.6.6 结果判定
(1) 质控标准:阴性对照无Ct值并且无扩增曲线;且阳性对照的Ct值应≤28,并出现特定的扩增曲线,则实验成立。如阴性对照和阳性对照条件不满足以上条件,则实验无效。
(2) 结果判定:无Ct值或Ct>35,表明血清样品提取物中无BVDV核酸,结果为阴性。Ct≤30且出现特定的扩增曲线,表示血清样品提取物中存在BVDV核酸,结果为阳性。
(3) 测序与分析:将13份BVDV阳性猪血清荧光RT-PCR扩增产物进行测序,并分析。
2. 结果与分析
2.1 荧光RT-PCR检测及鉴定结果
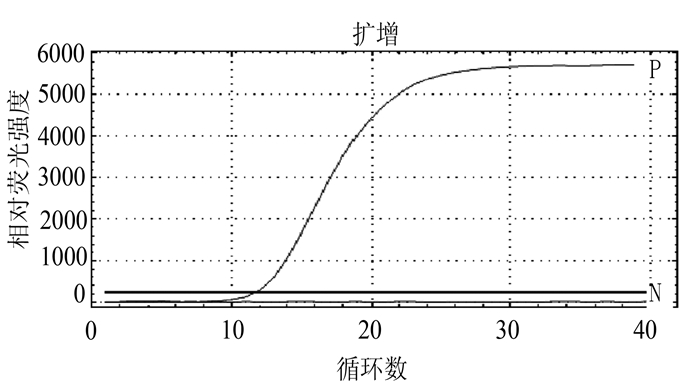
对BVDV参考毒株进行荧光RT-PCR检测,结果呈现典型的扩增曲线,与预期一致,而阴性对照则没有扩增曲线,见图 1。
2.2 荧光RT-PCR敏感性试验结果
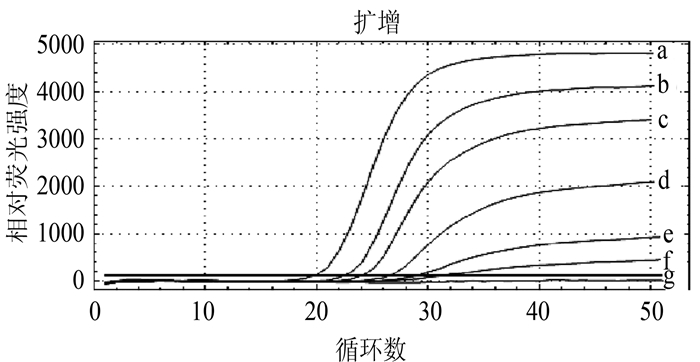
参考病毒悬液毒力测定结果,按Reed-muench方法计算细胞半数感染量105.2TCID50/50 μL,10倍倍比稀释病毒即103、104、105、106、107、108、109,使病毒毒力依次为1×102.2、1×101.2、1×100.2、1×10-0.8、1×10-1.8、1×10-2.8、1×10-3.8TCID50/50 μL,分别取各稀释病毒提取的RNA进行荧光RT-PCR检测,结果表明该方法最低检出限为1×10-2.8 TCID50/50 μL,结果见图 2。
2.3 荧光RT-PCR特异性试验结果
应用同一对引物和探针进行的荧光RT-PCR特异性检测中,BVDV参考毒株呈现典型的扩增曲线,而HCLV毒株、PRRS毒株、TGEV毒株和MDBK细胞均无扩增曲线。
2.4 荧光RT-PCR重复性试验结果
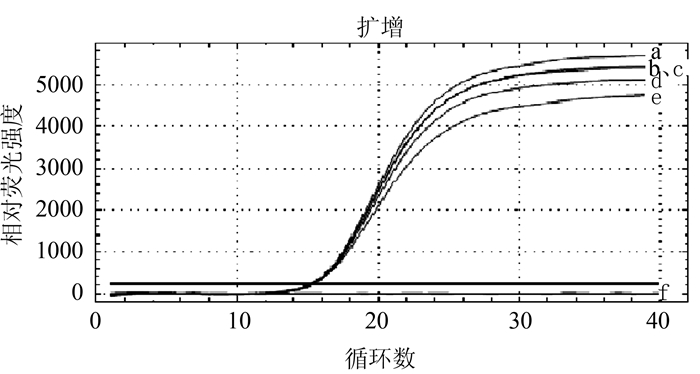
将BVDV参考病毒单一样品在相同条件下进行5次荧光RT-PCR重复检测,结果均获得相同的扩增曲线,结果表明具有良好的组内重复性;将单一样品分别经5次提取RNA进行荧光RT-PCR重复检测,获得的一致的扩增曲线,结果表明该方法具有良好的组间重复性,见图 3。
2.5 荧光RT-PCR的应用检测
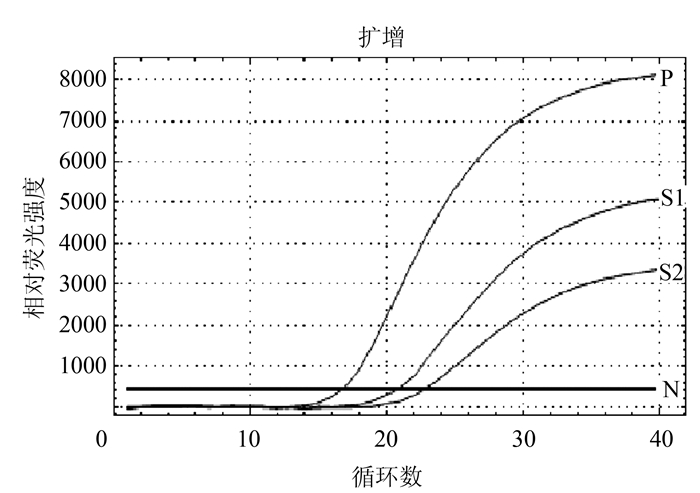
经所建立荧光RT-PCR检测,359份屠宰猪血清中有52份BVDV阳性,屠宰猪血样中BVDV阳性率为14.5%;表明福州市周边屠宰猪存在BVDV感染,猪源BVDV实时荧光定量RT-PCR扩增结果见图 4。
2.6 序列分析
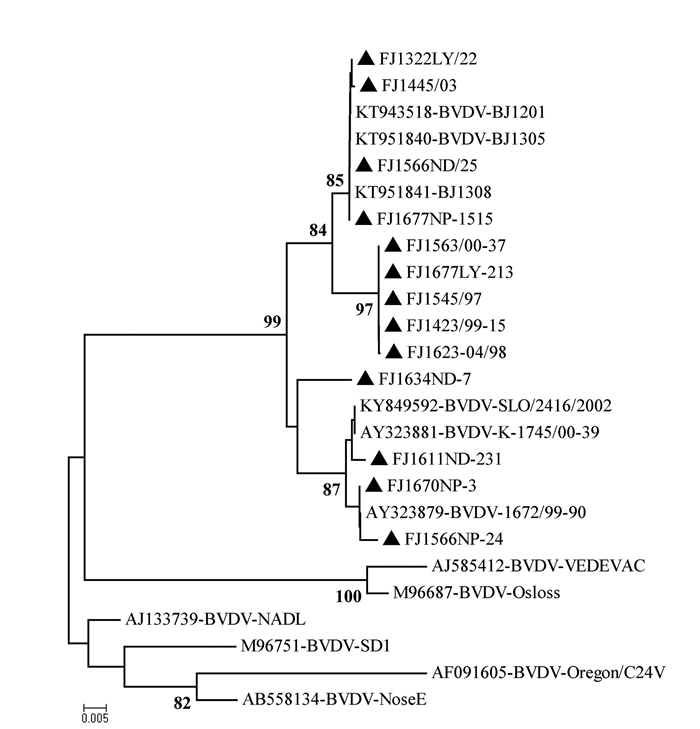
13份BVDV阳性血清中病毒5′-UTR序列分析表明,所检测的阳性样品5′-UTR序列同源性在96.2%~100%,与已发布的牛源BVDV分离株1672/99-90、SLO/2416/2002、1745/00-39及BJ1308等序列同源性在95.3%~99.7%,与Oregon C24V(AF091605)、NADL(M31182) 及SD1(M96751) 等BVDV参考毒株的序列同源性在87.5%~92.8%。
BVDV5′-UTR序列遗传进化分析表明(图 5),13份样品中的BVDV均为基因1d型毒株,其中FJ1634ND-7、FJ1670NP-3、FJ1566NP-24和FJ1611ND-231与斯诺文尼亚早期分离株1672/99-90及SLO/2416/2002[12]等处于同一进化分支,其余9份样品与我国2012-2013年北京分离毒株BJ1201及BJ1308[13]等处于同一进化分支,所有13份样品中的BVDV均与Oregon C24V、NADL及SD1等BVDV参考毒株差异较大,处于不同进化分支。以上扩增产物测序工作在福州博尚生物技术有限公司进行。
3. 讨论与结论
由于牛病毒性腹泻病毒(BVDV)和猪瘟病毒(CSFV)存在着广泛的抗原交叉,这给BVDV的诊断带来了难度,而荧光RT-PCR方法作为一种先进的检测方法,相比传统方法具有较大的优点[7]。通过对福州市周边屠宰猪的359份血清样品的检测结果,表明本研究以牛病毒性腹泻病毒参考株Oregon C24V建立的检测猪源BVDV的荧光RT-PCR方法具有良好的特异性和重复性,且对13份BVDV阳性样品5`端UTR片段进行序列测定分析发现,与VEDEVAC进化谱系较为密切,均为基因Ⅰ型。这些表明所建立的猪源BVDV的荧光RT-PCR方法适用于猪感染BVDV的监测。
以建立的检测猪源BVDV的荧光RT-PCR方法对359份屠宰猪血清样品检出52份BVDV阳性,BVDV感染阳性率为14.5%,略高于已有研究报道的福建省猪群血清样品BVDV感染阳性率8.1%[4],但低于福州市周边猪群BVDV抗体阳性率34.7%[2],表明福州市屠宰猪和福建省养殖猪群均存在BVDV感染。
王新平等(1996) 在国内首次报道猪感染BVDV后[9],福建、河南、浙江、安徽、湖南、江西、广西和辽宁等地均有猪感染BVDV报道。这种可能适应猪体的BVDV感染后会引起猪群较严重的后果[3],猪感染BVDV后会出现类似慢性猪瘟的临床症状和病理变化;母猪感染BVDV会导致繁殖障碍、产仔数下降和流产;先天性感染的仔猪出生后可产生BVDV抗体,会形成持续性感染和免疫耐受,可长期带毒、并且可将BVDV传播给易感的母猪,由于BVDV与猪瘟病毒的交叉反应性,BVDV还可降低猪瘟疫苗的免疫效果,猪群中BVDV的感染不但增加了BVD的防控难度,还使猪瘟的防控受到干扰[8-10]。可见,我国不同猪群存在BVDV感染,引起类似慢性猪瘟的临床症状和病理变化,并给养猪业带来经济损失,因此应引起有关部门的高度重视。
-
表 1 荧光RT-PCR反应体系
Table 1 The reaction system of Fluorescence RT-PCR
成分 用量/μL 10×RT-PCR buffer solution 2.5 MgCl2(25 mmol·L-1) 5.0 dNTP(10 mmol·L-1) 2.5 RNasin(40 U·μL-1) 0.5 AMV reverse transcriptase (5 U·μL-1) 0.5 Taq DNA polymerase(5 U·μL-1) 0.5 upstream primers(10 μmol·L-1) 0.5 downstream primers(10 μmol·L-1) 0.5 TaqMan probe(5 μmol·L-1) 0.5 RNA 5.0 RNase-Free water 7.0 -
[1] FAUQUET C. Virus taxonomy:classification and nomenclature of viruses:eighth report of the International Committee on the Taxonomy of Viruses[M]. Academic Press, 2005.
[2] FERNELIUS A L, AMTOWER W C, LAMBERT G, et al. Bovine Viral Diarrhea Virus in swine:characteristics of virus recovered from naturally and experimentally infected swine[J]. Can J Comp Med, 1973, 37(1):13-20. http://www.ncbi.nlm.nih.gov/pubmed/4265548
[3] 朱礼倩, 周艳君, 于海, 等.牛病毒性腹泻在中国的流行现状分析[J].中国动物传染病学报, 2011, 19(5):83-86. http://www.cnki.com.cn/Article/CJFDTOTAL-ZSJB201105017.htm [4] 徐磊, 曾亮明, 王玉玲, 等.福建省猪群感染牛病毒性腹泻病毒的病原学检测与分析[J].畜牧兽医学报, 2014, 45(12):2006-2012. http://www.cnki.com.cn/Article/CJFDTOTAL-XMSY201412014.htm [5] 曾亮明, 徐磊, 王玉玲, 等.猪血清中牛病毒性腹泻病毒抗体ELISA检测方法的建立与应用[J].中国兽医科学, 2014, 44(09):944-950. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGSY201409011.htm [6] 吴文辉. 猪群BVDV感染状况调查及成因初步分析[D]. 上海: 上海交通大学, 2011. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=sytx201104014&dbname=CJFD&dbcode=CJFQ [7] 邓宇, 张荣, 丛雁方, 等.猪源牛病毒性腹泻病毒实时荧光定量PCR检测方法的建立[J].畜牧兽医学报, 2011, 42(7):1046-1050. http://www.cnki.com.cn/Article/CJFDTOTAL-XMSY201107023.htm [8] 王新平, 涂长春, 李红卫, 等.从可疑猪瘟病料中检出牛病毒性腹泻粘膜病病毒[J].中国兽医学报, 1996, 16(4):341-345. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zsyx604.007&dbname=CJFD&dbcode=CJFQ [9] 孙泉云, 张苏华, 沈悦, 等.奶牛和猪血清中牛病毒性腹泻-粘膜病抗体的检测[J].畜牧与兽医, 2004, 36(2):30-31. http://www.cnki.com.cn/Article/CJFDTOTAL-XMYS200402018.htm [10] 宋永峰, 张志, 张燕霞, 等.猪源牛病毒性腹泻病毒的流行初探[J].中国动物检疫, 2008, 25(7):25-27. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGDW200807018.htm [11] TERPSTRA C, WENSVOORT G. Natural infections of pigs with bovine viral diarrhea virus associated with signs resembling swine fever[J]. Res Vet Sci, 1988, 45(2):137-142. http://www.ncbi.nlm.nih.gov/pubmed/2848298
[12] TOPLAK I, SANDVIK T, BARLI-MAGANJA D, et al. Genetic typing of bovine viral diarrhoea virus:most Slovenian isolates are of genotypes 1d and 1f[J]. Veterinary Microbiology, 2004, 99(3-4):175. DOI: 10.1016/j.vetmic.2003.12.004
[13] CAI D, SONG Q, WANG J, et al. Genomic characterization of three bovine viral diarrhea virus isolates from cattle.[J]. Archives of Virology, 2016, 161(12):1-4. http://www.ncbi.nlm.nih.gov/pubmed/27613287
-
期刊类型引用(7)
1. 杨彩虹,漆晶晶,李能琴,王吉成. 牛病毒性腹泻-黏膜病的流行现状与防控策略. 养殖与饲料. 2024(07): 79-84 .  百度学术
百度学术
2. 张帆帆,韦家禛,李杰茂,谭美芳,胡利珍,曾艳兵,龚小齐,杨群,徐俊. 赤羽病病毒、牛疱疹病毒1型和牛病毒性腹泻病毒多重RT-PCR检测方法的建立. 福建农业学报. 2024(11): 1242-1247 .  本站查看
本站查看
3. 徐磊,曾亮明,张体银,刘毅发,杨慧,余勋信,林秋敏,刘小龙,傅光华,白泉阳,黄瑜,张渊魁. 福建省猪源BVDV流行病学检测分析及其对CSFV抗体的影响. 中国兽医学报. 2021(06): 1031-1037+1059 .  百度学术
百度学术
4. 陶洁,洪天旗,王亨,张信军,刘惠莉,朱国强. 我国牛病毒性腹泻流行现状与防控策略. 微生物学通报. 2019(07): 1850-1858 .  百度学术
百度学术
5. 刘艳,王鸣秋,李诗瑶,朱必婷,杨硕,马弋,张莉. 基于实时荧光定量PCR和数字PCR的肉制品中牛源性成分检测. 现代食品科技. 2019(07): 254-260 .  百度学术
百度学术
6. 康彪,高闪电,独军政,田占成,殷宏,胡永浩. 牛病毒性腹泻病毒E1蛋白的原核表达及多克隆抗体的制备. 动物医学进展. 2018(11): 30-34 .  百度学术
百度学术
7. 刘存,崔尚金. 牛病毒性腹泻病毒SYBR Green荧光定量PCR方法的建立及其应用. 现代畜牧兽医. 2018(12): 9-13 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载: