Genomic Library Construction of Monokaryons with Different Mating Type of Agaricus bisporus
-
摘要: 对24个双孢蘑菇不育单孢进行两两杂交配对, 以菌株9608为基准, 获得了2种不同交配型的不育单孢菌株A+:9601、9608、9609、9612、AgQG841-1、AgLH830-4、AgLH830-6、AgQL8125-5;A-:9602、9603、9604、9607、Ag2k811-1、M7206-1、M7206-2、M7206-11、M7206-13。将这2种菌株进行DNA提取, 并构建DNA文库, 对文库进行酶切验证, 用SalⅠ酶切, 可切出20、14、9 kb等3个片段, 其中20、9 kb为λ载体的左右臂, 插入片段为14 kb, 与预期相符, 说明文库的质量较高。Abstract: In this study, twenty-two Agaricus bisporus monokaryons strains were pairwisely paired.Based on strain 9608, two different mating types of monokaryons were obtained.A + strains:9601, 9608, 9609, 9612, AgQG841-1, AgLH830-4, AgLH830-6, AgQL8125-5.A-:9602, 9603, 9604, 9607, Ag2k811-1, M7206-1, M7206-2, M7206-11, M7206-13.The genomic DNA of two strains were extracted and DNA library were constructed.The library was verified by restriction enzyme digestion with SalⅠ.The 20 kb, 14 kb and 9 kb 3 fragments were cut out, of which 20 kb and 9 kb were the inserted into the left and right arms of lambda vector and the fragment of 14kb, was the insertion genomic DNA fragments.Enzyme digestion result was in line with expectations, indicating the higher quality of the library.
-
Keywords:
- Agaricus bisporus /
- monokaryons /
- mating type factor /
- genomic library
-
双孢蘑菇Agaricus bisporus是世界上栽培最为广泛的食用菌, 具有非常重要的经济价值。2015年, 我国双孢蘑菇的鲜菇年产量达340万t左右, 已成为我国农业重要的支撑产业[1]。然而, 有限的高产优质双孢蘑菇品种严重地阻碍了双孢蘑菇生产的发展, 虽然菌类遗传育种专家作出了巨大的努力, 但是采用常规的杂交育种技术还是很难获得新的优良菌种, 这主要是由于双孢蘑菇属二极性次级同宗结合的单因子交配型系统, 大多数担孢子是异核可育的, 不能用于杂交, 只有同核不育孢子才能用于杂交。此外, 双孢蘑菇菌丝细胞呈多核状态, 缺乏锁状联合[2-3]。这就造成了鉴定单核体或同核体间杂交的困难, 常常盲目地进行杂交, 严重阻碍了杂交育种工作的进行。
目前, 我们的研究团队能够应用同工酶标记, 在菌丝阶段可以对异核体和同核体进行区分和鉴定, 大大提高了双孢蘑菇杂交育种效率[4]。但不同的同核体菌株仍存在相同或不同的交配型, 只有具不同交配型因子的同核体之间才有可能配对成功, 随机配对获得杂交子的成功率仍然很低。前人研究表明, 双孢蘑菇是单因子交配型系统, 由单个A位点控制(A+/A-)且交配型基因A因子与mip基因紧密连锁, 但A因子的序列尚未见报道[5-6]。为了更有效地开展育种工作, 必须开展对双孢蘑菇交配型A因子的研究。本研究对课题组长期以来获得的双孢蘑菇不育单孢菌株进行杂交配对, 对不同交配型的不育单孢进行分组, 并构建基因组文库, 为下一步进一步克隆交配型A因子基因鉴定基础。
1. 材料和方法
1.1 菌株
供试菌株及来源见表 1。
表 1 供试菌株编号及来源Table 1. Strains tested number and Origin编号 菌株 来源 1 9601 分离自 As2796 2 9602 分离自 As2796 3 9603 分离自 As2796 4 9604 分离自 As2796 5 9605 分离自 As2796 6 9606 分离自 As2796 7 9607 分离自 As2796 8 9608 分离自 As2796 9 9609 分离自 As2796 10 9612 分离自 As2796 11 AgQG841-1 分离自野生菌株 AgQG841 12 AgQG841-3 分离自野生菌株 AgQG841 13 AgQG841-9 分离自野生菌株 AgQG841 14 Ag2k811-1 分离自野生菌株 Ag2k811 15 Ag2k811-3 分离自野生菌株 Ag2k811 16 AgLH830-4 分离自野生菌株 AgLH830 17 AgLH830-6 分离自野生菌株 AgLH830 18 AgLH830-7 分离自野生菌株 AgLH830 19 AgQL8125-3 分离自野生菌株 AgQL8125 20 AgQL8125-5 分离自野生菌株 AgQL8125 21 M7206-1 分离自 M7206 22 M7206-2 分离自 M7206 23 M7206-11 分离自 M7206 24 M7206-13 分离自 M7206 1.2 试验方法
1.2.1 同核不育株间配对杂交
不同菌株分离的同核不育体配对接种在PDA平板上, 置24℃条件下进行培养, 观察配对菌丝间的接触点是否有融合, 把菌丝接触点间恢复正常生长的菌丝体转接到PDA试管中进行纯化培养。
1.2.2 同核不育菌株同工酶谱的电泳分析
按王贤樵等的方法进行[4]。
1.3 DNA提取方法
参照参考文献[7]的方法。
1.4 基因组文库的构建
采用上述方法所提的50 μg DNA溶解在500 μL的SalⅠ的酶切缓冲液中, 加入0.25 U SalⅠ, 在30℃下酶切30 min。0.4%低熔点琼脂糖(1 ×TAE缓冲液)电泳分离DNA片段, 回收9~23 kb基因组片段。将基因组DNA片段(3 μg)与BamHⅠ消化的λ载体(5 μg)用T4 DNA连接酶在25℃连接4 h。取连接产物与包装蛋白混和, 22℃反应4 h。包装产物梯度稀释后侵染感受态E.coli C600hfl。铺平板培养进行文库的滴度测定。以上详细步骤参照文献[8-9]。
2. 结果与分析
2.1 同核不育单孢菌株的生物学鉴定
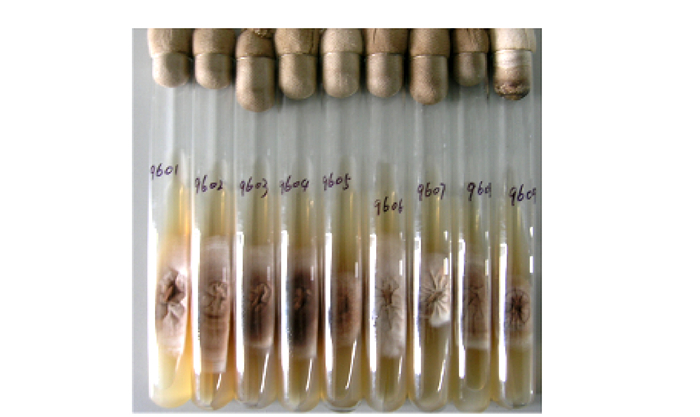
同核不育单孢菌株通常是生长速度慢、紧贴培养基表面生长的甸旬型, 菌丝弱细, 部分菌株会分泌出褐色色素, 在PDA培养基的生长情况见图 1~3。
2.2 同核不育单孢菌株的酯酶同工酶谱鉴定
同核不育单孢在酯酶同工酶的带型上表现为特殊的S型(图 4)。
![]() 图 4 同核不育单孢的酯酶同工酶带型注:泳道1为对照菌株As2796, 泳道2~10为表 1中对应的1~9号菌株。Figure 4. Esterase isoenzyme patterns of monokaryons
图 4 同核不育单孢的酯酶同工酶带型注:泳道1为对照菌株As2796, 泳道2~10为表 1中对应的1~9号菌株。Figure 4. Esterase isoenzyme patterns of monokaryons2.2 同核不育单孢间的杂交配对
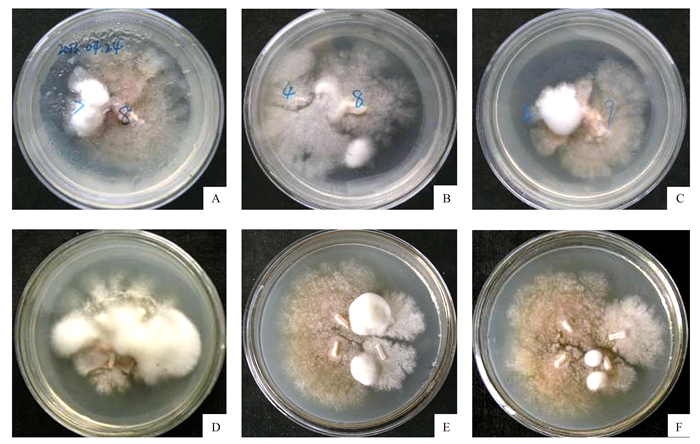
将表 1中的24个不育单孢菌株进行两两间的杂交配对, 再根据同种交配型因子交配不亲和性原理, 将获得的不育单孢进行分组。部分杂交配对结果如图 5所示。两两间杂交配对的结果见表 2。
表 2 供试菌株两两配对杂交Table 2. Two-pair hybridization of the tested strains1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 1 + + + 2 + + 3 + + 4 + + + + + 5 + 6 7 + + 8 + + + + + 9 + + 10 + + + 11 + 12 + 13 14 + + 15 + 16 + 17 + + 18 19 20 + 21 + + + + 22 + 23 + 24 + 注:“+”表示菌株间可以杂交配对。 从配对结果可以看出来自不同的菌株的分离的不育单孢可杂交的概率也是不一样, 其中菌株编号4号、8号, 21号可杂交的概率较高, 其他的不育单孢可杂交的概率较低。其中以8号菌株为例, 菌株2号、4号、7号、21号、22号可以与8号菌株杂交, 根据同种交配型因子杂交不亲和性, 将8号菌株定为菌株A+, 那么菌株2号、4号、7号、21号、22号为A-。其余的菌株, 根据不同交配型可性亲和原则, 可将上述的供试菌株分为A+:1、8、9、10、11、16、17、20。对应菌株编号为:9601、9608、9609、9612、AgQG841-1、AgLH830-4、AgLH830-6、AgQL8125-5。A-:2、3、4、7、14、21、22、23、24。对应菌株编号为:9602、9603、9604、9607、Ag2k811-1、M7206-1、M7206-2、M7206-11、M7206-13。
2.3 基因组文库的构建
将上述获得的A+菌株:9601、9608、9609、9612、AgQG841-1、AgLH830-4、AgLH830-6、AgQL8125-5行基因组DNA的提取, 并将这些DNA混合成A+ DNA池。同样将A-菌株:9602、9603、9604、9607、Ag2k811-1、M7206-1、M7206-2、M7206-11、M7206-13进行基因组DNA的提取, 并混合A-DNA池。
将A+DNA池和A-DNA池进行酶切, 用SalⅠ酶切, 电泳。酶切前和酶切后的电泳图谱见图 6。
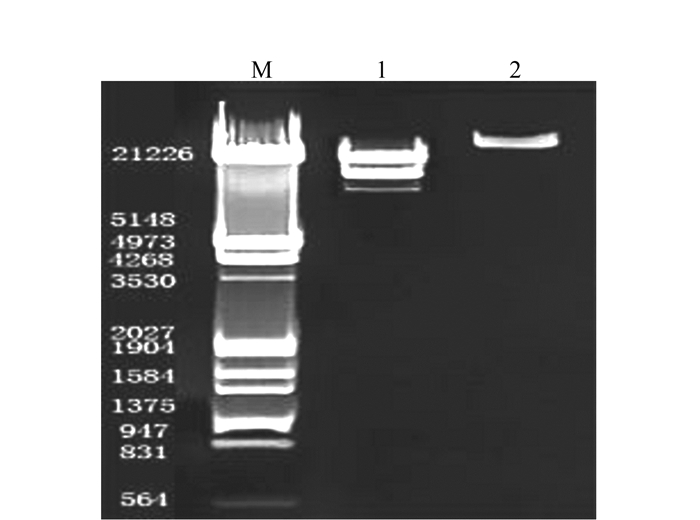
参照上述基因组文库的构建方法, 将酶切后的基因组DNA和酶切后的噬菌体λDNA, 进行连接、包装、侵染、铺平板及滴度测定。从平板上随机挑取分隔良好的几个噬菌斑, 提取重组后的噬菌体λDNA, 并进行酶切验证(图 7)。
结果可以看出, 经SalⅠ酶切, 可切出20 kb、14 kb和9 kb 3个片段, 其中20 kb和9 kb为λ载体的左右臂, 插入片段为14 kb, 与预期相符, 说明文库的质量较高。
3. 结果与讨论
3.1
高分子质量的DNA对构建基因组文库尤为重要。如果小片段多, 会导致DNA转化噬菌体的效率低。在研究中发现, 在高浓度钾离子存在下, SDS与多糖或蛋白质结合生成复合物, 能有效除去多糖, 所得DNA易溶解。DNA提取过程中只使用SDS, 而不使用CTAB, 减少了对DNA的损害。另外我们用30%乙醇溶解DNA后, 于4℃放置过夜, 能进一步去除多糖和其他杂质, 提高所提取的DNA纯度。
3.2
本研究中所提的双孢蘑菇大片段DNA经SalⅠ部分酶切, 低熔点琼脂糖电泳回收9~23 kb的片段, 回收的DNA片段与BamHⅠ消化的λ载体连接, 获得了2×105个转化子。在真菌的基因组为107~108 bp, 当重组转化子为2×103~2×104时, 可保证99 %的基因存在于基因组文库中, 说明了构建的文库基因覆盖率较全。
3.3
本研究通过单孢菌株间的两两配对杂交, 获得了2种不同交配型的双孢蘑菇不育单孢菌株, 并构建了这2种不同交配型的不育单孢的基因组文库, 这为下一步克隆双孢蘑菇的交配型基因以及研究不同交配型的不育单孢的基因组成差异奠定了基础。
-
图 4 同核不育单孢的酯酶同工酶带型
注:泳道1为对照菌株As2796, 泳道2~10为表 1中对应的1~9号菌株。
Figure 4. Esterase isoenzyme patterns of monokaryons
表 1 供试菌株编号及来源
Table 1 Strains tested number and Origin
编号 菌株 来源 1 9601 分离自 As2796 2 9602 分离自 As2796 3 9603 分离自 As2796 4 9604 分离自 As2796 5 9605 分离自 As2796 6 9606 分离自 As2796 7 9607 分离自 As2796 8 9608 分离自 As2796 9 9609 分离自 As2796 10 9612 分离自 As2796 11 AgQG841-1 分离自野生菌株 AgQG841 12 AgQG841-3 分离自野生菌株 AgQG841 13 AgQG841-9 分离自野生菌株 AgQG841 14 Ag2k811-1 分离自野生菌株 Ag2k811 15 Ag2k811-3 分离自野生菌株 Ag2k811 16 AgLH830-4 分离自野生菌株 AgLH830 17 AgLH830-6 分离自野生菌株 AgLH830 18 AgLH830-7 分离自野生菌株 AgLH830 19 AgQL8125-3 分离自野生菌株 AgQL8125 20 AgQL8125-5 分离自野生菌株 AgQL8125 21 M7206-1 分离自 M7206 22 M7206-2 分离自 M7206 23 M7206-11 分离自 M7206 24 M7206-13 分离自 M7206 表 2 供试菌株两两配对杂交
Table 2 Two-pair hybridization of the tested strains
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 1 + + + 2 + + 3 + + 4 + + + + + 5 + 6 7 + + 8 + + + + + 9 + + 10 + + + 11 + 12 + 13 14 + + 15 + 16 + 17 + + 18 19 20 + 21 + + + + 22 + 23 + 24 + 注:“+”表示菌株间可以杂交配对。 -
[1] 王泽生, 蔡丹凤, 谢宝贵, 等.福建省食用菌学科发展研究报告[J].海峡科学, 2016, (1):119-127. http://mall.cnki.net/magazine/Article/YJYZ201601019.htm [2] RAPER CA, RAPER JR, MILLER RE.Genetic Analysis of the Life Cycle of Agaricus bisporus[J].Mycologia.1972, 64(5):1088-1117. DOI: 10.2307/3758075
[3] RAPER CA, KAYE G.Sexual and Other Relationships in the Genus Agaricus[J].J Gen Microbiol.1978, 105(1):135-151. DOI: 10.1099/00221287-105-1-135
[4] 王贤樵, 王泽生.同工酶技术及其在双孢蘑菇选育种中的应用—Ⅰ.双孢蘑菇同工酶标记筛选研究[J].中国食用菌, 1989, (6):7-12. [5] XU J, KERRIGAN RW, HORGEN PA, et al.Localization of the mating type gene in Agaricus bisporus[J].Appl.Environ.Microbiol.1993, 59(9):3044-3049. DOI: 10.1007/BF00279535.pdf
[6] LI Y, CHALLEN MP, ELLIOTT TJ, et al.Molecular Analysis of Breeding Behavior in Agaricus species[J].Mushroom Sci.2004, 16:103-109. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC91888/
[7] 陈美元, 廖剑华, 李洪荣, 等.双孢蘑菇栽培菌株遗传多样性的DNA指纹分析[J].中国农学通报, 2009, 25(4):149-156. http://d.old.wanfangdata.com.cn/Periodical/zgnxtb200904036 [8] 王泽生, 陈美元, 廖剑华, 等.双孢蘑菇部分cDNA文库的构建及筛选[J].菌物学报, 2004, (1):63-65. http://d.old.wanfangdata.com.cn/Periodical/jwxt200401013 [9] J·萨姆布鲁克, EF·弗里奇, T·曼尼阿蒂斯.分子克隆实验指南:第2版[M].北京:科学出版社, 1992:1-1062. -
期刊类型引用(1)
1. 王翠, 郭仲杰, 尤洁, 宋飞飞, 蔡志欣. 双孢蘑菇产、质量性状相关分子标记的初步研究. 福建农业科技. 2018(07): 1-5 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: