Epidemiology and Genetic Variation of Duck Hepatitis A Virus Type 1 Circulating in Some Regions of China
-
摘要: 为了解鸭群中鸭1型甲肝病毒(DHAV-1)的流行及其分子变异情况,对2015-2016年福建、广东、浙江及江西鸭群采集的327份临床样品进行检测、病毒分离鉴定、序列测定与分析。结果表明,自327份临床样品中检出DHAV-1阳性样品35份,阳性率10.7%;从阳性样品中分离获得23株DHAV-1,主要来自30日龄以内的麻鸭和半番鸭。对DHAV-1的VP1基因分子特征及遗传变异分析,表明23株病毒VP1基因核苷酸序列同源性介于93.3%~99.9%,分属2个病毒亚群,两亚群间的遗传距离为0.06。23株临床分离株中有18株与引起雏鸭胰腺泛黄的毒株(MPZJ1206株)处于同一亚群,为目前流行的优势毒株,与国内外疫苗株核苷酸同源性在91.3%~96.2%,存在较大差异。由此可见,我国福建省及周边地区鸭群中不同DHAV-1流行株之间及流行毒株与疫苗株间均存在不同程度的差异。Abstract: The epidemic prevalence and molecular variation of duck hepatitis A virus type 1 (DHAV-1) were investigated. Three-hundred-twenty-seven clinical samples collected in 2015-2016 from Fujian and surrounding provinces were used for the virus detection and isolation. Thirty-five of these samples (10.7%)were found to be pusitive for DHAV-1. From the 35 positive specimens, 23 strains were isolated, mainly from shelducks and mule ducks of less than 30-day-old. The sequence analysis on VP1 gene of the 23 isolates showed 93.3%-99.9% homology, and the strains could be divided into 2 subgroups with a genetic distance of 0.06. Among them, 18 isolates clustered in a currently prevalent subgroup which contains the virus (MPZJ1206)causing yellowed-pancreas in ducklings. On the other hand, all 23 isolates shared merely 91.3-96.2% nucleotide sequence homology with the strain used for vaccination abroad and domestically. It appeared that genetic variations existed among the various DHAV-1 strains.
-
Keywords:
- duck hepatitis A virus type 1 /
- VP1 gene /
- variation analysis
-
秋石斛Dendrobium spp.为兰科石斛属常绿类石斛,又称蝴蝶石斛、杜兰、石斛、石兰等。多是以原产于新几内亚的热带原生种蝴蝶石斛Dendrobium Phalaenopsis为亲本育成的杂交品种。秋石斛是近几年在中国插花市场上流行的花卉,种类繁多,花形花姿优美,色彩艳丽,花期长,具有较高的观赏价值,在国内切花和盆花的市场需求量逐年增加,对优质种苗的需求迫切。
近年我国大陆引进了不少秋石斛品种,但是种苗生产主要靠分株繁殖,繁殖速度慢,而且病毒不断积累严重影响品质,难以满足生产需求。利用植物组织培养技术可以解决秋石斛种苗快速繁殖的问题,目前国内对秋石斛组织培养的技术报道仅见少量报道[1-4],且集中在其原球茎诱导途径繁殖技术。黄志明等[1]曾报道蝴蝶石斛兰以嫩芽茎尖为外植体,先诱导无菌球胚,后经球胚增殖与芽分化、壮苗等环节建立了育苗技术。罗岚等[2-3]报道以秋石解兰小苗的茎尖为材料,先诱导原球茎,后经原球茎增殖、芽分化、生根等环节建立了离体繁殖技术。陈亚鸿等[4]报道秋石斛梦系列品种在原球茎增殖、芽分化过程通过培养基中添加活性炭和胰蛋白胨降低褐化率的研究。目前,采用丛生芽诱导途径,建立秋石斛‘三亚阳光’丛生芽组培快繁技术研究尚未见报道。
秋石斛同其他兰科植物一样,在种苗生产上,较为理想的繁殖途径是丛生芽诱导途径,通过芽生芽达到快速繁殖,能最大限度保持母株的优良特性,笔者在文心兰系列品种种苗组培快繁中有较多实践应用[5]。当前,秋石斛种苗培养效率低、组培苗抗性差,移栽死亡率高等问题还未得到系统解决,急需通过改进培养方法与培养基配方的创新来优化种苗的快速繁殖技术体系。本研究探讨基本培养基、植物生长调节剂等对‘三亚阳光’丛生芽诱导、增殖与生根培养等关键环节的影响,旨在探索优质种苗工厂化快繁技术,为提高其种苗商业化生产效率提供技术基础。
1. 材料与方法
1.1 试验材料
秋石斛‘三亚阳光’(Dendrobium spp.‘Sanya Sunny’),海南引进的品种,选择健壮植株抽长的幼芽作为启动培养的外植体。试验在福建省特色花卉工程技术研究中心花卉育种实验室进行。
1.2 试验方法
1.2.1 外植体消毒灭菌处理
选择健康母株为外植体取材对象,当新芽萌发1.0~2.0 cm时,先进行套袋隔离,待新芽具3~5个节时进行取样,去除叶片后,用自来水冲洗干净,然后在超净工作台上将外植体放入无菌容器中,先用75%的酒精浸泡30~50 s,随后转入0.1%升汞溶液中进行摇床振荡消毒5~6 min,然后更换升汞溶液1次,再摇床振荡消毒4~5 min,最后在超净工作台上,将无菌容器中的外植体取出用无菌水冲洗4~5次,再用无菌纸巾吸干水分,备用。
1.2.2 丛生芽诱导与增殖
切取带节茎段和茎尖,接种到丛生芽诱导培养基配方为MS+6-BA 2.0 mg·L-1+NAA 0.1 mg·L-1 +白糖30 g·L-1 +琼脂粉5.0 g·L-1的培养基中进行丛生芽诱导培养。获得的丛生芽作为增殖培养试验材料。
丛生芽增殖采用4因素3水平L9 (43)正交设计,选择基本培养基(花宝1号、改良1#、改良2#)、6-BA、NAA、白糖为试验因素,代号分别为A、B、C、D,各因素取3个水平(表 1)。各处理培养基均附加琼脂粉3.0 g·L-1、卡拉胶3.0 g·L-1。每处理接种10瓶,每瓶接种12团(每团带2~3个小芽),3次重复。增殖培养50 d时统计丛生芽增殖系数(增殖系数=增殖芽数/接种芽数)。
表 1 L9 (43)因素及水平Table 1. Factors and levels of orthogonal design L9 (43)编号 基本培养基 6-BA/
(mg·L-1)NAA/
(mg·L-1)白糖/
(g·L-1)1 花宝1号 1.0 0.05 20.0 2 改良1# 2.0 0.1 30.0 3 改良2# 3.0 0.2 40.0 注:花宝1号用量3.0 g·L-1。 改良1#基本培养基的组分为:KNO31 900 mg·L-1、NH4NO31 750 mg·L-1、KH2PO4250 mg·L-1、MgSO4·7H2O 500 mg·L-1、CaCl2·2H2O 440 mg·L-1、MnSO4·H2O 16.9 mg·L-1、ZnSO4·7H2O 8.6 mg·L-1、H3BO36.2 mg·L-1、KI 0.83 mg·L-1、Na2MoO2·2H2O 0.25 mg·L-1、CoCl2·6H2O 0.025 mg·L-1、CuSO4·5H2O 0.025 mg·L-1、FeSO4·7H2O 27.8 mg·L-1、Na2·EDTA 37.3 mg·L-1、盐酸硫胺素5.0 mg·L-1、烟酸2.0 mg·L-1、盐酸吡哆醇1.0 mg·L-1、甘氨酸2.0 mg·L-1、肌醇150 mg·L-1。
改良2#基本培养基的组分为:花宝1号15 000 mg·L-1、KNO3 950 mg·L-1、NH4NO3 875 mg·L-1、KH2PO4 125 mg·L-1、MgSO4·7H2O 250 mg·L-1、CaCl2·2H2O 440 mg·L-1、MnSO4·H2O 16.9 mg·L-1、ZnSO4·7H2O 8.6 mg·L-1、H3BO36.2 mg·L-1、KI 0.83 mg·L-1、Na2MoO2·2H2O 0.25 mg·L-1、CoCl2·6H2O 0.025 mg·L-1、CuSO4·5H2O 0.025 mg·L-1、FeSO4·7H2O 27.8 mg·L-1、Na2·EDTA 37.3 mg·L-1、盐酸硫胺素8.0 mg·L-1、烟酸3.0 mg·L-1、盐酸吡哆醇1.0 mg·L-1、甘氨酸2.0 mg·L-1、肌醇150 mg·L-1。
1.2.3 生根培养
以改良3#为基本培养基,添加不同含量的NAA(0.1、0.3、0.5 mg·L-1)和IBA(0.1、0.3、0.5 mg·L-1)、活性炭0.5 g·L-1、白糖20 g·L-1、香蕉泥100.0 g·L-1、琼脂粉3.6 g·L-1及卡拉胶3.6 g·L-1。6个处理,每处理接种5瓶,每瓶接种25株,3次重复。生根培养75 d时统计生根情况。
改良3#基本培养基的组分为:花宝1号12 000 mg·L-1、KNO3800 mg·L-1、NH4NO3500 mg·L-1、KH2PO4125 mg·L-1、MgSO4·7H2O 185 mg·L-1、CaCl2·2H2O 220 mg·L-1、MnSO4·H2O 16.9 mg·L-1、ZnSO4·7H2O 8.6 mg·L-1、H3BO36.2 mg·L-1、KI 0.83 mg·L-1、Na2MoO2·2H2O 0.25 mg·L-1、CoCl2·6H2O 0.025 mg·L-1、CuSO4·5H2O 0.025 mg·L-1、FeSO4·7H2O 27.8 mg·L-1、Na2·EDTA 37.3 mg·L-1、盐酸硫胺素3.0 mg·L-1、烟酸1.0 mg·L-1、盐酸吡哆醇5.0 mg·L-1、甘氨酸2.0 mg·L-1、肌醇100 mg·L-1。
1.2.4 炼苗移栽
当苗高6.0~8.0 cm,具4~6片叶时,将瓶苗放置于遮光率70%~80%的温室中炼苗,并进行移栽种植,定期观测移栽成活率及生长表现。
1.2.5 培养方式与培养条件
以650 mL的组培瓶为培养容器,采用固体培养基培养方式,pH值5.6~5.8,培养温度为(25±2)℃,光强为2 000~2 500 lx,光照时间为12 h·d -1。
以上试剂均为国药集团化学试剂有限公司生产的分析纯试剂,白糖为厦门古龙牌优质白砂糖;琼脂粉、卡拉胶产地日本,强度1 400 g·cm2;花宝1号产地美国,其N、P2O5、K2O质量比7:6:19。
1.3 数据统计
采用正交设计助手V3.1软件进行分析[6]。
2. 结果与分析
2.1 丛生芽诱导与增殖
切取带节茎段和茎尖接种在诱导培养基上,培养28 d时,茎段与茎尖外植体逐渐萌动膨大,其基部逐渐脱分化出生长点,逐渐形成突起,分化出丛生小芽,经3~5次继代转接,获得一定量的丛生芽作为下一步增殖培养试验材料。
芽的增殖是组培快繁的重要环节,增殖率影响繁殖效率。利用正交设计法[L9 (43)]研究了基本培养基、6-BA、NAA、白糖4种因素对秋石斛丛生芽增殖的影响,从而优化增殖培养条件以筛选出适宜的培养基配方。丛芽团接种21 d时,芽基部切口部位开始膨大,35 d时不同处理组陆续长出丛生芽。增殖培养50 d时统计丛生芽增殖系数(增殖系数=增殖芽数/接种芽数),试验统计分析结果见表 2、3。
表 2 L9 (34)正交试验设计与极差分析结果Table 2. Result of orthogonal experiment L9 (34)处理 因素 丛生芽平均增殖系数 A B C D 1 花宝1号 1.0 0.05 20 1.69 2 花宝1号 2.0 0.10 30 1.45 3 花宝1号 3.0 0.20 40 1.39 4 改良1# 1.0 0.10 40 3.71 5 改良1# 2.0 0.20 20 4.30 6 改良1# 3.0 0.05 30 3.28 7 改良2# 1.0 0.20 30 6.25 8 改良2# 2.0 0.05 40 5.07 9 改良2# 3.0 0.10 20 4.43 k1 1.510 3.883 3.347 3.473 k2 3.763 3.607 3.197 3.660 k3 5.250 3.033 3.980 3.390 极差R 3.740 0.850 0.783 0.270 主次顺序 A>B>C>D 优水平 A3 B1 C3 D2 优组合 A3 B1 C3 D2 表 3 丛生芽增殖系数方差分析结果Table 3. Variance analysison propagation rate因素 SS df F F0.05 显著性 F0.10 显著性 基本培养基 21.275 2 185.000 19.000 * 9.000 * 6-BA 1.128 2 9.809 19.000 9.000 * NAA 1.037 2 9.017 19.000 9.000 * 白糖 0.115 2 1.000 19.000 9.000 误差 0.12 2 表 2结果表明,从k值大小可以看出, 在秋石斛丛生芽增殖培养过程中, 以改良2#为基本培养基较好,6-BA需求量较低, 适宜量为1.0 mg·L-1,NAA适宜量为0.2 mg·L-1,白糖适宜量为30 g·L-1;从极差R值大小可以看出,不同因素对丛生芽增殖影响的主次关系为A>B>C>D,这说明对秋石斛丛生芽增殖起主要作用是基本培养基,其次是6-BA、NAA,白糖对增殖的影响较小。丛生芽增殖最佳处理组合是A3 B1 C3 D2,即改良2#+6-BA 1.0 mg·L-1 +NAA 0.2 mg·L-1 +白糖30 g·L-1,50 d平均增殖系数达6.25。实现了种苗大量繁殖,为规模化育苗提供了技术保障(图 1)。
从表 3可知,基本培养基、6-BA及NAA这3种因素均显著影响秋石斛丛生芽增殖系数,但其影响程度的大小有较大差异,表现为基本培养基>6-BA>NAA,白糖无显著影响,与极差分析结果一致。
2.2 生根培养
将获得的健壮的丛生芽切割成单芽(芽大小为2.0~2.5 cm),并接种于生根培养基上进行培养,培养75 d时观测统计试验数据。
试管苗生长表现见表 4,综合考虑生根率、发根数及根的质量,筛选出适宜生根的培养基配方为改良3#+NAA 0.3 mg·L-1+ IBA 0.3 mg·L-1+活性炭0.5 g·L-1+香蕉泥100.0 g·L-1+白糖20 g·L-1+琼脂粉3.6g·L-1+卡拉胶3.6 g·L-1,生根率为100.0%,平均生根数6.1条,平均根长2.6cm(图 2)。
表 4 不同用量NAA和IBA对试管苗生根培养的影响Table 4. Effect of NAA and IBA in varied concentrations on rooting ofplantlets in test tubes处理 NAA+ IBA/
(mg·L-1)接种株数
/株生根株数
/株生根率
/%诱导生根情况 1 0.1+0.1 125 108 86.4 d 21 d左右开始生根,平均生根数1.6条,平均根长1.5 m,根较细弱 2 0.1+0.3 125 119 95.2 b 14 d左右开始生根,平均生根数4.8条,平均根长2.3 cm,根细弱 3 0.3+0.3 125 125 100.0 a 10 d左右开始生根,平均生根数6.1条,平均根长2.6 cm,根粗壮,呈放射状 4 0.5+0.5 125 125 100.0 a 10 d左右开始生根,平均生根数5.2条,平均根长1.8 cm,根较粗壮,呈放射状 5 0+0.5 125 125 100.0 a 10 d左右开始生根,平均生根数5.3条,平均根长2.4 cm,根较粗壮,呈放射状 6 0.5+0 125 116 92.8 bc 14 d左右开始生根,平均生根数4.5条,平均根长2.2cm,根细弱 注:LSD测验,不同字母表示P<0.05显著性差异。 2.3 炼苗及移栽
当苗高6.0~8.0 cm,具4~6片叶时,将瓶苗放置于遮光率70%~80%的温室中炼苗约10 d(闭口6 d、半敞口2 d、全敞口2 d),以提高瓶苗适应力,适应栽培环境(图 3)。
炼苗后进行清水洗苗,洗净根部粘连的培养基,然后将苗置于1.0 g·L-1多菌灵或百菌清杀菌剂溶液浸泡消毒5 min,捞出晾干,及时剔除畸形、弱小植株,采用水苔(水苔需用清水浸泡8 h以上,沥干水分后,用清水冲洗一遍再挤干水分备用)包住根部植入4.5 cm育苗杯中,放置四槽托盘整齐摆放在温室层架上进行常规栽培管理(图 4、5)。当4.5 cm杯苗移植12个月时或根系盘绕满底部,须进行换盆种植,采用树皮与椰壳组合(比例2:1) 为栽培基质进行后续栽培(图 6)。
3. 讨论与结论
兰花组培由于存在外植体基因型等因素的差异,其各组培环节关键技术在对特定基因型材料进行培养时,一定要进行反复试验, 针对品种特性,设计培养方案,才能寻找最适合特定基因型材料培养的专用培养基与培养方式。
本试验选择丛生芽途径直接诱导出苗,并利用正交试验设计方法,探索秋石斛‘三亚阳光’丛生芽增殖培养体系,筛选出适宜的增殖培养基配方是改良2#+6-BA 1.0 mg·L-1+NAA 0.2 mg·L-1+白糖30.0 g·L-1+琼脂粉3.0 g·L-1+卡拉胶3.0 g·L-1,50 d平均增殖系数达6.25,有效提高了其繁殖效率,为种苗工程化育苗提供了技术保障。筛选出适宜生根的培养基配方为改3#+NAA 0.3 mg·L-1+ IBA 0.5 mg·L-1+活性炭0.5 g·L-1+香蕉泥100.0 g·L-1+白糖20 g·L-1+琼脂粉3.6 g·L-1+卡拉胶3.6 g·L-1,生根率为100.0%,平均生根数4.5条,平均根长2.8 cm,获得健壮生长的生根苗为移栽成活提供了基础保障;试管苗移栽60 d成活率达96.5%。
笔者根据丛生芽增殖、试管苗生根阶段植物营养需求特性,并结合多年组培实践经验,对基本培养基进行了改良设计,在正交试验设计试验结果中也可以看出对秋石斛丛生芽增殖起主要作用是基本培养基,其次是6-BA、NAA,白糖对增殖的影响较小,可见基本培养基是增殖培养的最为关键因素,探索合适培养基配方是兰花组培是否能进行量化生产的关键,培养基配方的探讨不是一成不变,其更优化的培养方案有待进一步试验探讨。
-
表 1 样品来源
Table 1 Sources of specimens
序号 省份 主要来源地 样品类型 样品数 1 福建 福州、莆田、漳州、三明、福清、南平、宁德 肝脏及脾脏等 187 2 广东 清远、湛江、广州、惠州 肝脏及脾脏等 65 3 浙江 金华、宁波、湖州 肝脏及脾脏等 42 4 江西 南昌、南城、吉安 肝脏及脾脏等 33 总计 肝脏及脾脏等 327 表 2 分离毒株信息
Table 2 Information on isolated viruses
毒株名称 宿主 日龄/d 采集年份 主要剖检病变 FQ12SD-0111 麻鸭 12 2015 肝肿大出血 FQ10SD-0119 麻鸭 10 2015 肝肿大出血 FQ20SD-0131 麻鸭 20 2015 肝肿大出血 FZ12SD-0413 麻鸭 12 2015 胰腺泛黄 CL26SD-0426 麻鸭 26 2015 肝肿大出血 CL12SD-0425 麻鸭 12 2015 肝、肾肿大出血 CL12SD-0506 麻鸭 12 2015 肝肿大出血 MH07SD-0701 麻鸭 7 2015 肝肿大出血 MH09SD-0409 麻鸭 9 2015 肝出血 FQ06SD-0412 麻鸭 6 2015 肝、肾肿大出血 FZ10SD-0703 麻鸭 10 2015 肝、肾肿大出血 MH10MD-0515 半番鸭 10 2015 胰腺泛黄 GT15MD-0312 半番鸭 15 2015 肝出血 MH08MD-0409 半番鸭 8 2015 肝出血 YT15MD-0411 半番鸭 15 2015 胰腺泛黄 MH08MD-0417 半番鸭 8 2015 肝肿大出血 FZ167MD-0517 半番鸭 167 2016 肝出血,肾肿大 ZZ02MD-0617 半番胚 24 2016 - GT30MD-0228 番鸭 30 2015 肝出血 GD20MD-0301 番鸭 20 2016 肝出血 SD23CD-0825 樱桃谷鸭 23 2015 肝、脾肿大出血 FZ10CD-0514 樱桃谷鸭 10 2016 肝出血 JH51Gu-0307 鹌鹑 未知 2015 肺脏出血、脑膜炎 表 3 不同DHAV毒株VP1基因序列同源性分析
Table 3 Homology analysis on VP1 gene of DHAV isolates
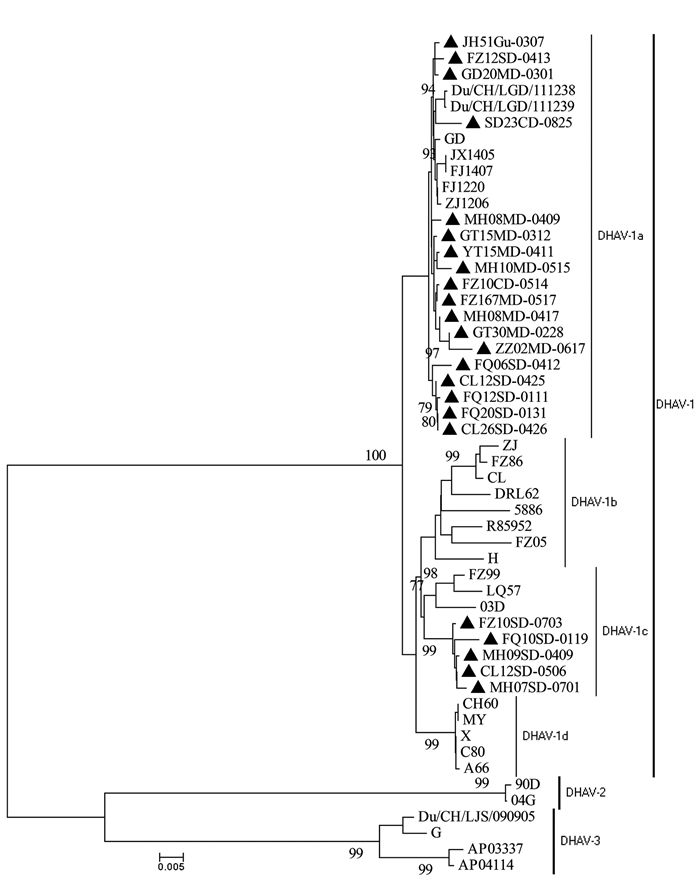
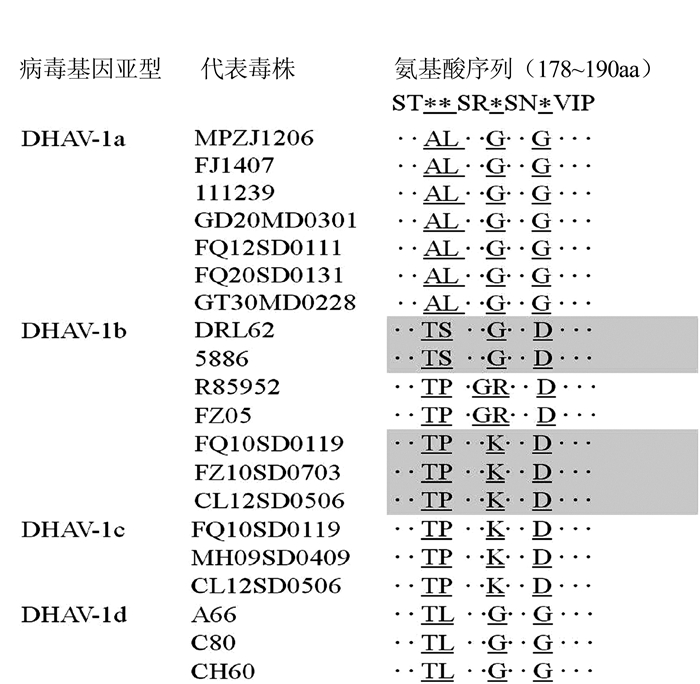
基因型 毒株名称(分离年份) 序列同源性/% 核苷酸 氨基酸 DHAV-1 本研究分离株(2015-2016) 93.3~99.9 94.4~100 FZ05(2005) 91.3~93.7 95.8~97.6 ZJ(2007) 91.8~95.1 93.5~96.3 03D(2005) 93.5~95.6 95.3~98.6 LQ57(2011年前) 93.5~95.9 94.9~97.2 H(1993) 92.7~95.4 95.8~98.1 FJ1220(2012) 94.4~99.6 95.3~100 GD(2012) 94.4~99.6 95.8~99.5 MPZJ1206(2012) 94.3~99.7 94.9~99.5 FJ1407(2014) 93.9~99.3 94.9~99.5 JX1405(2014) 93.9~99.3 94.9~99.5 Du/CH/LGD/111239(2011) 94.1~99.2 94.4~98.1 Du/CH/LGD/111238(2011) 94.3~99.0 94.4~97.6 A66(2006年前) 94.0~96.2 95.3~98.5 CH60(2000) 94.1~96.2 95.8~98.5 C80(2006年前) 94.1~96.4 95.8~99.0 DHAV-2 90D(1990) 64.9~67.1 68.9~71.2 04G(2004) 65.1~67.2 69.2~72.5 DHAV-3 Du/CH/LJS/90905(2009) 67.3~70.2 75.7~78.2 G(1999) 67.1~70.1 75.7~78.2 AP03337(2004) 65.9~69.0 75.2~78.3 -
[1] KNOWLES N J, HOVI T, HYYPIA T, et al. Family Picornaviridae[A]. In Virus Taxonomy: Ninth Report of the International Committee on Taxonomy of Viruses, 2012: 855-880.
[2] SAIF Y M. 禽病学[M]. 苏敬良, 高福, 索勋, 译. 12版. 北京: 中国农业出版社, 2012: 431-443. [3] TSENG C H, TSAI H J. Molecular characterization of a new serotype of duck hepatitis virus[J]. Virus Res, 2007, 126(1-2):19-31. DOI: 10.1016/j.virusres.2007.01.012
[4] KIM M C, KWON Y K, JOH S J, et al. Recent Koren isolates of duck hepatitis virus reveal the presence of a new geno-and serotype when compared to duck hepatitis virus type 1 type strain[J]. Arch Virol, 2007, 152(11):2059-2072. DOI: 10.1007/s00705-007-1023-0
[5] WANG L, PAN M, FU Y, et al. Classification of duck hepatitis virus into three genotypes based on molecular evolutionary analysis[J]. Virus Genes, 2008, 37(1):52-59. DOI: 10.1007/s11262-008-0233-1
[6] 黄均建.小鸭病毒性肝炎研究[M].上海:上海农业科学院畜牧兽医研究所, 1963. [7] 郭玉璞, 潘文石.北京病毒性肝炎血清型的初步鉴定[J].中国兽医杂志, 1984, 10(11):2-3. http://cdmd.cnki.com.cn/Article/CDMD-90106-1013279893.htm [8] 王平, 潘文石, 胡寿文, 等.北京小鸭病毒性肝炎的研究——(一)诊断和防治[J].北京大学学报:自然科学版, 1980, 16(1):57-76. http://www.cnki.com.cn/Article/CJFDTOTAL-BJDZ198001006.htm [9] LIU G Q, WANG F, NI Z, et al. Genetic diversity of the VP1 gene of duck hepatitis virus type 1(DHV-1) isolates from southeast China is related to isolate attenuation[J]. Virus Research, 2008, 124(11):1-5. https://es.scribd.com/document/358385920/1119991420-pdf
[10] FU Y, PAN M, WANG X, et al. Molecular detection and typing of duck hepatitis A virus directly from clinical specimens[J]. Vet Microbiol, 2008, 131(3/4):247-257. http://cn.bing.com/academic/profile?id=161229d691cc8ed741299cc6557dba8a&encoded=0&v=paper_preview&mkt=zh-cn
[11] 林世棠, 黄瑜, 黄纪铨, 等.一种新的鸭传染病研究Ⅰ.流行情况与初步诊断[J].中国预防兽医学报, 1996, 18(4):14-17. http://www.cnki.com.cn/Article/CJFDTotal-ZGXQ201007006.htm [12] 陈建红, 张济培, 司兴奎, 等.标准鸭肝炎1型血清对鸭肝炎野毒株的免疫保护试验[J].中国兽医学报, 2001, 21(3):231-234. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGXQ199101006.htm [13] 何冉娅, 于淼, 张玉玲, 等. 2007~2009年华南地区鸭肝炎病毒流行病学调查及分离株的VP1基因变异分析[J].中国动物传染病学报, 2010, 18(1):7-17. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zsjb201001005&dbname=CJFD&dbcode=CJFQ [14] TSENG C H, KNOWLES N J, TSAI H J. Molecular analysis of duck hepatitis virus type 1 indicates that it should be assigned to a new genus[J]. Virus Research, 2007, 123(2):190-203. DOI: 10.1016/j.virusres.2006.09.007
[15] GUERIN J L, ALBARIC O, NOUTARY V, et al. A duck hepatitis virus type I is agent of pancreatitis and encephalitis in Muscovy duckling[C]//Proceedings of the 147th American Veterinary Medicine Association/50th American Association of Avian Pathologists Conference, 14-18 July 2007, Washington, DC, USA, Abs 4585.
[16] 傅光华, 陈红梅, 黄瑜, 等.雏番鸭胰腺型鸭1型甲肝病毒分离鉴定及VP1基因分析[J].福建农业学报, 2012, 27(9):945-950. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=fjnx201209009&dbname=CJFD&dbcode=CJFQ [17] KIM M C, KWON Y K, JOH S J, et al. Molecular analysis of duck hepatitis virus type 1 reveal s a novel lineage close to t he genus parechovirus in the family Picornaviridae[J]. J Gen Virol, 2006, 87(11):3307-3316. DOI: 10.1099/vir.0.81804-0
-
期刊类型引用(3)
1. 李志晴,李亚梅,李崇晖,尹俊梅. 秋石斛胚性愈伤组织诱导及再生体系的建立. 热带作物学报. 2024(06): 1175-1183 .  百度学术
百度学术
2. 叶秀仙,陈艺荃,林榕燕,樊荣辉,林兵,钟淮钦. 石斛兰杂交结实性研究. 福建农业科技. 2021(03): 1-5 .  百度学术
百度学术
3. 叶秀仙,方能炎,吴建设,钟淮钦. 应用正交设计优选二歧鹿角蕨球状体分化培养基研究. 福建农业科技. 2020(02): 24-27 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: