Optimization and Application of SSR-PCR Reaction System for Macadamia
-
摘要: 以澳洲坚果DNA为模板,通过单因素设计方法对影响SSR-PCR反应体系的5个主要因素进行了优化。结果表明,澳洲坚果SSR-PCR反应体系的最适条件为:20 μL的反应体系中,包含30 mg·L-1模板DNA,1.0 U Taq聚合酶,2.5 mmol·L-1 Mg2+,0.6 μmol·L-1引物和0.3 mmol·L-1dNTPs。采用该反应体系对不同引物和15份澳洲坚果种质进行验证,扩增条带的可靠性和稳定性良好,且分辨率较高。因此,该SSR-PCR反应体系可用于澳洲坚果种质源鉴定及遗传多样性分析研究。Abstract: Five major factors of the SSR-PCR reaction system were optimized for genomic DNA of macadamia (Macadamia spp.) by a single factor design. The volume of optimum reaction system was 20 μL that consisted of 30 mg·L-1 template DNA, 1.0 U Taq polymerase, 2.5 mmol·L-1 Mg2+, 0.6 μmol·L-1 primer and 0.3 mmol·L-1 dNTPs. On 15 germplasms of macadamia using different SSR primers, the system proved to be reliable and stable in the amplification bands with high resolution. Consequently, it seemed adequate for the identification and genetic diversity analysis of macadamia germplasms.
-
Keywords:
- macadamia /
- SSR-PCR /
- system optimization /
- single factor design
-
澳洲坚果Macadamia spp.是山龙眼科Proteaceae澳洲坚果属Macadamia常绿乔木,原产于澳大利亚昆士兰与新南威尔的亚热带雨林,是中国南方发展起来的新兴果树,在云南、广西、广东、贵州、福建等地均有种植。澳洲坚果营养价值和经济价值高,风味独特,享有“干果皇后”的美誉。目前,有关澳洲坚果种质资源的研究主要集中在形态学特征描述和遗传多样性分析[1],在分子水平上通过同工酶技术[2, 3]和分子标记技术,如RAPD[4]、AFLP[5]、ISSR[6]和SCoT[7]等初步对澳洲坚果进行种质鉴定和遗传多样性研究,但对其种质资源的遗传背景缺乏深入研究。
SSR(simple sequence repeats)即简单序列重复,又称微卫星DNA(microsatellite DNA),是由少数几个核苷酸(一般为1~6个)为单位多次串联重复的DNA序列,具有操作简便、多态性强、遗传信息量大、共显性遗传等特点。目前,SSR标记技术在芒果[8]、桃[9]、板栗[10]等果树种质资源的遗传多样性分析及种质鉴定等方面具有广泛的应用。但是,基于转录组开发的澳洲坚果SSR标记在其种质资源的遗传多样性研究中国内还未见报道。基于前期的研究基础[7, 11-12],本研究利用单因素试验设计方法,对影响澳洲坚果SSR-PCR反应体系的主要因素进行优化,建立最适澳洲坚果SSR-PCR的反应体系,为SSR标记在澳洲坚果种质资源鉴定、遗传多样性分析和指纹图谱构建等方面提供技术支持。
1. 材料和方法
1.1 试验材料
供试材料澳洲坚果Macadamia spp.种质均取自广西亚热带作物研究所澳洲坚果种质资源圃,15份供试材料包括光壳种Macadamia integrifolia、粗壳种Macadamia tetraphylla及两者的杂交种(表 1)。其中A16品种用于反应体系优化,其余材料用于优化后反应体系的稳定性和可靠性检测。所有供试材料均从健康植株采集的幼叶,液氮速冻后于-70℃保存备用。
表 1 供试澳洲坚果种质的编号、名称、类型及原产地Table 1. Codes, names, types and origins of tested macadamia germplasms编号 种质名称 种质类型 原产地 1 HVA4(A4) 杂交种Hybrid 澳大利亚昆士兰州 2 HVA16(A16) 杂交种Hybrid 澳大利亚昆士兰州 3 Renown(D4) 杂交种Hybrid 澳大利亚昆士兰州 4 HY 杂交种Hybrid 澳大利亚昆士兰州 5 Hinde(H2) 光壳种(Macadamia integrifolia) 澳大利亚昆士兰州 6 Own Choice(O.C.) 光壳种(Macadamia integrifolia) 澳大利亚昆士兰州 7 T2 粗壳种(Macadamia tetraphylla) 澳大利亚昆士兰州 8 DND 光壳种(Macadamia integrifolia) 澳大利亚昆士兰州 9 D.Bown 光壳种(Macadamia integrifolia) 澳大利亚昆士兰州 10 NG-18 光壳种(Macadamia integrifolia) 不详 11 Ronik 光壳种(Macadamia integrifolia) 澳大利亚昆士兰州 12 HAES109 光壳种(Macadamia integrifolia) 美国夏威夷 13 HAES114 光壳种(Macadamia integrifolia) 美国夏威夷 14 HAES246(Keauhou) 光壳种(Macadamia integrifolia) 美国夏威夷 15 HAES294(Purvis) 光壳种(Macadamia integrifolia) 美国夏威夷 1.2 DNA提取与检测
参照蔡元保等[7]的方法提取澳洲坚果基因组DNA,用含有核酸染料的1.0%琼脂糖凝胶电泳检测其质量和浓度。用Biophotometre型核酸蛋白仪检测其纯度,稀释至50 mg·L-1,置于-20℃保存备用。
1.3 SSR-PCR反应体系的单因素优化设计
SSR基本反应体系组成为:30 mg·L-1模板DNA,1.0 U Taq聚合酶,2.0 mmol·L-1 Mg2+,0.6 μmol·L-1引物,0.3 mmol·L-1dNTPs和2 μL 10×PCR buffer,最后用无菌超纯水补足至20 μL。
选取澳洲坚果A16品种为DNA模板,(1)以引物MS78(正向引物:5′-ATT GAG TGC AGC CCA GAC TT-3′;反向引物:5′-GTA GCC AGT CCC GTT TAG CA-3′);(2)引物MS183(正向引物:5′-AAG GGA GCT CCA ACT TCA CA-3′;反向引物:5′-CAC CCC TGC ACT TCC TAC AT-3′)分别对影响反应的5个主要因素(模板DNA、Taq聚合酶、Mg2+、引物、dNTPs)进行单因素优化分析,每个因素分别设置5个浓度梯度。以SSR基本反应体系组成为基础,在保持其他因素一致不变的条件下,变化单一因素的浓度,筛选出最适浓度。其中,模板DNA浓度依次为:10、20、30、40、50 mg·L-1;Taq聚合酶浓度依次为:0.25、0.5、1.0、1.5、2.0 U;Mg2+浓度依次为:1.0、1.5、2.0、2.5、3.0 mmol·L-1;引物浓度依次为:0.2、0.4、0.6、0.8、1.0 μmol·L-1;dNTPs浓度依次为:0.1、0.2、0.3、0.4、0.5 mmol·L-1。
1.4 PCR扩增与检测
PCR扩增程序:94℃预变性5 min;94℃变性1 min,52℃复性45 s,72℃延伸90 s,35个循环,最后72℃延伸10 min,4℃保存。PCR产物在含有核酸染料的1.8%琼脂糖凝胶中电泳分离,电泳缓冲液为0.5×TBE。电泳结束后,于凝胶成像系统上检测并拍照。
1.5 SSR-PCR最优反应体系验证
根据以上试验结果确定的SSR-PCR最佳反应体系,选用引物MS78和引物MS183分别对15份供试材料进行PCR扩增,检验该反应体系的稳定性和可靠性。
2. 结果与分析
2.1 澳洲坚果基因组DNA的浓度及质量检测
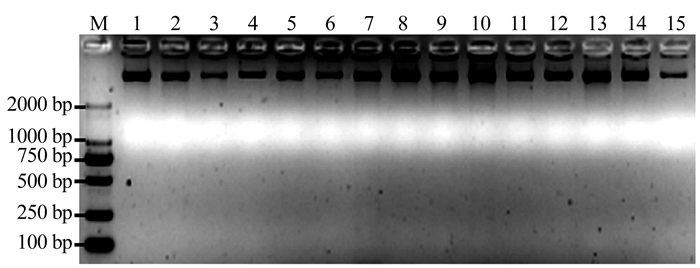
琼脂糖凝胶电泳检测结果显示(图 1),15份澳洲坚果供试材料的基因组DNA条带清晰,无拖尾现象,浓度较高。核酸蛋白仪检测DNA质量结果表明,在260、280 nm波长下的OD值,所有供试材料基因组DNA的OD260/OD280比值在1.8~2.0,纯度较高,可以直接用于PCR扩增。
![]() 图 1 15份澳洲坚果基因组DNA的电泳检测注:M为DNA marker, DL 2 000;1~15材料编号同表 1。Figure 1. Electrophoresis of genomic DNA on 15 samples
图 1 15份澳洲坚果基因组DNA的电泳检测注:M为DNA marker, DL 2 000;1~15材料编号同表 1。Figure 1. Electrophoresis of genomic DNA on 15 samples2.2 SSR-PCR反应体系的单因素优化试验
2.2.1 模板DNA浓度对SSR-PCR的影响
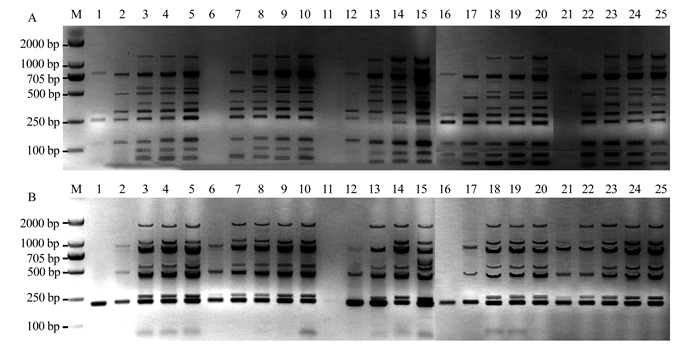
模板DNA浓度对SSR-PCR影响的结果显示(图 2-A和图 2-B中泳道1~5),当浓度为10 mg·L-1时,扩增的条带很少;当浓度为20 mg·L-1时,条带有所增加;当浓度增加至30 mg·L-1时,扩增的条带数更多,颜色更深;而浓度为40、50 mg·L-1时,扩增的条带颜色虽然加深,但扩增的条带数与浓度为30 mg·L-1时一样多。因此,选择30 mg·L-1作为模板DNA的最适宜浓度。
![]() 图 2 模板DNA、Taq聚合酶、Mg2+、引物(A: MS78; B: MS183)和dNTPs浓度对SSR-PCR反应的影响注:M为DNA marker, DL 2 000; 1~5为10、20、30、40、50 mg·L-1模板DNA; 6~10为0.25、0.5、1.0、1.5、2.0 U Taq聚合酶;11~15为1.0、1.5、2.0、2.5、3.0 mmol·L-1 Mg2+;16~20为0.2、0.4、0.6、0.8、1.0 μmol·L-1引物; 21~25为0.1、0.2、0.3、0.4、0.5 mmol·L-1 dNTPs。Figure 2. Effects of 5 major factors in SSR-PCR reaction system (A: primer MS78; B: primerMS183)
图 2 模板DNA、Taq聚合酶、Mg2+、引物(A: MS78; B: MS183)和dNTPs浓度对SSR-PCR反应的影响注:M为DNA marker, DL 2 000; 1~5为10、20、30、40、50 mg·L-1模板DNA; 6~10为0.25、0.5、1.0、1.5、2.0 U Taq聚合酶;11~15为1.0、1.5、2.0、2.5、3.0 mmol·L-1 Mg2+;16~20为0.2、0.4、0.6、0.8、1.0 μmol·L-1引物; 21~25为0.1、0.2、0.3、0.4、0.5 mmol·L-1 dNTPs。Figure 2. Effects of 5 major factors in SSR-PCR reaction system (A: primer MS78; B: primerMS183)2.2.2 Taq聚合酶浓度对SSR-PCR的影响
Taq聚合酶浓度对SSR-PCR影响的结果显示(图 2-A和图 2-B中泳道6~10),当浓度为0.25 U时,没有扩增出条带或者条带很少;当浓度为0.5 U时,扩增的条带有所增加;当浓度为1.0 U时,扩增的条带数达到最多;而当浓度再升高至1.5、2.0 U时,扩增出的条带数不再增加,颜色虽然不断加深,但浓度越高,拖尾现象越严重。因此,选择1.0 U作为Taq聚合酶的最适浓度。
2.2.3 Mg2+浓度对SSR-PCR的影响
Mg2+浓度对SSR-PCR影响的结果显示(图 2-A和图 2-B中泳道11~15),当浓度为1.0 mmol·L-1时,都没有扩增出条带;当浓度为1.5 mmol·L-1时,扩增的条带数少,且带型模糊,颜色较浅;当浓度为2.0 mmol·L-1时,扩增的条带数均有增加;当浓度为2.5、3.0 mmol·L-1时,扩增的条带数最多,但浓度越高,越有拖尾现象。因此,选择2.5 mmol·L-1作为反应体系的最适Mg2+浓度。
2.2.4 引物浓度对SSR-PCR的影响
引物浓度对SSR-PCR影响的结果显示(图 2-A和图 2-B中泳道16~20),当浓度为0.2 μmol·L-1时,扩增出条带数很少;当浓度为0.4 μmol·L-1时,扩增的条带数不断增加;当浓度为0.6、0.8、1.0 μmol·L-1时,扩增出的条带数基本不再增减,条带也清晰可见。从经济角度考虑,选择0.6 μmol·L-1作为引物的最适浓度。
2.2.5 dNTPs浓度对SSR-PCR的影响
dNTPs浓度对SSR-PCR影响的结果显示(图 2-A和图 2-B中泳道21~25),当浓度为0.1、0.2 mmol·L-1时,扩增的条带数随着dNTPs浓度的增加而增加;当浓度为0.3、0.4、0.5 mmol·L-1时,扩增的条带数增加基本不变。因此,选择0.3 mmol·L-1作为dNTPs的最适浓度。
2.3 澳洲坚果SSR-PCR最优反应体系验证
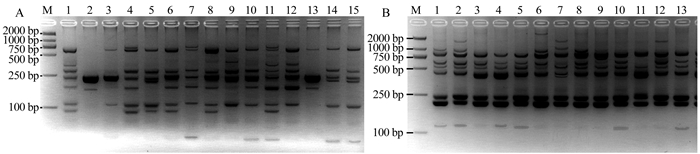
综合以上结果可见,在总体积20 μL的澳洲坚果SSR-PCR反应体系中,包含30 mg·L-1模板DNA,1.0 U Taq聚合酶,2.5 mmol·L-1 Mg2+,0.6 μmol·L-1引物和0.3 mmol·L-1 dNTPs。选用引物MS78和MS183分别对供试的15个澳洲坚果种质进行PCR扩增。结果表明(图 3),15个澳洲坚果种质均可以扩增出清晰、重复性好、多态性高的条带,说明该反应体系具有较好的稳定性和重复性及较高的分辨率,适用于澳洲坚果SSR-PCR分析。
![]() 图 3 引物MS78(A)和引物MS183(B)对15份澳洲坚果种质的SSR-PCR扩增注:M为DNA marker, DL 2000;1~15材料编号同表 1。Figure 3. SSR-PCR amplifications of 15 macadamia germplasms using primer MS78 (A) and primer MS183 (B)
图 3 引物MS78(A)和引物MS183(B)对15份澳洲坚果种质的SSR-PCR扩增注:M为DNA marker, DL 2000;1~15材料编号同表 1。Figure 3. SSR-PCR amplifications of 15 macadamia germplasms using primer MS78 (A) and primer MS183 (B)3. 讨论与结论
SSR标记具有重复性和稳定性强以及共显性等优点,已在多种植物中广泛应用[13],但仅从SSR-PCR体系优化方面来看,不同的材料PCR反应体系差别较大。SSR标记是基于PCR扩增基础之上的,而PCR扩增反应涉及诸多因素,如反应条件(模板DNA、Taq聚合酶、Mg2+、引物和dNTPs浓度等5个主要影响因素)、扩增程序等,且每个因素对扩增效率都会产生影响。因此,有必要对澳洲坚果SSR-PCR反应体系进行优化。
本研究通过单因素试验对影响澳洲坚果SSR-PCR反应体系的5个主要因素进行了优化,建立了澳洲坚果最适的SSR-PCR反应体系:20 μL的反应体系中,包含30 mg·L-1模板DNA,1.0 U Taq聚合酶,2.5 mmol·L-1 Mg2+,0.6 μmol·L-1引物和0.3 mmol·L-1 dNTPs。试验结果表明,不同浓度的5个因素,扩增结果在条带的明亮度、清晰度和数量上均有差别,其中受Mg2+的影响比较明显。随着Mg2+浓度的增加,扩增结果的条带数和清晰度有所增加,但是随着浓度的进一步增加,虽然条带数也在增加,可是拖尾现象越严重。而其他因素在浓度较低时,扩增不出条带或者扩增的条带数较少;当浓度达到一定范围,扩增的条带数基本不变,仅是扩增条带颜色深浅的变化。在冬瓜[14]和红椿[15]等植物的SSR-PCR反应体系研究表明,Mg2+浓度是影响SSR-PCR反应体系最大的因素,与本研究结论相同。但是,在油菜[16]和蚕豆[17]等植物的SSR-PCR反应体系研究表明,Mg2+和dNTPs浓度对SSR-PCR反应体系的影响不大,这可能是由于不同模板DNA造成的结果。
本研究利用优化好的反应体系,在不同引物和不同澳洲坚果材料中进行验证,均能扩增出清晰、重复性好、多态性高的谱带,表明经过优化确立的SSR-PCR反应体系稳定可靠,可适用于澳洲坚果SSR分析,也可为后续基于PCR扩增反应的澳洲坚果相关试验提供一定理论和技术基础。
-
图 1 15份澳洲坚果基因组DNA的电泳检测
注:M为DNA marker, DL 2 000;1~15材料编号同表 1。
Figure 1. Electrophoresis of genomic DNA on 15 samples
图 2 模板DNA、Taq聚合酶、Mg2+、引物(A: MS78; B: MS183)和dNTPs浓度对SSR-PCR反应的影响
注:M为DNA marker, DL 2 000; 1~5为10、20、30、40、50 mg·L-1模板DNA; 6~10为0.25、0.5、1.0、1.5、2.0 U Taq聚合酶;11~15为1.0、1.5、2.0、2.5、3.0 mmol·L-1 Mg2+;16~20为0.2、0.4、0.6、0.8、1.0 μmol·L-1引物; 21~25为0.1、0.2、0.3、0.4、0.5 mmol·L-1 dNTPs。
Figure 2. Effects of 5 major factors in SSR-PCR reaction system (A: primer MS78; B: primerMS183)
图 3 引物MS78(A)和引物MS183(B)对15份澳洲坚果种质的SSR-PCR扩增
注:M为DNA marker, DL 2000;1~15材料编号同表 1。
Figure 3. SSR-PCR amplifications of 15 macadamia germplasms using primer MS78 (A) and primer MS183 (B)
表 1 供试澳洲坚果种质的编号、名称、类型及原产地
Table 1 Codes, names, types and origins of tested macadamia germplasms
编号 种质名称 种质类型 原产地 1 HVA4(A4) 杂交种Hybrid 澳大利亚昆士兰州 2 HVA16(A16) 杂交种Hybrid 澳大利亚昆士兰州 3 Renown(D4) 杂交种Hybrid 澳大利亚昆士兰州 4 HY 杂交种Hybrid 澳大利亚昆士兰州 5 Hinde(H2) 光壳种(Macadamia integrifolia) 澳大利亚昆士兰州 6 Own Choice(O.C.) 光壳种(Macadamia integrifolia) 澳大利亚昆士兰州 7 T2 粗壳种(Macadamia tetraphylla) 澳大利亚昆士兰州 8 DND 光壳种(Macadamia integrifolia) 澳大利亚昆士兰州 9 D.Bown 光壳种(Macadamia integrifolia) 澳大利亚昆士兰州 10 NG-18 光壳种(Macadamia integrifolia) 不详 11 Ronik 光壳种(Macadamia integrifolia) 澳大利亚昆士兰州 12 HAES109 光壳种(Macadamia integrifolia) 美国夏威夷 13 HAES114 光壳种(Macadamia integrifolia) 美国夏威夷 14 HAES246(Keauhou) 光壳种(Macadamia integrifolia) 美国夏威夷 15 HAES294(Purvis) 光壳种(Macadamia integrifolia) 美国夏威夷 -
[1] 贺熙勇, 倪书邦, 陈国云, 等.澳洲坚果种质资源形态性状的遗传多样性分析[J].中国农学通报, 2010, 26(3):206-215. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgnxtb201003044 [2] VITHANAGE V, WINKS C W. Isozymes as genetic markers for Macadamia[J]. Sci Hort, 1992, 49(1/2):103-115. http://cn.bing.com/academic/profile?id=ca8c7f325a5888489b6a3c36429d00fe&encoded=0&v=paper_preview&mkt=zh-cn
[3] ARADHYA M K, YEE L K, ZEE F T, et al. Genetic variability in macadamia[J]. Genet Resour Crop Ev, 1998, 45(1):19-32. DOI: 10.1023/A:1008634103954
[4] VITHANAGE V, HARDNER C, ANDERSON K L, et al. Progress made with molecular markers for genetic improvement of macadamia[J]. Acta Hort, 1998, 461(8):199-208. http://cn.bing.com/academic/profile?id=4f00e13c2e8d64d044cb00ac241fdd53&encoded=0&v=paper_preview&mkt=zh-cn
[5] STEIGER D L, MOORE P H, ZEE F, et al. Genetic relationships of macadamia cultivars and species revealed by AFLP markers[J]. Euphytica, 2003, 132(3):269-277. DOI: 10.1023/A:1025025522276
[6] 郭凌飞, 邹明宏, 杜丽清, 等.利用ISSR分析澳洲坚果的亲缘关系[J].园艺学报, 2011, 38(9):1741-1746. http://www.cnki.com.cn/Article/CJFDTotal-YYXB201109022.htm [7] 蔡元保, 杨祥燕, 陈显国, 等.澳洲坚果SCoT反应体系的建立及应用[J].热带亚热带植物学报, 2013, 21(3):253-258. http://www.cnki.com.cn/Article/CJFDTOTAL-RYZB201303012.htm [8] 罗纯, 武红霞, 姚全胜, 等.芒果转录组中SSR位点信息分析与引物筛选[J].热带作物学报, 2015, 36(7):1261-1266. http://www.cnki.com.cn/Article/CJFDTotal-RDZX201507013.htm [9] 周平, 郭瑞, 张小丹, 等. SSR分析50份桃种质资源遗传多样性[J].福建农业学报, 2017, 32(1):47-50. http://www.cnki.com.cn/Article/CJFDTotal-XBNX201301006.htm [10] 江锡兵, 汤丹, 龚榜初, 等.基于SSR标记的板栗地方品种遗传多样性与关联分析[J].园艺学报, 2015, 42(12):2478-2488. http://www.cqvip.com/QK/90024X/201512/667629676.html [11] 蔡元保, 杨祥燕, 陈豪军, 等.. SRAP结合SCoT标记分析番木瓜种质的遗传多样性[J].植物遗传资源学报, 2014, 15(2):292-298. DOI: 10.13430/j.cnki.jpgr.2014.02.010.html [12] 杨祥燕, 蔡元保, 郭凌飞, 等.番木瓜SCoT反应体系建立及引物筛选[J].热带亚热带植物学报, 2012, 20(6):578-584. http://www.oalib.com/paper/5078342 [13] 罗冉, 吴委林, 张吻, 等. SSR分子标记在作物遗传育种中的应用[J].基因组学与应用生物学, 2010, 29(1):137-143. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=jyzxyyyswx201001024 [14] 潘珍珍, 吴才君, 刘文睿, 等.冬瓜SSR-PCR体系优化及引物筛选[J].分子植物育种, 2015, 13(4):898-902. https://www.researchgate.net/profile/Boyong_Liao/publication/304953364_Optimization_of_SSR-PCR_reaction_system_and_primer_screening_of_Melia_azedarach/links/57fe440408ae6b2da3c889f1.pdf?origin=publication_list [15] 湛欣, 鲁好君, 赵帅, 等.红椿SSR-PCR体系建立和多态性引物筛选[J].林业科学研究, 2016, 29(4):565-570. https://www.researchgate.net/profile/Boyong_Liao/publication/304953364_Optimization_of_SSR-PCR_reaction_system_and_primer_screening_of_Melia_azedarach/links/57fe440408ae6b2da3c889f1.pdf?origin=publication_list [16] 冯旭东, 徐玲玲, 张凯凯, 等.甘蓝型油菜SSR-PCR体系优化[J].山地农业生物学报, 2015, 34(6):30-36. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=sdnyswxb201506006 [17] 沙伟超, 侯万伟, 刘玉皎, 等.蚕豆SSR-PCR体系建立及优化[J].青海大学学报, 2017, 35(2):13-18, 27. http://www.cnki.com.cn/Article/CJFDTotal-ZNTB201409030.htm -
期刊类型引用(5)
1. 周涛,聂艳丽,李翠萍,王大玮. 云南澳洲坚果果实内含物测定及多样性分析. 种子. 2025(01): 31-38 .  百度学术
百度学术
2. 井敏敏,黄炳钰,戴小红,李栋梁,陈晶晶. 基于SSR标记的澳洲坚果种质资源遗传多样性分析. 热带作物学报. 2022(02): 262-270 .  百度学术
百度学术
3. 李冰,杨祥燕,蔡元保,曾黎明,林玉虹,李季东. 分子标记在澳洲坚果遗传育种中的应用研究进展. 农业研究与应用. 2022(04): 39-43 .  百度学术
百度学术
4. 谭秋锦,王文林,陈海生,韦媛荣,郑树芳,黄锡云,贺鹏,夏志强. 基于SNP分子标记的澳洲坚果种质遗传多样性分析. 分子植物育种. 2020(21): 7246-7253 .  百度学术
百度学术
5. 李穆,曾黎明,李季东,黄锦媛,蔡元保,唐秀观,林玉虹,陈燕,郑文武. 不同保果剂对澳洲坚果花粉活力、柱头可授性及坐果率的影响. 农业研究与应用. 2019(04): 15-19 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载: