A High Cellulase-producing Bacterium from Tobacco Lamina
-
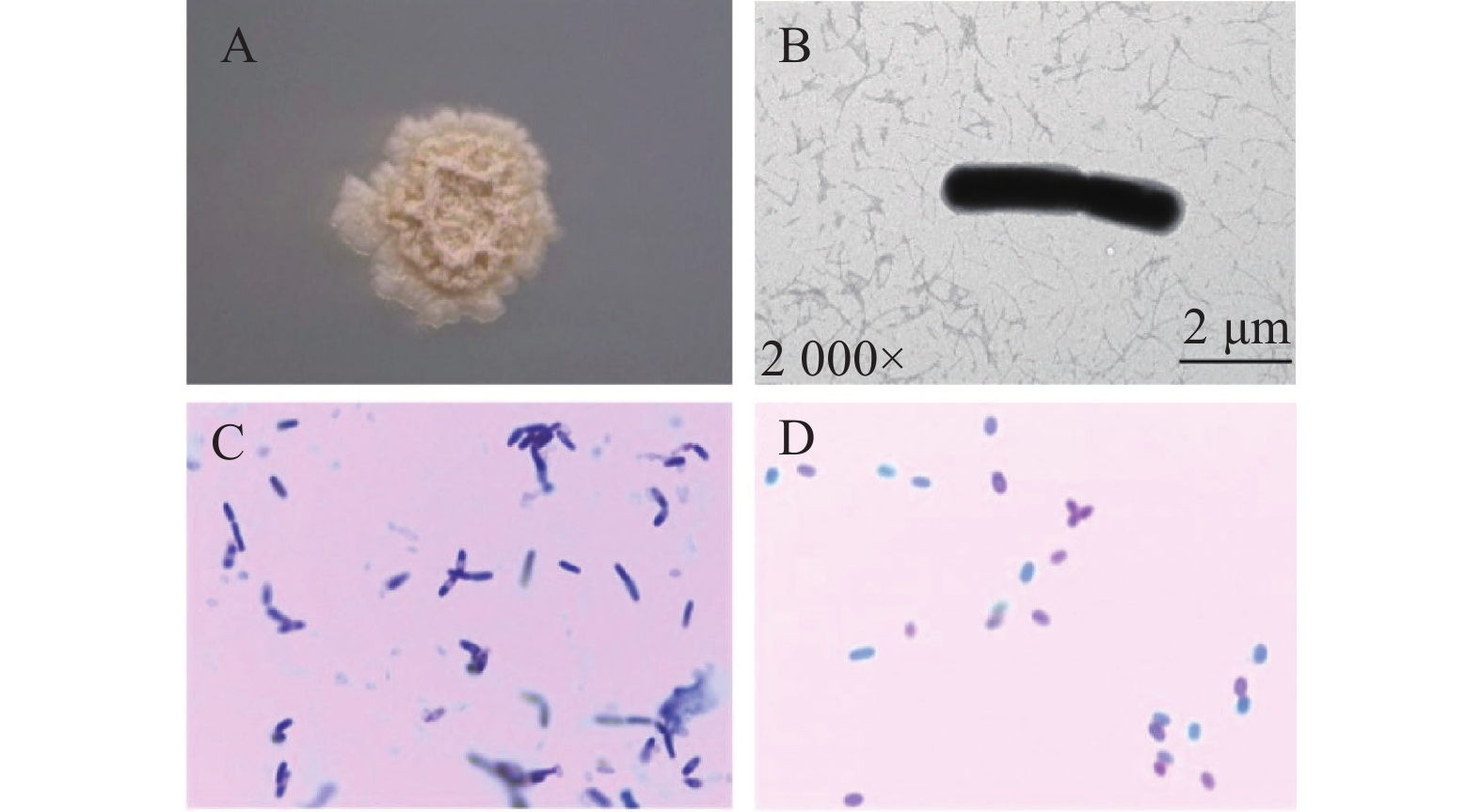
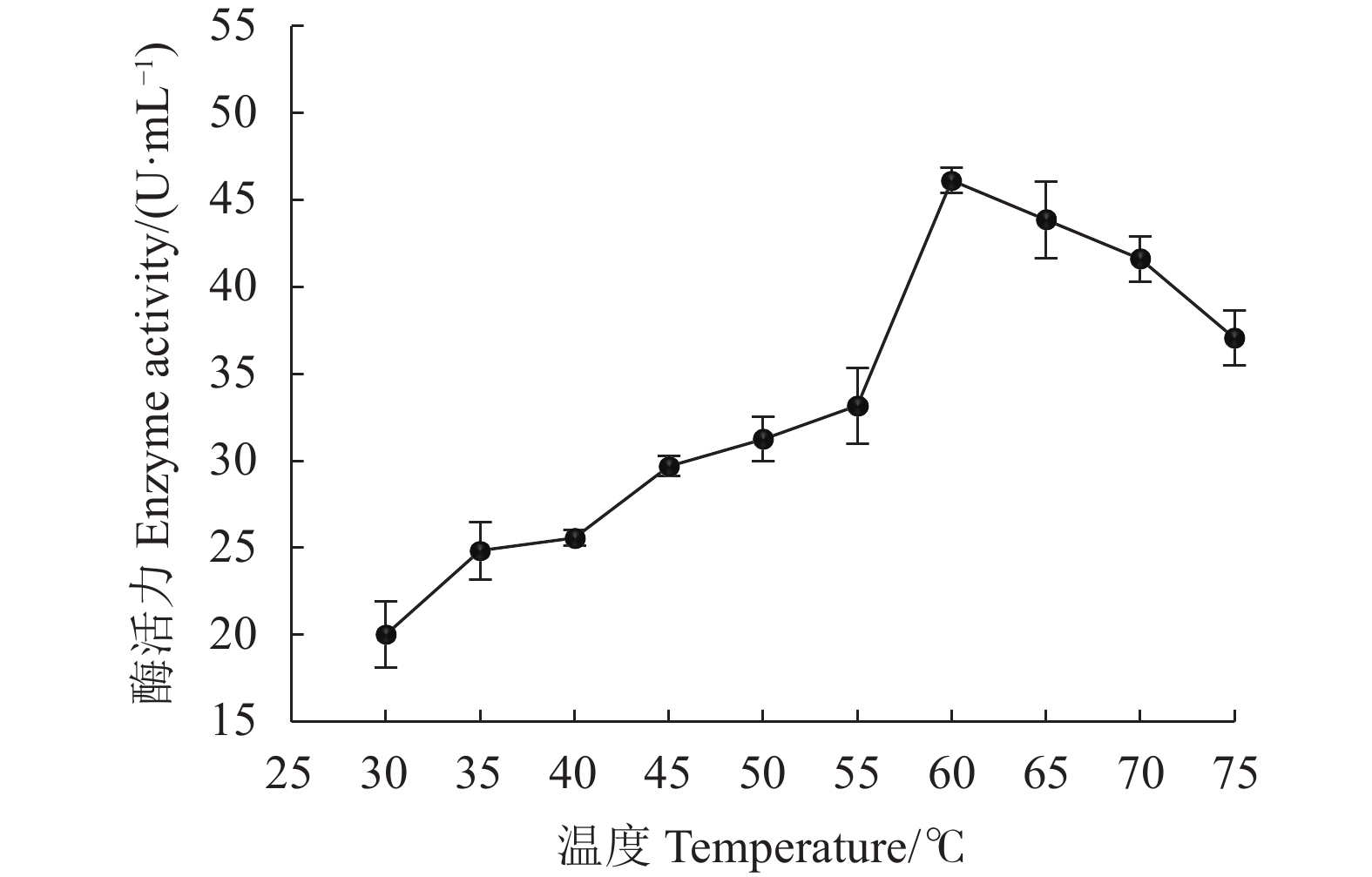
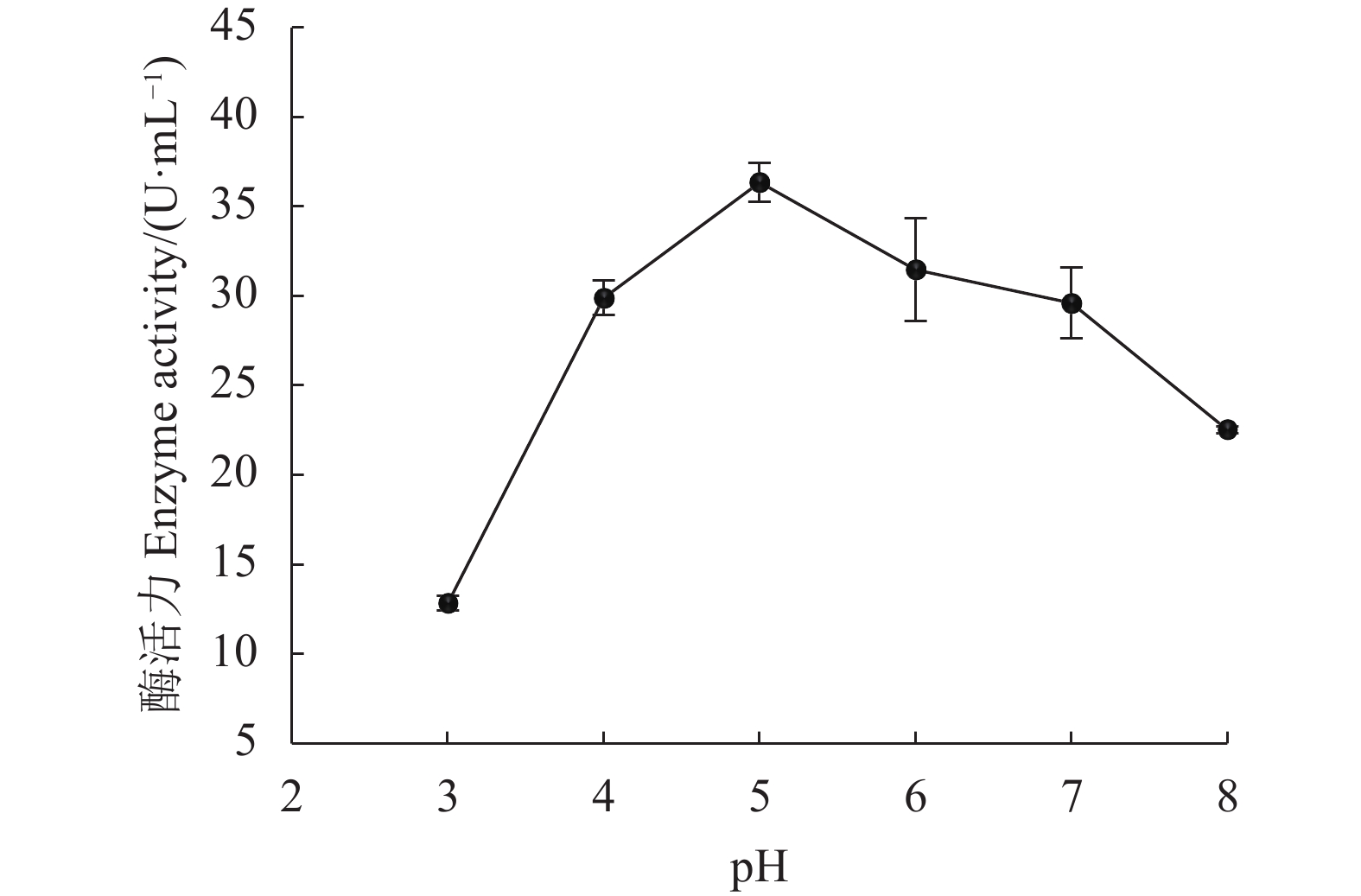
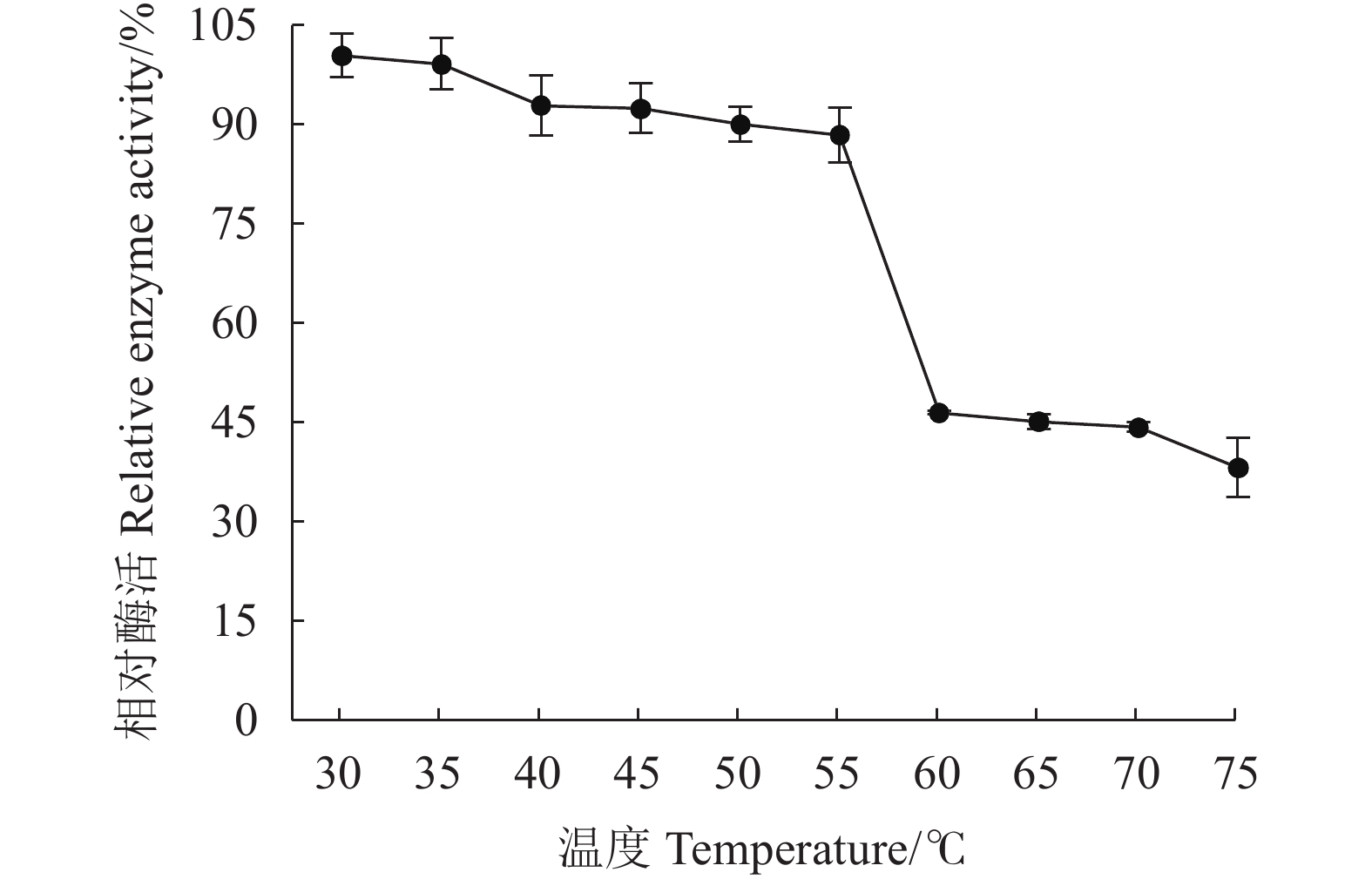
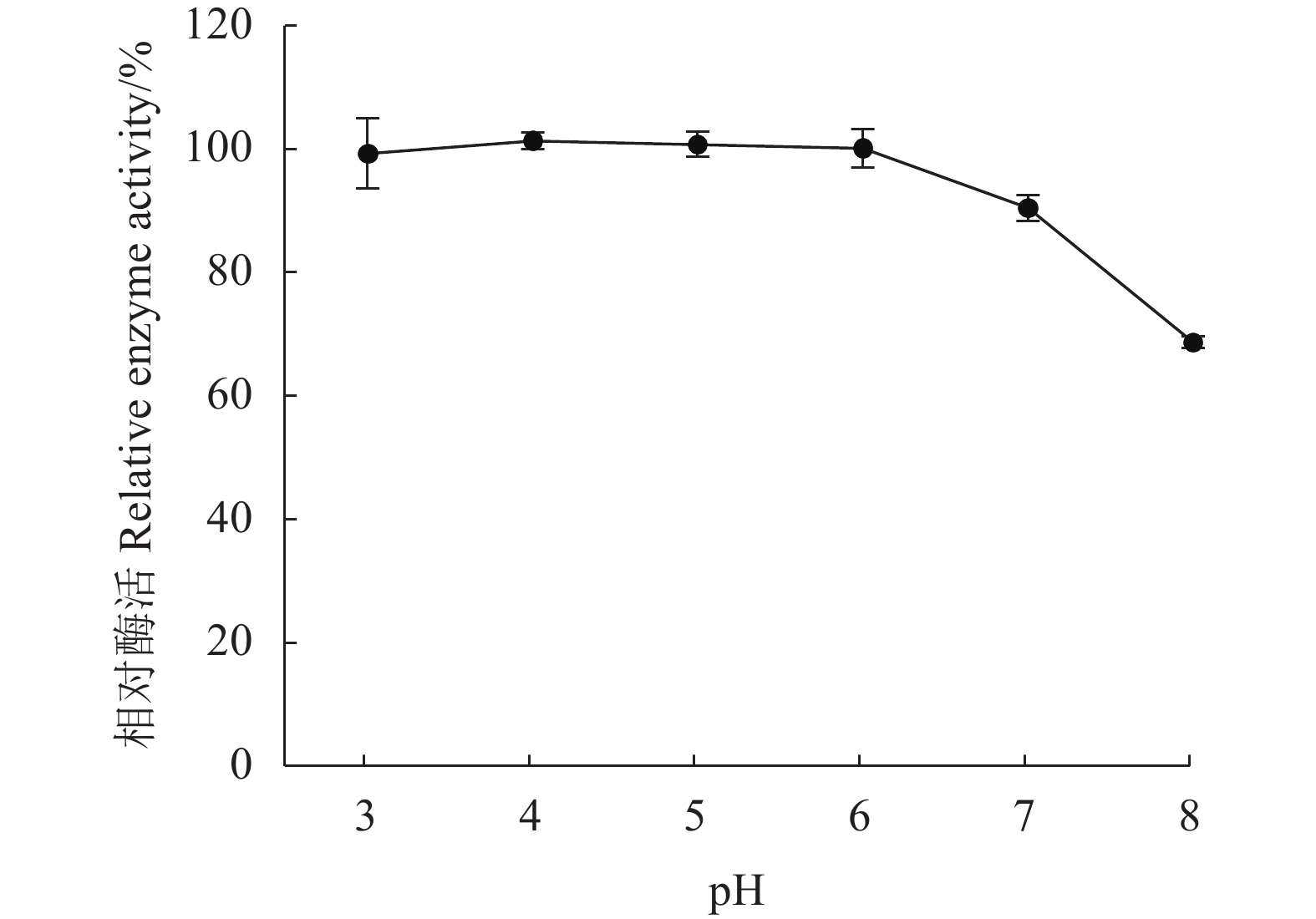
摘要:目的 从不同品种烟叶原料中分离筛选高产纤维素酶细菌菌株,为提高烟叶原料使用价值提供优秀菌种资源。方法 采用稀释涂布法从37份片烟样品中分离纯化菌株,利用刚果红染色法结合摇瓶复筛进行筛选,测定菌株纤维素酶活性,通过形态学观察与16S rRNA序列鉴定功能菌的系统发育学地位,并对功能菌所产纤维素酶进行酶学性质研究。结果 筛选到1株烟用纤维素酶活性高的菌株FX-1,其在37 ℃发酵48 h纤维素酶酶活力最高,达56.261 U·mL−1。FX-1菌体呈杆状,可产芽孢,革兰氏阳性,其16S rRNA序列与Bacillus subtilis相似度最高(100%),系统发育树中与枯草芽孢杆菌位于同一分支中,初步鉴定为枯草芽孢杆菌(Bacillus subtilis)。通过酶学性质分析,酶反应的最适温度为60 ℃,最适pH为5.0,在温度30~55 ℃或pH值3.0~7.0保温30 min后仍有较高活力,相对酶活有90%以上,具有良好的热稳定性和耐酸能力。结论 从37份片烟样品中筛选获得1株高产纤维素酶菌株FX-1,初步鉴定为枯草芽孢杆菌。FX-1所产纤维素酶的反应条件较宽,酶学性质稳定,在烟草行业中具有良好的产业化开发利用前景。Abstract:Objective Bacteria with a high cellulase-producing capacity were isolated from different varieties of tobacco for the potential of upgrading the economic value of tobacco raw materials.Methods Candidate bacterial strains were isolated and purified from 37 flue-cured tobacco strip samples using dilution coating method. They were screened by the Congo red staining combined with shaking flask culture and cellulase activity determination. Phylogenetic property of a strain identified by morphological observation was confirmed with 16S rRNA sequencing. The cellulase activities were investigated.Results FX-1 was preliminarily identified as a strain that produced high cellulase activity of 56.261 U·mL−1 after 48h fermentation at 37 ℃. It was a gram-positive, rod-shape, spore-producing bacterium that showed a perfectly matching 16S rRNA sequence in a branch of Bacillus subtilis phylogenetic tree. The cellulase from FX-1 displayed a peak activity at 60 ℃ and pH 5.0. Greater than 90% of its relative activity was retained after being held at 30-55 ℃ or pH 3.0-7.0 for 30 min.Conclusion A high cellulase-producing bacterium screened from 37 flue-cured tobacco strip samples was preliminarily identified as a strain of B. subtilis. The cellulase produced by the strain FX-1 exhibited a wide-range temperature and pH stability, and thus, had a considerable potential to be developed for new commercial use in tobacco manufact.
-
Keywords:
- tobacco /
- cellulase /
- screening /
- identification /
- enzymatic property
-
0. 引言
【研究意义】百合Lilium是多年生鳞茎植物,其切花商品价值高,市场需求量大。目前我国百合切花所需种球均从荷兰等国进口,每年种球进口量达2亿余头,且需求仍在不断增加。种球依赖进口导致切花成本居高不下,且市场抗风险能力弱,因此百合种球国产化繁育势在必行。基于亚热带平原地区的气候资源禀赋,采用反季节繁育技术可创制高品质的商品球,而繁育过程中经常出现种球二次抽薹的异常现象,对此异常现象的形成机制进行深入分析并采取科学的技术措施消除不利影响对实现百合种球国产化繁育具有重大意义。【前人研究进展】为了解决百合原种问题,打破花卉大国的控制,近年来国内陆续开展了相关种球繁育研究。主要集中在组培快繁[1-3]、鳞片扦插[4-6]、冷藏春化[7-8]、栽培技术[9-10]等几个方面,而抽薹通常是作为冷藏春化是否完全的验收指标,而本研究所涉及的二次抽薹现象是基于亚热带平原地区种球反季节繁育方式所形成的独特现象,其形成原因在于栽种的种球经历了冬春季节的低温诱导形成了生理分化,到了夏季春化完全后诱发种球出现二次抽薹现象。【本研究切入点】百合鳞茎作为多年生的地下贮藏器官,在其生长发育过程中经历了多次源、库功能上的转换,淀粉是百合鳞茎细胞内碳水化合物的主要贮藏形式,其代谢作用直接关系到鳞茎及植株的发育。针对形成二次抽薹现象的生物学机制研究仍未见报道。【拟解决的关键问题】本研究拟通过对不同发育时期种球的淀粉代谢机制进行研究,探讨百合种球二次抽薹前后不同发育时期,鳞茎中淀粉形态内容物变化以及淀粉酶基因的活性变化情况,以深入了解二次抽薹现象的形成情况,揭示形成二次抽薹现象的生物学机制并提出解决措施,为实现种球国产化繁育提供了理论依据。
1. 材料与方法
1.1 试验材料
试验于2018年4-6月在福州吴凤百合基地进行。选用东方百合西伯利亚品种分4次进行取样,4月24日取第一次样品,5月4日第二次取样,5月23日(鳞茎内部已观察到拔节),6月5日(鳞茎已抽薹8 cm),以下笔者把这4个时期分别称为膨大期、成熟期、萌动期、抽薹期。
1.2 试验方法
1.2.1 取样及养分含量测定
4次取样,每次取10个鳞茎,重复3次,洗净烘干后打成粉末,混合取样。用蒽酮比色法测定鳞片的淀粉、还原糖含量。
1.2.2 扫描电镜观察
分别取不同时期中层、外层鳞片进行切片观察,切取鳞片中心部位薄片1 cm×1 cm,用5%的戍二醛固定样品4h,磷酸缓冲液清洗样品3遍(各15 min),1%锇酸固定4 h,蒸馏水清洗3遍(各15 min),50%~100%酒精逐级脱水(各15 min,其中100%置换3次),环氧丙烷置换2遍,用日立(HITACHI)HCP-2型临界点干燥仪干燥,将样品用IB-5离子溅射仪喷铂金后,用日本电子(JEOL) JSM-6380LV型扫描电子显微镜观察。
1.2.3 总RNA提取和cDNA的合成
利用RNAprep pure多糖多酚植物总RNA提取试剂盒(天根生化科技有限公司,TIANGEN)提取百合鳞茎总RNA,1.2%琼脂糖凝胶电泳检测RNA质量。以各样品100 ng总RNA为模板,利用RevertAid First Strand cDNA Synthesis Kit#K1622(赛默飞世尔科技公司,Thermo Scientific)反转录合成cDNA第一链,存于−80℃储藏备用。
1.2.4 淀粉分解与合成关键酶基因表达分析
应用Applied Biosystems® QuantStudio®荧光定量PCR仪进行荧光检测,qRT-PCR的反应体系为2×ChamQ SYBR qPCR Master Mix 5 μL,各样品的cDNA 11 μL,Forward Primer和Reverse Primer(浓度10 μmol·L−1)各0.4 μL,用ddH2O补足体积至20 μL。qRT-PCR的反应程序为:95℃ 30 s;95℃ 10 s;60℃ 30 s, 40个循环。实验设计3个技术重复,数据读取由仪器自动完成,通过溶解曲线分析确定扩增产物的特异性。
根据百合已登录序列采用Primer 6.0分别设计AMY、SSS、SBE 3个基因的特异性引物序列(表1),由福州白鲸生物科技有限公司合成,以ACTIN为内参基因。采用2−ΔΔCT法[11]进行数据的相对定量分析。
表 1 引物序列及内参基因信息Table 1. Genes and primer sets used in qRT-PCR analysis基因名称
Gene name引物序列(5′–3′)
Primer sequence长度 Length/bp AMY F: GGGATATTCAGCAGAAATGGCGAAG 130 R: GCGGTTGGCATCTTGATTGTAGAGT SSS F: GTCAACGATTGGCACGCAAGTCT 171 R: ACCATACCACTCAGAGGGCAAGC SBE F: AGCAGCGGAGCGTCGTTAATCT 213 R: CCTGAGAGTCTTCAGCAGCCACT ACTIN F: GTCTGCGACAATGGTACTGGAATG 149 R: GCCTCATCACCAACATAAGCATCTT 注:F:正向引物;R:反向引物。
Note: F, forward primer; R, reverse primer.1.3 统计分析
利用Image Pro-Plus软件对扫描电镜的淀粉粒进行几何特征分析;试验数据采用Excel软件进行计算和处理,利用DPS软件进行差异显著性分析。
2. 结果与分析
2.1 不同发育时期鳞茎的养分含量变化
在4个不同的发育期中,百合淀粉含量总体呈先上升后下降趋势(图1),前期栽种的百合种球虽然地上植株已陆续开始黄化,但地下部仍在膨大贮藏养分,淀粉含量也从20.08%上升至21.26%,但到后期淀粉含量迅速下降,尤其在萌动期,淀粉含量相对之前下降了4.98%,而到了抽薹期,淀粉消耗相对趋缓。因此,在出现二次抽薹现象的过程中,百合的大部分能量用于内部初始拔节。而还原糖的增长也主要集中在萌动期(图2),增加了3.23%,之后缓慢下降,也就是说随着百合鳞茎内部拔节的发生,还原糖含量明显增加,表明鳞片的代谢性养分供给加速,这与此时鳞片中淀粉含量大幅下降是相关联的。
2.2 不同发育时期鳞茎的淀粉粒扫描电镜比较研究
在百合4个时期取鳞茎的中层鳞片,用扫描电镜观察百合鳞片中细胞的亚显微结构,可清楚地看到淀粉粒形态和分布变化。从图3(1-4)可以看出中层鳞片维管束细胞中淀粉粒的整体状态,栽种期的鳞茎有部分淀粉粒游离在细胞腔内,并且有絮状物包裹。随着鳞茎的生长发育,淀粉颗粒变大,开始逐步充满整个细胞腔,絮状物减少。到了拔节期,淀粉颗粒出现各种变形、凹陷、脱落,而抽薹期腔体空隙变大,小颗粒增多,颗粒表面及腔体内壁均出现大量泡状突起或是絮状物。
![]() 图 3 百合鳞茎抽薹过程中淀粉粒的SEM图像注:1~4. 膨大期(1)、成熟期(2)、萌动期(6)、抽薹期(4)百合中层鳞片淀粉粒的整体状态(×150);5. 膨大期鳞片淀粉粒与絮状物共存(×500);6. 成熟期鳞片淀粉粒(×500);7. 萌动期鳞片淀粉粒出现形态变异(×500);8. 抽薹期鳞片淀粉颗粒表面及腔体内壁出现大量泡状突起(×500);9. 成熟期鳞片单个淀粉粒(×2 000);10. 萌动期鳞片单个淀粉粒(×1 500); 11. 抽薹期鳞片单个淀粉粒(×4 500);12. 抽薹期鳞片出现淀粉粒呈撕裂状(×500)。Figure 3. SEM images of starch granules in bolting lily budsNote: 1-4. Whole starch granules in mid-layer scales of lily bulb at expanding stage (1), mature stage (2), germination stage (3), and bolting stage (4) (×150); 5. Starch granules and flocs at expanding stage (×500); 6. Starch granules at mature stage (×500); 7. Morphological variations of starch granules at germination stage (×500); 8. Surface and vesicular protuberances on surface and inner wall of starch granules at bolting stage (×500); 9. Individual starch granule at mature stage (×2 000); 10. Individual starch granule at germination stage (×1 500); 11. Individual starch granule at bolting stage (×4 500); 12. Torn starch granules at bolting stage (×500).
图 3 百合鳞茎抽薹过程中淀粉粒的SEM图像注:1~4. 膨大期(1)、成熟期(2)、萌动期(6)、抽薹期(4)百合中层鳞片淀粉粒的整体状态(×150);5. 膨大期鳞片淀粉粒与絮状物共存(×500);6. 成熟期鳞片淀粉粒(×500);7. 萌动期鳞片淀粉粒出现形态变异(×500);8. 抽薹期鳞片淀粉颗粒表面及腔体内壁出现大量泡状突起(×500);9. 成熟期鳞片单个淀粉粒(×2 000);10. 萌动期鳞片单个淀粉粒(×1 500); 11. 抽薹期鳞片单个淀粉粒(×4 500);12. 抽薹期鳞片出现淀粉粒呈撕裂状(×500)。Figure 3. SEM images of starch granules in bolting lily budsNote: 1-4. Whole starch granules in mid-layer scales of lily bulb at expanding stage (1), mature stage (2), germination stage (3), and bolting stage (4) (×150); 5. Starch granules and flocs at expanding stage (×500); 6. Starch granules at mature stage (×500); 7. Morphological variations of starch granules at germination stage (×500); 8. Surface and vesicular protuberances on surface and inner wall of starch granules at bolting stage (×500); 9. Individual starch granule at mature stage (×2 000); 10. Individual starch granule at germination stage (×1 500); 11. Individual starch granule at bolting stage (×4 500); 12. Torn starch granules at bolting stage (×500).同时,研究发现百合鳞茎细胞含有3种淀粉粒:A型(大粒)淀粉粒长轴直径≥50 μm,B型(中粒)20 μm≤长轴直径<50 μm,C型(小粒)长轴直径<20 μm(图3,5-12,表2)。
表 2 百合抽薹过程中淀粉粒特性比较Table 2. Characteristics of starch granules of bolting lily bulbs时期
Period淀粉粒类型
Type of starch granule长轴
Long axis(L)短轴
Short axis(S)L/S 范围 Min-Max/μm 平均 Mean/μm 范围 Min-Max/μm 平均 Mean/μm 范围 Min-Max/μm 平均 Mean/μm 膨大期
Expanding stageA 52.81-58.94 55.87 c 36.14-37.42 36.78 b 1.46-1.58 1.52 b B 31.15-39.58 35.03 a 17.86-33.32 24.22 ab 1.16-1.88 1.45 a 成熟期
Mature stageA 52.28-63.40 58.34 b 36.33-49.42 43.00 a 1.24-1.63 1.37 c B 21.08-48.68 35.60 a 14.01-36.52 25.37 a 1.21-2.25 1.50 a 萌动期
Germination stageA 53.03-68.90 61.48 a 24.79-43.30 35.98 b 1.47-2.42 1.77 a B 22.00-49.66 29.49 b 17.28-35.92 21.59 b 1.19-1.59 1.36 b C 16.74-18.34 17.54 b 13.96-14.42 14.19 a 1.20-1.27 1.24 a 抽薹期
Bolting stageB 23.20-46.43 34.29 ab 19.70-34.40 25.82 a 1.15-1.61 1.33 b C 17.62-19.58 18.60 a 13.82-15.50 14.66 a 1.26-1.28 1.27 a 注:不同类型淀粉粒进行方差分析,不同小写字母表示差异显著(P<0.05),相同字母者表示差异不显著(P>0.05)。
Note: Variance analysis of different types of starch grains, different lowercase letters indicate significant differences(P <0.05), the same letters indicate that the difference is not significant(P >0.05).(1)膨大期:包含A型和B型淀粉粒。A型淀粉粒平均大小为55.87 μm×36.78 μm,淀粉颗粒较大,呈椭圆型,淀粉粒表面粘连着丰富的絮状粘丝。在A型淀粉粒周围有部分B型淀粉粒分布,淀粉粒之间有空隙,排列较松散,平均大小为35.03 μm×24.22 μm。
(2)成熟期:包含A型和B型淀粉粒。A型淀粉粒排列较为紧密,呈菱形和椭圆型,颗粒间絮状粘丝减少,淀粉粒平均为58.34 μm×43.00 μm,B型淀粉粒少量游离于A型淀粉粒周边,平均为35.60 μm×25.37 μm。相比膨大期A型淀粉颗粒增幅显著,颗粒变大,且数量增多,这与淀粉含量测定结果相符。
(3)萌动期:包含A、B、C3种类型淀粉粒,C型小粒开始出现。腔体内淀粉颗粒总体排列松散,A型淀粉粒出现异形、凹陷或是拉伸(图3-7、10),长短轴比(L/S)达最大(1.77),淀粉粒大小平均为61.48 μm×35.98 μm,因此在萌动期淀粉大颗粒长轴被拉伸,短轴减小,淀粉颗粒被逐渐拆分。B型淀粉粒多为圆型或椭圆型,平均为29.49 μm×21.59 μm,淀粒颗粒显著减小。与此同时,近圆型的C型颗粒少量出现,平均为17.54 μm×14.19 μm,长短轴比(L/S)达最小(1.24)。此时的淀粉含量测定也发现萌动期百合鳞片中的淀粉含量相比膨大期和成熟期显著下降,淀粉不断被降解。
(4)抽薹期:包含B型和C型淀粉粒,A型淀粉粒消失。腔体内排列着较为紧密的B型淀粉粒,平均为34.29 μm×25.82 μm,C型淀粉粒在其周围游离分布,平均为18.60 μm×14.66 μm。B、C型颗粒表面均出现大量泡状突起,小颗粒可见以这种“出芽”(图3-11)的方式长出。抽薹期A型淀粉粒消失,B型淀粉粒相比萌动期显著增大,可以判断百合鳞茎抽薹过程中A型淀粉粒被分解为B型淀粉粒,为百合抽薹提供能量。同时,笔者在抽薹期还发现部分大量包裹絮状物的淀粉粒,观察发现其中1个C型淀粉粒呈撕裂状(图3-12)。并伴有絮状物,且极小淀粉粒形成之初都有大量絮状物包裹(图3-13),因此淀粉粒形成是否与絮状物有关,絮状物是何成分有待进一步研究。
2.3 淀粉分解与合成关键酶基因表达分析
由图4可知,百合鳞茎淀粉分解酶基因AMY在成熟期的表达量与膨大期并无显著性差异且略有下调,萌动期与抽薹期的AMY基因高度表达,分别约为膨大期的2.4倍和6.2倍,该结果与不同时期的百合淀粉含量与还原糖含量变化趋势相符。淀粉分解酶基因AMY集中在萌动期与抽薹期高度表达,α-淀粉酶将大量淀粉分解为还原糖和蔗糖,为百合种球二次抽薹的启动提供能量来源。
由图5-6可知,百合鳞茎淀粉合成酶关键酶基因SSS和SBE在成熟期表达水平最高,进入萌动期后表达强度出现显著性逐渐减弱,基因表达水平变化趋势与不同时期的百合淀粉含量变化趋势一致。在种球成熟期阶段,淀粉合成酶关键基因SSS和SBE高度表达,该时期百合种球内部大量养分以合成淀粉的形式进行储藏。
3. 讨论
3.1 淀粉和还原糖含量与百合抽薹的关系
孙红梅等[12]研究发现,亚洲系‘精粹’百合和兰州百合在出苗阶段淀粉含量下降,而在花后期达最大值,分别为28.64%和21.70%;还原糖含量则在花后期出现最小值。霍昱璟[13]证明,东方百合鳞茎在花芽分化时期中淀粉含量变化显著,其含量随着花芽分化的过程逐渐降低;夏宜平等[14]测定表明,从栽种期到含苞期,东方百合淀粉含量均下降,至盛花期后逐渐上升,而去花苞处理的淀粉含量高于未去花苞的处理。本研究针对百合种球二次抽薹现象前后不同时期中的淀粉和还原糖进行测定,结果表明,在萌动期百合淀粉含量迅速下降了4.98%,与之相对,还原糖含量显著增加,达11.3%。萌动期淀粉和还原糖含量的变化与前人的研究相符,当百合鳞茎发生形态变化时,内部淀粉分解为糖类,参于新陈代谢,为植株提供能量来源。
3.2 淀粉粒的形态特征变化以及与百合抽薹代谢的关系
近几年,对百合淀粉粒的研究主要有关花芽分化[15]、低温贮藏[16-17]、鳞茎更新发育[14]和不同培养方式[18],其中对淀粉粒显微结构变化的描述较为笼统,未进行几何特性的系统分析和分类,因而对百合形态变化过程中淀粉粒的分化、产生以及形态变异阐述不清晰。本研究对百合抽薹过程中的淀粉粒进行分析发现,百合鳞茎细胞含有3种淀粉粒:A型(大粒)淀粉粒长轴直径≥50 μm,B型(中粒)20 μm≤长轴直径<50 μm,C型(小粒)长轴直径<20 μm。膨大期和成熟期包含A型和B型淀粉粒,C型小淀粉粒在萌动期开始出现,而到了抽薹期A型大淀粉粒消失。萌动期A型淀粉粒出现异形、凹陷或是拉伸,长短轴比(L/S)达最大(1.77),变异度显著增大,而抽薹期A型淀粉粒消失不见,取而代之的是大量的B型和C型淀粉粒,且B型淀粉粒相比萌动期显著增大,可以判断百合鳞茎抽薹期中的部分B型淀粉粒是由A型淀粉粒分解而来,淀粉粒的分解为百合抽薹提供能量,这与前面的淀粉和还原糖含量变化测定结果一致。韦存虚等[19]对小麦胚乳淀粉粒的结构观察表明大淀粉粒的淀粉体通过缢缩进行增殖和分化,而百合鳞茎中是成熟的籽粒,不存在淀粉体,大淀粉粒很可能是以自身的拉伸变形来完成增殖和分化。邢世岩等[20]对叶籽银杏淀粉粒特性进行研究发现其中粒和小粒淀粉粒明显可见以“出芽”方式从大淀粉粒上长出。本研究结果显示,抽薹期B、C型颗粒表面均出现大量泡状突起似“出芽”,而其中一个C型淀粉粒又呈撕裂状,极小淀粉粒形成之初都有大量絮状物包裹,因此,小颗粒是以这种“出芽”的方式从大淀粉粒上长出或是通过拉伸撕裂的方式产生尚不明确。
3.3 淀粉代谢相关酶与百合鳞茎生长发育的关系
碳水化合物是植物体内非常重要的物质,一方面它是植物体内非常重要的组成成分,另一方面它参与新陈代谢,为植物提供能量来源,其组成形式及含量的变化影响着植物的生长发育[21]。淀粉作为百合鳞茎内主要的贮藏物质,百合的整个生长发育过程其实就是淀粉代谢的过程[22]。淀粉酶活性的强弱反应了植物体内碳水化合物的代谢状况,与植物生长发育密切相关。吴沙沙[23]的研究指出淀粉合成酶(可溶性淀粉合成酶)SSS可以作为百合鳞茎源或库功能的指标。杨春起[24]通过高通量转录组测序技术揭示了α-淀粉酶参与了种球的休眠解除。李雪艳等[25]对小鳞茎形成与发育转录组进行分析表明在生物学代谢过程中参与的基因最多,其中主要是淀粉-蔗糖代谢,并且验证了淀粉合成酶(可溶性淀粉合成酶)基因SSS、淀粉分支酶基因SBE等参与了小鳞茎生长发育的过程。结合前人的研究,用淀粉合成酶基因SSS、SBE和淀粉分解酶基因AMY针对反季节种球繁育过程中出现的二次抽薹现象进行表达量相对分析,能够直观反映出该过程淀粉酶活性变化,同时揭示二次抽薹现象出现的过程中,前期淀粉以合成为主储藏养分于种球之中,后期淀粉以分解为主,为二次抽薹提供能量来源。
4. 结论
本研究结果表明,百合种球反季节繁育过程中出现二次抽薹的现象,其能量来源于种球内部淀粉的消解。在种球膨大期到成熟期之间,测量的淀粉含量呈上升趋势,还原糖含量呈下降趋势,电镜观察显示A型淀粉颗粒增幅显著,颗粒变大,且数量增多,淀粉合成酶SSS、SBE高度表达,淀粉代谢形式以合成为主,种球汲取大量养分;在种球成熟期到萌动期之间,测定的淀粉含量大幅下降,还原糖含量大幅上升,电镜观察显示C型淀粉粒出现,A型淀粉粒被拆分,B型淀粉粒颗粒变小,淀粉分解酶基因AMY高度表达,淀粉代谢形式以消解为主,种球贮藏的养分被释放;在种球萌动期到抽薹期之间,测定的淀粉含量呈下降趋势,还原糖含量呈上升趋势,电镜观察显示A型淀粉粒消失,淀粉分解酶基因AMY表达水平提高,淀粉代谢形式以消解为主,种球贮藏的养分被充分释放。二次抽薹现象的出现消耗了种球内部大量的养分不利于种球下一季的生长,对商品球的质量和鲜切花的品质造成不利影响。为消解此现象带来的不利因素,种球反季节繁育过程当中应注重把握成熟种球的收储时间,以亚热带平原地区的气候条件为参考,夏季5月份上旬为成熟期种球的最佳采收时间。
-
表 1 样品片烟来源
Table 1 Source of flue-cured tobacco strip samples
编号
Number等级
Grade编号
Number等级
Grade1 云南马沾YLC1Y-2019片烟
Yunnan Mazhan YLC1Y-2019 flue-cured tobacco strips20 湖南永州宁远C3F-2019片烟
Hunan Yongzhou Ningyuan C3F-2019 flue-cured tobacco strips2 云南马沾C4FY-2018片烟
Yunnan Mazhan C4FY-2018 flue-cured tobacco strips21 湖南永州宁远B2F-2019片烟
Hunan Yongzhou Ningyuan B2F-2019 flue-cured tobacco strips3 云南保山AB-2019香料烟
Yunnan Baoshan AB-2019 spice tobacco22 辽宁YELC3F-2019片烟
Liaoning YELC3F-2019 flue-cured tobacco strips4 云南楚雄YLC1-2019片烟
Yunnan Chuxiong YLC1-2019 flue-cured tobacco strips23 辽宁B23F-2019片烟
Liaoning B23F-2019 flue-cured tobacco strips5 云南大理祥云YLC1Y-2019片烟
Yunnan Dali Xiangyun YLC1Y-2019 flue-cured tobacco strips24 贵州遵义铜仁YLC2Y-2019片烟
Guizhou Zunyi Tongren YLC2Y-2019 flue-cured tobacco strips6 云南马沾ELC1Y-2019片烟
Yunnan Mazhan ELC1Y-2019 flue-cured tobacco strips25 贵州遵义铜仁YLC1Y-2019片烟
Guizhou Zunyi Tongren YLC1Y-2019 flue-cured tobacco strips7 云南楚雄ELC1-2019片烟
Yunnan Chuxiong ELC1-2019 flue-cured tobacco strips26 山东潍坊诸城B2F-2019片烟
Shandong Weifang Zhucheng B2F-2019 flue-cured tobacco strips8 云南大理祥云ELC1Y-2019片烟
Yunnan Dali Xiangyun ELC1Y-2019 flue-cured tobacco strips27 山东潍坊诸城C3F-2019片烟
Shandong Weifang Zhucheng C3F-2019 flue-cured tobacco strips9 云南曲楚大F03-2019片烟
Yunnan Quchu Da F03-2019 flue-cured tobacco strips28 重庆彭水B2F-2019片烟
Chongqing Pengshui B2F-2019 flue-cured tobacco strips10 云南楚雄F03-2019片烟
Yunnan Chuxiong F03-2019 flue-cured tobacco strips29 黑龙江哈尔滨C3L-2019片烟
Heilongjiang Harbin C3L-2019 flue-cured tobacco strips11 福建龙岩三明YLC2YCB-1-2018片烟
Fujian Longyan Sanming YLC2YCB-1-2018 flue-cured tobacco strips30 巴西TMB1O-FJ-2019片烟
Brazil TMBIO-FJ-2019 flue-cured tobacco strips12 福建三明尤溪YLC1CB-2019片烟
Fujian Sanming Youxi YLC1CB-2019 flue-cured tobacco strips31 巴西B1O/C-2019片烟
Brazil B1O/C-2019 flue-cured tobacco strips13 福建龙岩永定YLC1Y-2019片烟
Fujian Longyan Yongding YLC1Y-2019 flue-cured tobacco strips32 巴西L1O-2019片烟
Brazil L1O-2019 flue-cured tobacco strips14 福建龙岩三明YLC2YCB-1-2019片烟
Fujian Longyan Sanming YLC2YCB-1-2019 flue-cured tobacco strips33 津巴布韦L1O/C(天泽)-2019片烟
Zimbabwe L1O/C(Tianze)-2019 flue-cured tobacco strips15 福建三明尤溪ELC1CB-2019片烟
Fujian Sanming Youxi ELC1CB-2019 flue-cured tobacco strips34 津巴布韦L1O/C(英美)-2019片烟
Zimbabwe L1O/C (Anglo-American)-2019 flue-cured tobacco strips16 福建龙岩永定ELC1Y-2019片烟
Fujian Longyan Yongding ELC1Y-2019 flue-cured tobacco strips35 津巴布韦L1OA(环球)-2019片烟
Zimbabwe L1OA (Global)-2019 flue-cured tobacco strips17 福建龙岩南平SLC4-2019片烟
Fujian Longyan Nanping SLC4-2019 flue-cured tobacco strips36 赞比亚L1OL-3(CNT)-2019片烟
Zambia L1OL-3 (CNT)-2019 flue-cured tobacco strips18 福建龙岩三明CF03-2019片烟
Fujian Longyan Sanming CF03-2019 flue-cured tobacco strips37 阿根廷ASBOCF-1-2019片烟
Argentina ASBOCF-1-2019 flue-cured tobacco strips19 福建龙三南X2F03-2019片烟
Fujian Long Sanan X2F03-2019 flue-cured tobacco strips表 2 葡萄糖标准曲线制作参数
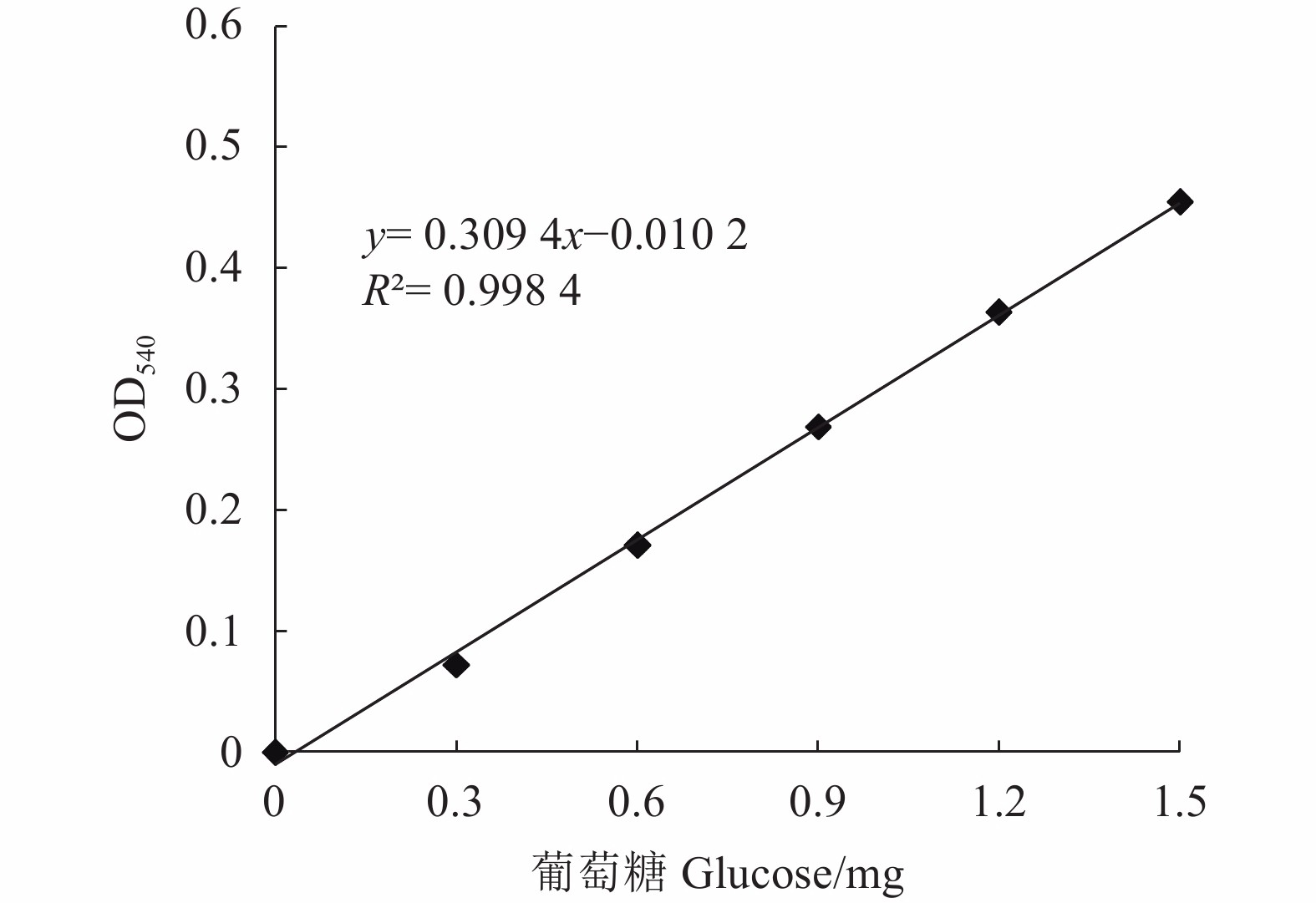
Table 2 Parameter of glucose standard curve
管号
Tube number葡萄糖溶液
Glucose solution/mg·mL−1蒸馏水
Distilled water/mLDNS/mL 0 0.0 2.0 1.5 1 0.2 1.8 1.5 2 0.4 1.6 1.5 3 0.6 1.4 1.5 4 0.8 1.2 1.5 5 1.0 1.0 1.5 注:葡萄糖溶液为1.5 mg·mL−1。
Note: glucose solution was 1.5 mg·mL−1.表 3 FX-1菌株刚果红染色结果
Table 3 Congo red staining of FX-1
菌株
Strain菌落直径
Colony
diameter/mm水解圈直径
Hydrolysis circle
diameter/mmH/C FX-1 5.89±0.41
(SD=0.3141)23.58±0.38
(SD=0.3138)4.01±0.23
(SD=0.2529)表 4 菌株FX-1的生理生化特征
Table 4 Physiological and biochemical characteristics of FX-1
测定指标
Measurement item结果
Result测定指标
Measurement item结果
Result革兰氏染色
Gram stain+ 硝酸盐还原试验
Nitrate reduction test+ 接触酶试验
Exposure to enzyme test+ V-P试验
V-P test+ 柠檬酸盐试验
Citrate test+ 吲哚试验
Indole test− 注:+:阳性;−:阴性。
Note: +: Positive; −: Negative. -
[1] 闫克玉, 闫洪洋, 李兴波, 等. 烤烟烟叶细胞壁物质的对比分析 [J]. 烟草科技, 2005, 38(10):6−11. DOI: 10.3969/j.issn.1002-0861.2005.10.002 YAN K Y, YAN H Y, LI X B, et al. Comparative analysis of cell wall substances in flue-cured tobacco leaf [J]. Tobacco Science & Technology, 2005, 38(10): 6−11.(in Chinese) DOI: 10.3969/j.issn.1002-0861.2005.10.002
[2] BALIGA V, SHARMA R, MISER D, et al. Physical characterization of pyrolyzed tobacco and tobacco components [J]. Journal of Analytical and Applied Pyrolysis, 2003, 66(1/2): 191−215.
[3] 蒲俊, 刘彦岭. 烤烟纤维素含量与烟叶品质的相关性研究 [J]. 中国农业文摘(农业工程), 2019, 31(2):67−70. DOI: 10.3969/j.issn.1002-5103.2019.02.019 PU J, LIU Y L. The correlation between the content of cellulose in cured tobacco and the quality of tobacco leaves [J]. Agricultural Science and Engineering in China, 2019, 31(2): 67−70.(in Chinese) DOI: 10.3969/j.issn.1002-5103.2019.02.019
[4] BANOŽIĆ M, JOKIĆ S, AČKAR Đ, et al. Carbohydrates-key players in tobacco aroma formation and quality determination [J]. Molecules (Basel, Switzerland), 2020, 25(7): 1734. DOI: 10.3390/molecules25071734
[5] YANG Y, PENG Q R, OU M Y, et al. Research progress in tobacco fermentation [J]. Journal of Biosciences and Medicines, 2018, 6(6): 105−114. DOI: 10.4236/jbm.2018.66008
[6] 卓治非, 林大燕, 高忠渊, 等. 生物技术在造纸法再造烟叶中应用的研究进展 [J]. 黑龙江造纸, 2017, 45(1):15−17. DOI: 10.3969/j.issn.1673-0283.2017.01.005 ZHUO Z F, LIN D Y, GAO Z Y, et al. The research progress of the application of biotechnology in paper-making reconstituted tobacco [J]. Heilongjiang Pulp & Paper, 2017, 45(1): 15−17.(in Chinese) DOI: 10.3969/j.issn.1673-0283.2017.01.005
[7] 王莹, 范坚强, 包可翔, 等. 一株片烟中纤维素降解菌的筛选鉴定及其初步应用研究 [J]. 现代农业科技, 2011(8):25−28. DOI: 10.3969/j.issn.1007-5739.2011.08.010 WANG Y, FAN J Q, BAO K X, et al. Screening and identification of a cellulose degradation bacteria from tobacco Lamina and its preliminary application [J]. Modern Agricultural Sciences and Technology, 2011(8): 25−28.(in Chinese) DOI: 10.3969/j.issn.1007-5739.2011.08.010
[8] GRAVELY L E, GEISS V L, et al. Microbial digestion of tobacco materials using mixedcultures [P]. US Patent: 4476881, 1984.
[9] 叶建斌, 王璐, 杨峰, 等. 类芽孢杆菌发酵原料浸提液提升再造烟叶品质 [J]. 中国烟草学报, 2019, 25(1):33−38. YE J B, WANG L, YANG F, et al. Improving quality of reconstituted tobacco via fermenting extract of its raw material with Paenibacillus sp [J]. Acta Tabacaria Sinica, 2019, 25(1): 33−38.(in Chinese)
[10] 于少藤, 毛淑蕊, 胡安妥, 等. 改善烟叶品质微生物的筛选及其作用效果研究 [J]. 南京农业大学学报, 2021, 44(4):766−777. DOI: 10.7685/jnau.202011008 YU S T, MAO S R, HU A T, et al. Study on screening of microorganisms for improving tobacco leaf quality and their effects [J]. Journal of Nanjing Agricultural University, 2021, 44(4): 766−777.(in Chinese) DOI: 10.7685/jnau.202011008
[11] 范坚强, 周彬, 宋纪真, 等. 片烟黑曲霉菌株产纤维素酶的条件优化及酶的分离纯化 [J]. 浙江农业学报, 2012, 24(6):1122−1128. FAN J Q, ZHOU B, SONG J Z, et al. Optimization of cellulase production by Aspergillus niger separated from tobacco and its separation and purification [J]. Acta Agriculturae Zhejiangensis, 2012, 24(6): 1122−1128.(in Chinese)
[12] 罗艳青, 张丹, 冯海玮, 等. DNS法检测灰略红链霉菌JSD-1产纤维素酶的CMC酶活条件的优化 [J]. 食品工业科技, 2015, 36(3):156−162. LUO Y Q, ZHANG D, FENG H W, et al. Optimization of conditions for CMCase activity of cellulase detected with DNS method for Streptomyces griseorubens(JSD-1) [J]. Science and Technology of Food Industry, 2015, 36(3): 156−162.(in Chinese)
[13] 布坎南(R. E. BUCHANAN)等. 伯杰细菌鉴定手册[M]. 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组译. 8版. 北京: 科学出版社, 1984. [14] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. [15] 郭勇. 酶工程[M]. 北京: 科学出版社, 2009. [16] 王霞, 华琳, 张海龙, 等. 纤维素降解菌CMC-4的分离鉴定、诱变和酶学特性研究 [J]. 土壤, 2017, 49(5):919−925. WANG X, HUA L, ZHANG H L, et al. Isolation, identification, mutagenesis of cellulose-degrading bacterium CMC-4 and its enzymatic properties [J]. Soils, 2017, 49(5): 919−925.(in Chinese)
[17] 孙会刚, 徐慧敏, 黄天姿, 等. 产酸性纤维素酶细菌的筛选鉴定及其酶学性质 [J]. 食品科技, 2021, 46(7):55−59. SUN H G, XU H M, HUANG T Z, et al. Screening, isolating and enzymatic properties of bacterium producing acidic cellulase [J]. Food Science and Technology, 2021, 46(7): 55−59.(in Chinese)
[18] 李碧婵, 陈金燕, 苏雅娜, 等. 纤维素酶高产细菌的筛选、鉴定及酶学特性分析 [J]. 湖北农业科学, 2016, 55(17):4572−4576. LI B C, CHEN J Y, SU Y N, et al. Screening and identification of a cellulase producing bacterium and its cellulase characterization [J]. Hubei Agricultural Sciences, 2016, 55(17): 4572−4576.(in Chinese)
[19] KALAIYARASI M, VIJAYARAGHAVAN P, RAJ S R F, et al. Statistical approach for the production of protease and cellulase from Bacillus cereus KA3 [J]. Bioprocess Engineering, 2017, 1: 93.
[20] 薛磊, 郑泽浩, 郭志刚, 等. 烟草增香细菌的筛选及其作用效果 [J]. 中国烟草科学, 2019, 40(5):60−67. XUE L, ZHENG Z H, GUO Z G, et al. Screening and application of aroma-enhancing bacteria for tobacco [J]. Chinese Tobacco Science, 2019, 40(5): 60−67.(in Chinese)
[21] ABD ELHAMEED E, SAYED A R M, RADWAN T E E, et al. Biochemical and molecular characterization of five Bacillus isolates displaying remarkable carboxymethyl cellulase activities [J]. Current Microbiology, 2020, 77(10): 3076−3084. DOI: 10.1007/s00284-020-02135-8
[22] YANG J K, ZHANG J J, YU H Y, et al. Community composition and cellulase activity of cellulolytic bacteria from forest soils planted with broad-leaved deciduous and evergreen trees [J]. Applied Microbiology and Biotechnology, 2014, 98(3): 1449−1458. DOI: 10.1007/s00253-013-5130-4
[23] 杨宗灿, 冯颖杰, 李龙飞, 等. 烟叶中纤维素高效降解菌的筛选与作用效果研究 [J]. 河南农业大学学报, 2018, 52(3):418−423. YANG Z C, FENG Y J, LI L F, et al. Study on screening and application of an efficient cellulose-degrading strain from tobacco leaf [J]. Journal of Henan Agricultural University, 2018, 52(3): 418−423.(in Chinese)
[24] 邹芳, 赵娟, 雷燕萍, 等. 一株烟草秸秆降解菌的分离、鉴定及酶学性质研究 [J]. 土壤, 2016, 48(5):939−945. ZOU F, ZHAO J, LEI Y P, et al. Isolation, identification and enzymatic property of a tobacco straw degradation strain [J]. Soils, 2016, 48(5): 939−945.(in Chinese)
[25] 梅金飞. 烟杆高效菌剂研发及其应用[D]. 安徽: 阜阳师范大学, 2020 MEI J F. Development and application of high-efficiency bactericide in tobacco rods[D]. Anhui: Fuyang Normal University, 2020. (in Chinese)
-
期刊类型引用(1)
1. 青亚林,侯炳豪,张宇航,曾珊珊,高婷,叶乃兴. 茶树GATA基因家族的全基因组鉴定及表达分析. 江苏农业科学. 2024(09): 42-50 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: