Study on matrix effects in the detection of 15 pesticide residues in 6 types of tea leaves
-
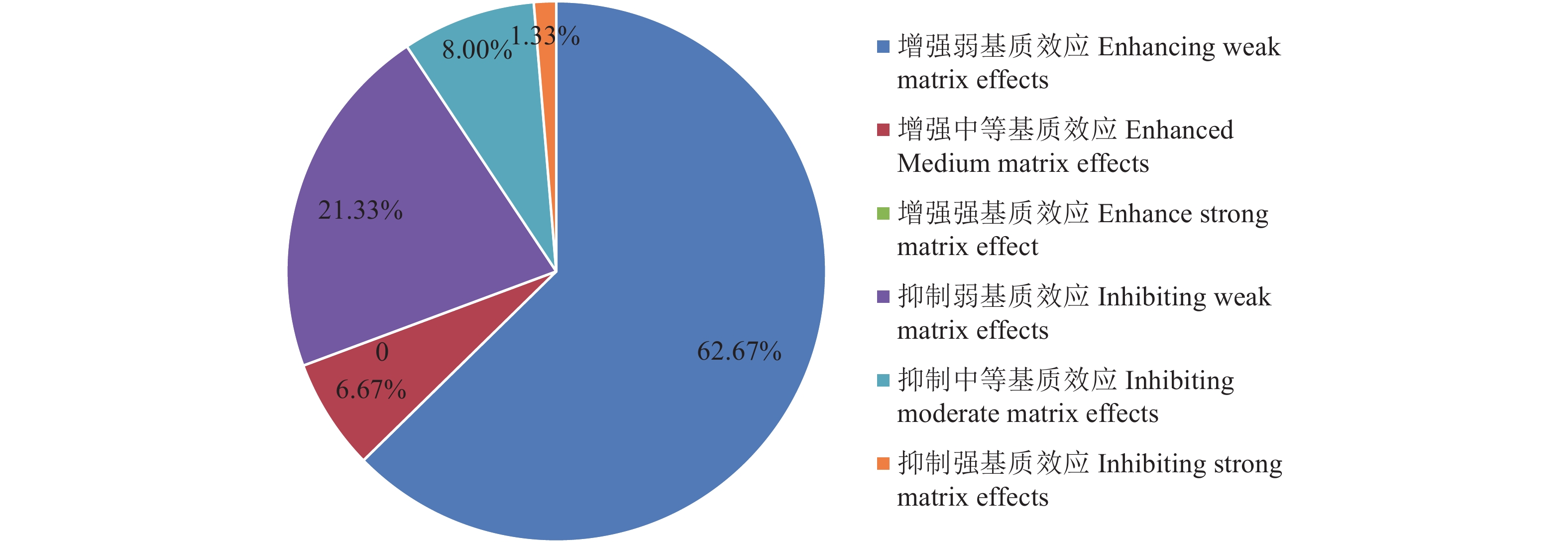
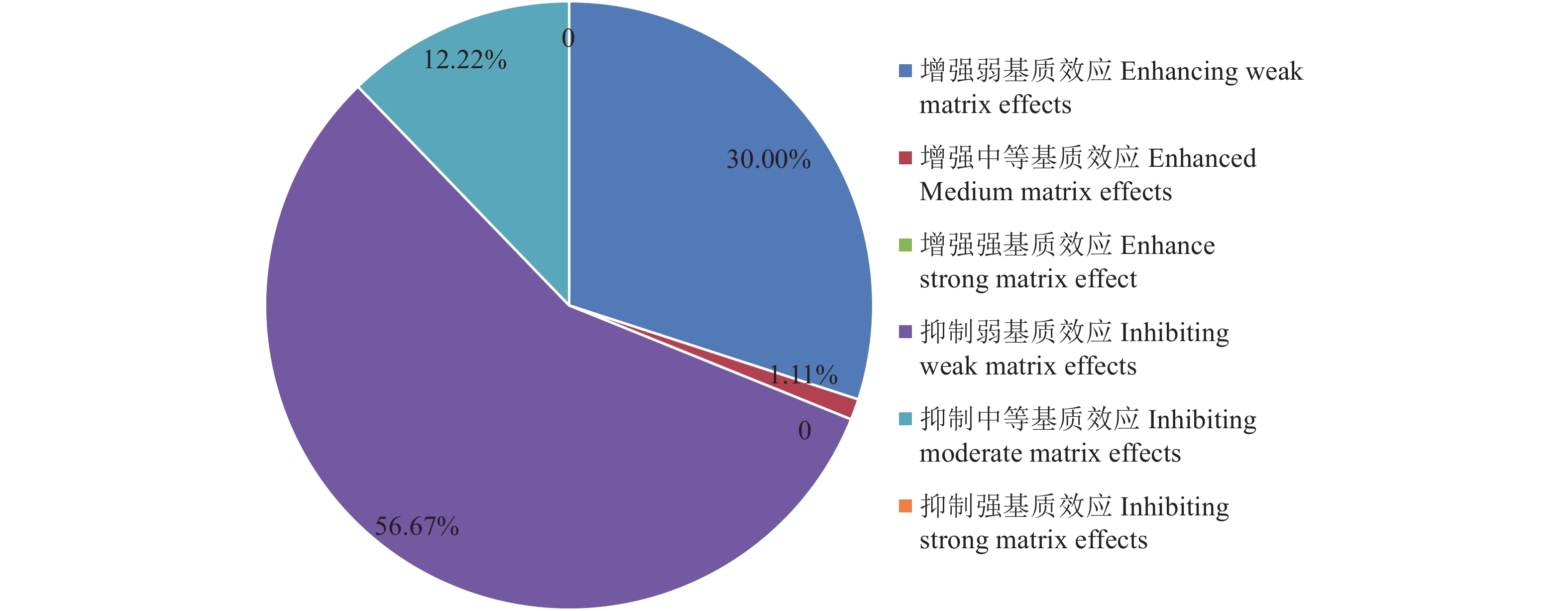
摘要:目的 对气相色谱-串联质谱法测定6类茶叶中15种农药残留过程中产生的基质效应进行分析,并就日常检测中常见批量样品同时处理时可采用的替代基质进行探讨。方法 茶叶样品经QuEChERS前处理,配制质量浓度在0.01~0.32 mg·L−1的溶剂标准曲线和基质标准曲线,经GC-MS/MS测定后计算基质效应。结果 6类茶叶中15种农药检测过程中均产生增强基质效应,其中以增强强基质效应为主,基质效应区间范围1.35%~411.58%, 强、中、弱基质效应分别为73.33%、23.33%、3.33%。以红茶为替代基质测定15种农药时,主要以产生增强弱基质效应为主,整体区间范围为|0.62%|~|59.22%|,强中弱基质效应分别为1.33%、14.67%、84.00%;以混合茶叶为代表基质测定15种农药时,主要以产生抑制弱基质效应为主,整体区间范围为|0.09%|~|48.09%|,强中弱基质效应分别为0、13.33%、86.67%。结论 茶叶样品基质复杂,在农残检测时使用基质标曲分析可降低基质效应,提高检测结果的准确度。使用混合茶叶样品作为替代基质配制基质标曲对茶叶农残进行定量分析时,可有效提高批量样品的分析效率。Abstract:Objective Matrix effects in detecting 15 pesticide residues in six types of tea using gas chromatography-tandem mass spectrometry (GC-MS/MS) with a sample pretreatment of QuEChERS were analyzed for assay improvement.Methods Tea samples were pretreated with QuEChERS, and solvent and matrix standard curves for the mass concentrations of 0.01-0.32 mg·L−1 prepared. After a GC-MS/MS determination, the matrix effects were calculated.Results Matrix effects were enhanced in the determination that ranged from 1.35-411.58% with the strong, medium, and weak matrix effects of 73.33%, 23.33%, and 3.33%, respectively. When black tea was used as an alternative matrix, they ranged 0.62-59.22% with the strong, medium, and weak matrix effects at 1.33%, 14.67% and 84.00%, respectively. Whereas, when a mixed tea was applied as an alternative matrix, suppressed matrix effects resulted at 0.09-48.09% with the strong, medium, and weak matrix effects at 0, 13.33% and 86.67%.Conclusion The matrix effects in the pesticide residue detection on teas were complex. Application of a matrix standard curve reduced the matrix effects and improved the determination accuracy. By using mixed tea sample as an alternative matrix, the analysis efficiency was significantly enhanced.
-
0. 引言
【研究意义】太子参(Pseudostellaria heterophylla)隶属于石竹科(Caryophyllaceae)假繁缕属(Pseudostellaria),是一种以块根入药的中药材,具有益气健脾和生津润肺的功效[1]。我国的福建、贵州和安徽等省是其主要种植区。随着人工栽培面积的扩大和种植年限的增加,太子参连作障碍逐年加重,重茬3年以上的地块几乎绝产[2]。土壤微生物结构失衡和土传病原微生物增加是太子参发生连作障碍的重要原因[3−4]。连作土壤中病原菌数量增加,太子参生长过程中受病原菌侵染的机率也相应增加[5]。镰刀菌属(Fusarium)真菌是引起太子参根腐病的主要病原菌,也是太子参产生连作障碍的关键致病菌之一[6−7]。长期和过量地施用化肥会破坏土壤生境、改变根际土壤微生物群落结构和功能,使得土传病原菌的活性受到激发,导致作物病害越发严重,形成连作障碍[8]。因此,探究有效缓解连作障碍的措施对太子参产业的可持续发展具有重要意义。【前人研究进展】目前,缓解作物连作障碍的措施主要有土壤灭菌、土壤改良、轮作和休耕等。在药用植物栽培中,药材道地性的要求决定了该类药材须在特定的区域内进行生长或种植[9−10]。但是,福建省太子参种植区域以山地居多,水旱轮作受限,大多数采取休耕措施,使得适宜太子参种植的耕地也日益减少。土壤改良通常采用增施有机肥、微生物肥和生物炭等措施改善土壤肥力,调整微生物群落结构,减缓连作障碍并实现增收[11−14]。近年来,基质栽培作为一种新兴的生态无土栽培技术,可有效地改善作物根系微环境和通气性,并且发挥促长防病和缓解连作障碍的作用,在设施蔬菜栽培中已广泛应用[15]。陈慕松等[16]采用栽培基质种植太子参,发现连作3年仍能有效阻止土传病害的发生,且产量未见明显降低。【本研究切入点】由于纯基质栽培成本高,水肥管理严格,使得目前采用栽培基质种植太子参的研究与应用仍然较少,栽培基质改良土壤对太子参根际土壤微生物群落结构影响也有待深入研究。【拟解决的关键问题】采用栽培基质替换太子参根围部分原土进行连作地块的土壤改良,并调查该措施对太子参的根腐病发病率、产量及根际土壤真菌群落变化的影响,分析内在相关性,以期为探索并建立太子参的可持续栽培模式,并为原位使用栽培基质改良土壤以缓解连作障碍和提高复种指数提供理论依据。
1. 材料与方法
1.1 试验材料
栽培基质购自厦门市江平生物基质技术股份有限公司,由基质化木纤维、发酵谷壳、泥炭和发酵菇渣等组成,N+P2O5+K2O≥3%、有机质≥45%、pH值5.5~6.5,用量为150 m3·hm−2;狮马复合肥15-15-15S型,购自中化化肥有限公司,用量为400 kg·hm−2;供试栽培品种为太子参柘参1号,为农户自留种,并剔除发病和破损种参,用量450 kg·hm−2。
1.2 试验地点
试验地位于福建省宁德市柘荣县(119°43'E, 27°05'N),气候温和湿润,年平均气温15.5 ℃,年总积温
5000 ~6500 ℃,年平均日照时数1634.2 h;年平均降水量为1600 ~2400 mm。3个代表性试验区块分别选在英山乡桦岭村(HL),山地、黄壤土;富溪镇富溪村(FX),水田地、砂壤土;城郊乡际头村(JT),水田地、黑壤土。不同田块的理化性质差异显著(表1)。表 1 不同地块土壤理化性质Table 1. Physicochemical properties of soils at different types of fields试验地块
Test field全氮
Total N/%全磷
Total P/(g·kg−1)全钾
Total K/(g·kg−1)有机质
organic matter/(g·kg−1)酸碱度
pHHL 0.06±0.01 b 0.45±16.05 c 10.76±0.77 b 8.39±0.12 b 5.18±0.11 a FX 0.07±0.01 b 0.78±13.32 b 14.42±0.86 a 8.90±0.44 b 4.07±0.07 b JT 0.14±0.00 a 1.21±36.06 a 14.08±1.07 a 17.37±0.46 a 5.38±0.13 a 同列不同小写字母表示差异显著(P<0.05)。HL、FX和JT分别代表桦岭村、富溪村和际头村试验地。下同。
Data with different lowercase letters on same column indicate significant difference (P<0.05). HL, FX, and JT refer to test fields at Hualing, Fuxi, and Jitou Villages, respectively. Same for below.1.3 试验设计
试验于2020~2022年在3个代表性试验区块开展,前一茬商品参收获后休耕5个月左右,于当年12月初再次种植。每个试验区块面积0.4 hm2,分别设置栽培基质处理组(T,简称基质处理组)和常规对照组(C,简称对照组)。每垄宽70 cm,垄间沟宽30 cm。每垄面上开2条深15 cm、上口宽17 cm左右的V型沟,并在沟底施入复合肥作为底肥。在V型沟两侧排放种参,株距5 cm。基质处理组(T)先用5 cm厚度的栽培基质覆盖底肥后排放种参,再用基质完全覆盖种参,最后覆盖10 cm厚度的原土;对照组(C)先用原土覆盖底肥后排放种参,继续用原土覆盖。每个处理重复3次,其他栽培管理措施均一致。
1.4 栽培基质改良对太子参根腐病发病率和产量的影响
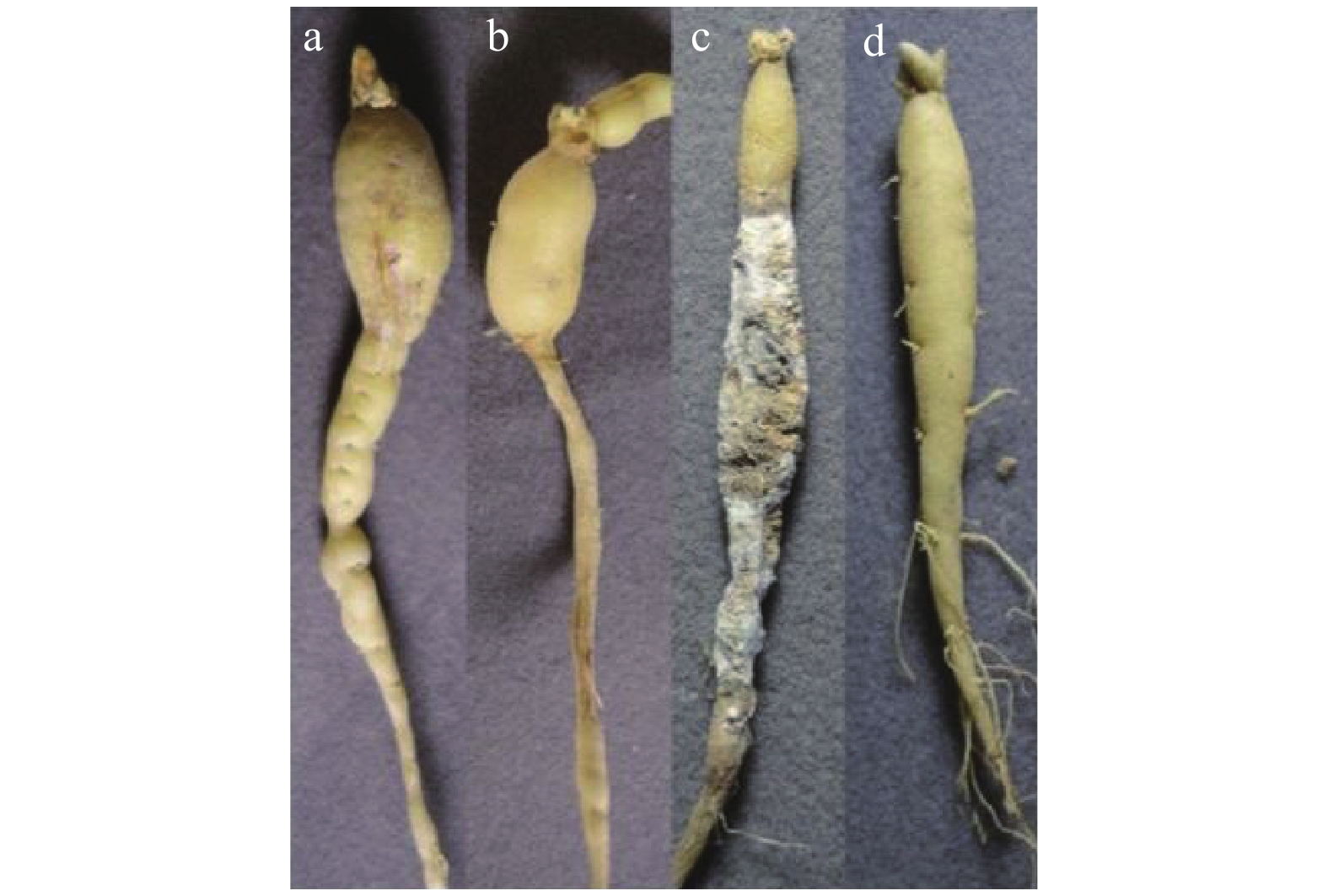
3个试验区块分别进行太子参块根的根腐病发病率调查和产量测定。根腐病的症状和调查方法参照文献[6, 17]。根腐病典型症状见图1。发病率调查:于采收前10 d,挖取整株太子参,抖净粘连土块,调查根腐病发病块根数和总块根数,每个处理组采集6株(获得的有效块根数平均达100根以上)。产量测定:每个处理组取20 m2,于7月上旬采挖,收获的太子参洗净后,晾干至表面无水分后称取鲜重,并按柘荣地区太子参的通用折干率27%计算[18]。以上各调查项目均重复3次。块根发病率和干重产量计算公式如下。
块根发病率/%=(发病块根数/调查总块根数)×100 (1) 干重产量/(kg⋅hm−2)=每平方米鲜重产量(kg)×104×27% (2) 1.5 栽培基质改良对太子参根际土壤真菌菌落结构的影响
1.5.1 土壤样品采集
选择无法水旱轮作的英山乡桦岭村山地试验区块作为代表性田块,采用5点取样法分别于太子参出苗期(3月2日)、块根膨大期(5月2日)和采收期(7月2日)采集土壤。选择长势健壮的太子参植株,除去植株周边约5 cm表层土壤,将整株连根挖出,然后抖动去除与根系或块根结合较松的土壤,收集根系或块根上的土壤。每个样点取3株,将15株太子参根际土壤样品均匀混合后放入无菌袋中待用。每个处理组取3个重复。基质处理组(T)的出苗期、膨大期和采收期的土壤样品分别记为T3、T5和T7,对照组(C)样品分别记为C3、C5和C7。标记好的土壤样品立即放入液氮冻存,返回实验室保存于−80 ℃超低温冰箱。
1.5.2 土壤真菌群落结构的ITS高通量测序
采用E.Z.N.A. Soil DNA Kit(Omega Bio-tek, USA)试剂盒提取供试土壤样本的基因组DNA。使用Nanodrop 2000(ThermoFisher Scientific, USA)检测DNA浓度和纯度。以样品DNA为模板,进行真菌ITS1区测序,引物为ITS1(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2(5′-GCTGCGTTCTTCATCGATGC-3′)[19]。PCR 扩增体系为20 μL:5×Fast Pfu缓冲液4 μL,2.5 mol·L−1 dNTPs 2 μL,5 μmol·L−1上、下游引物各0.8 μL,Fast Pfu 聚合酶0.4 μL,20 ng ·μL−1模板DNA 1 μL,BSA(牛血清白蛋白)0.2 μL,灭菌ddH2O 10.8 μL。PCR反应程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃复性45 s,35个循环;最后72 ℃延伸10 min。PCR产物经2%琼脂糖凝胶电泳检测,纯化后送上海美吉生物医药科技有限公司利用Miseq PE300平台进行高通量测序,原始数据上传至NCBI SRA数据库。
1.5.3 太子参的根腐病发病率、产量与根际真菌的相关性分析
选择英山乡桦岭村山地试验区基质处理组(T)和对照组(C)的太子参发病率和产量,与该地块太子参采收期根际土壤中相对丰度位于前10的优势真菌属,采用Pearson相关系数法分析因子间的相关性。
1.5.4 数据处理与分析
剔除下机数据中的标签及引物序列,进行序列拼接得到原始数据。使用Usearch软件(Version 7.0)过滤和去嵌合体序列得到有效序列;利用Mothur软件(version v.1.30.1)绘制稀释度曲线,分析根际土壤真菌群落中物种的Coverage(覆盖度)、Sobs和Chao1(丰富度指数)、Shannon和Simpson(多样性指数)等指数;利用Uparse软件在97%相似性水平上进行OTUs聚类分析;利用RDP classifier软件和Silva数据库进行物种分类注释。将序列进行物种分类,对每个样本和每个物种进行序列丰度计算,并构建样本和物种分类单元序列丰度矩阵。基于物种分类,绘制门和属水平的群落柱形图、属水平的群落Heatmap图。其他数据采用DPS 20.05版软件的最小显著性差异法(LDS)进行方差分析。
2. 结果与分析
2.1 栽培基质改良对太子参根腐病发病率和产量的影响
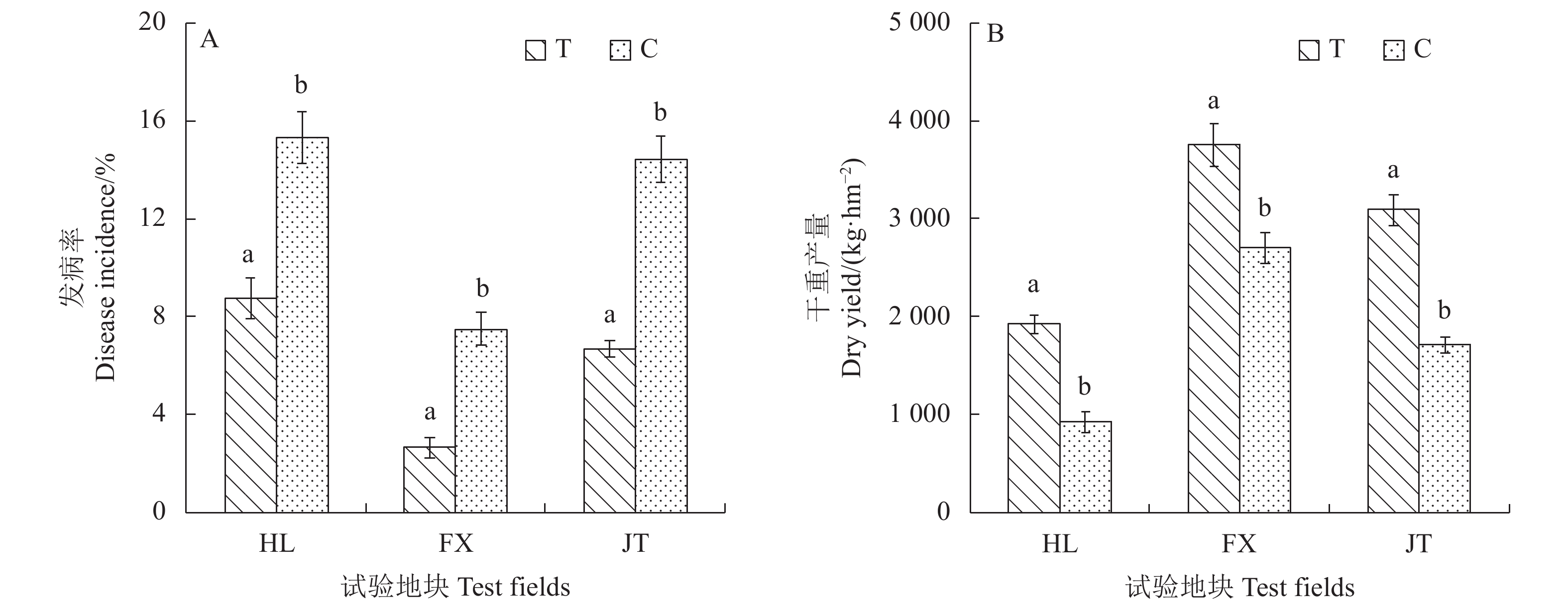
发病率调查结果表明(图2a):基质处理组(T)在3个试验地块(桦岭村HL、富溪村FX和际头村JT)的根腐病发病率依次为8.76%、2.66%和6.70%,较对照组分别降低6.56%、4.84%和7.69%。产量测定结果表明(图2b):3个试验地块基质处理组的产量依次为
1921.50 、3753.00 、3087.00 kg·hm−2,较对照组分别提高109.31%、39.00%和80.53%。说明采用栽培基质改良土壤能显著降低太子参的根腐病发病率并提高产量,且对山地(HL)的改良效果最为显著。2.2 栽培基质改良对太子参根际土壤真菌菌落结构的影响
2.2.1 对土壤真菌群落多样性的影响
测序原始数据在NCBI SRA数据库的登录号为SRX26416204-SRX26416221,分析结果见表2。所有样品的测序覆盖度均大于0.99,表明测序结果能够真实地反映各样本的真菌群落情况。对照组C3和C5的Sobs指数均显著高于处理组T3和T5(P<0.05),Simpson和Shannon指数与处理组T3和T5的无显著差异(P>0.05);对照组C7的Chao1和Simpson指数显著低于处理组T7(P<0.05),而Shannon指数结果反之。说明太子参出苗期和膨大期的对照组真菌群落丰富度高于基质处理组,但多样性无显著差异;而采收期的对照组真菌群落丰富度降低且多样性升高。
表 2 太子参根际土壤真菌群落Alpha多样性指数Table 2. Alpha diversity of fungal communities in P. heterophylla rhizosphere取样时间Sampling time 样品编号Sample group 丰富度指数Richness index 多样性指数Diversity index 覆盖度Coverage Sobs Chao1 Simpson Shannon Coverage 出苗期 T3 433.33±39.82 b 506.72±52.79 a 0.12±0.02 a 3.14±0.18 a 0.998±0.000 a Seedling stage C3 607.33±32.68 a 658.19±19.23 a 0.11±0.06 a 3.66±0.43 a 0.998±0.000 a 膨大期 T5 386.33±29.59 b 608.16±53.87 a 0.14±0.05 a 2.88±0.25 a 0.997±0.000 a Expanding period C5 514.33±46.27 a 607.33±70.91 a 0.11±0.02 a 3.52±0.11 a 0.998±0.001 a 采收期 T7 447.33±31.42 a 614.59±18.27 a 0.33±0.02 a 2.29±0.09 b 0.997±0.000 a Harvest period C7 351.67±17.70 a 458.68±45.84 b 0.14±0.00 b 2.80±0.04 a 0.997±0.000 a 同一取样时间同列不同小写字母表示差异显著(P<0.05)。
Data with different lowercase letters on same column at same sampling time indicate significant difference (P< 0.05).2.2.2 对土壤真菌群落组成的影响
桦岭村山地试验区采集的2个处理组18个根际土壤样本测序后共注释到13个门、48个纲、118个目、279个科、597个属、946个种。
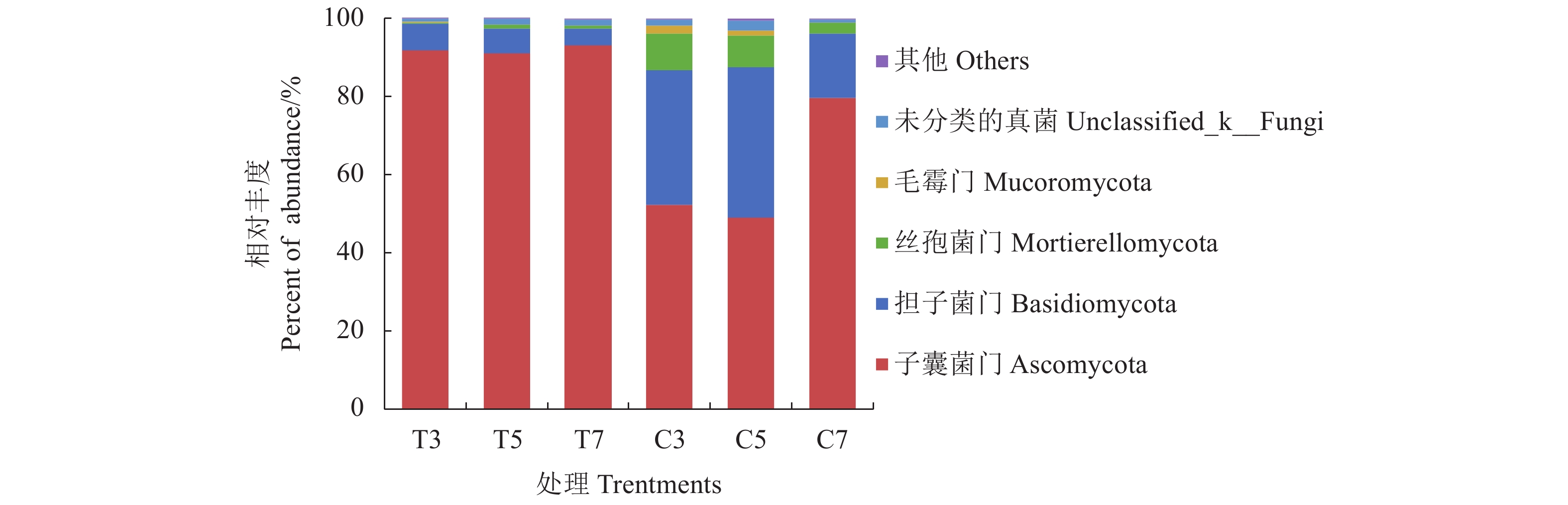
门水平的分析结果表明(图3):在基质处理组T和对照组C的根际土壤中检测到物种相对丰度大于1%的门有4个,分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)和毛霉门(Mucoromycota)。子囊菌门(Ascomycota)和担子菌门(Basidiomycota)在基质处理组和对照组的相对丰度均在85%以上,为优势真菌门。这两个门在太子参出苗期(T3、C3)和膨大期(T5、C5)根际土壤中的相对丰度较为稳定,但在对照组采收期(C7)根际土壤中的变化明显。
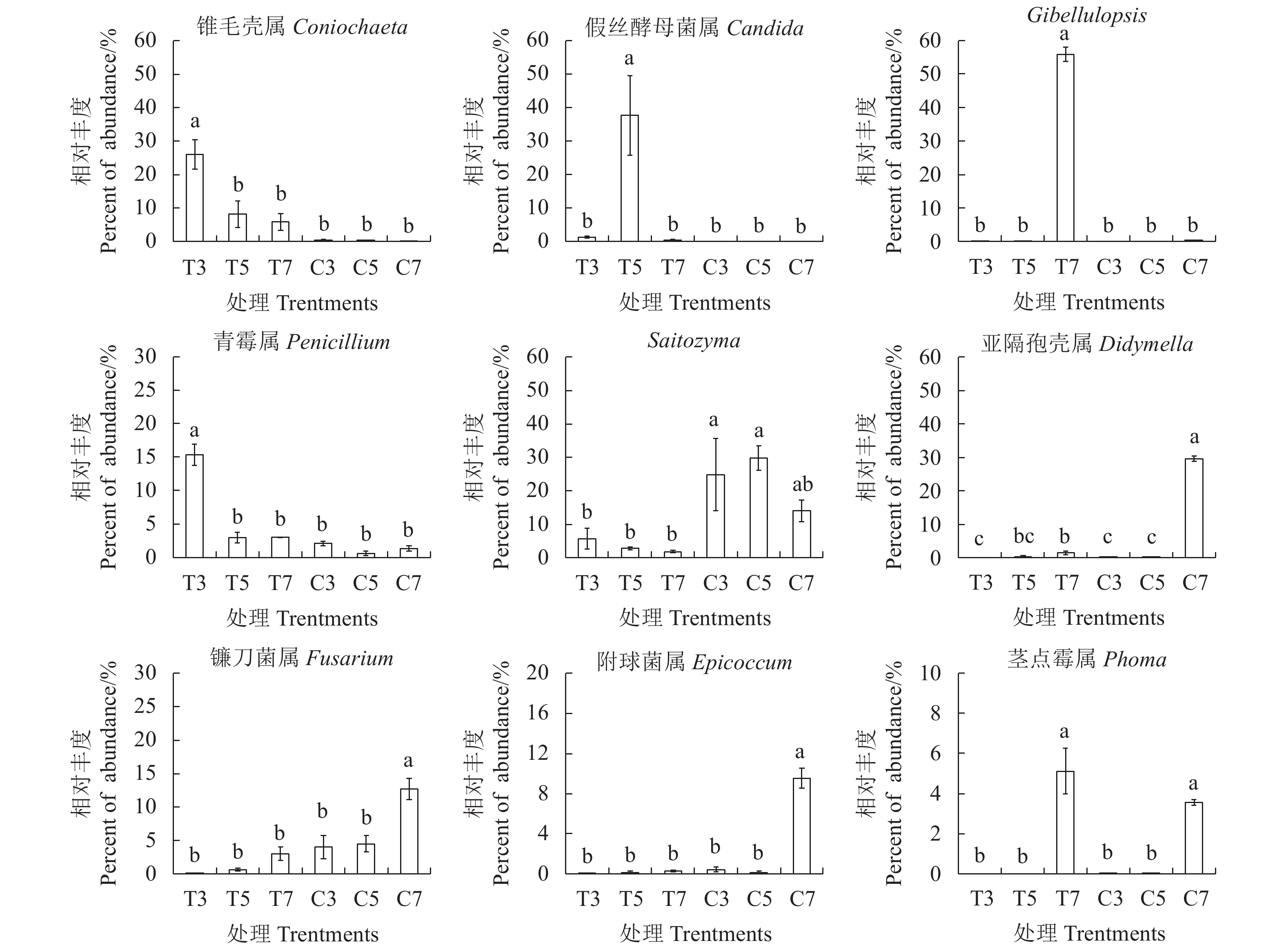
属水平的分析结果表明(图4):在基质处理组T和对照组C的根际土壤中检测到物种相对丰度大于1%的属有24个,其丰度比例超过60%。基质处理组的优势属为锥毛壳属(Coniochaeta)、假丝酵母菌属(Candida)、Gibellulopsis和青霉属(Penicillium)。锥毛壳属(Coniochaeta)和青霉属(Penicillium)是基质处理组出苗期(T3)的优势属,相对丰度分别为26.04%和15.33%,显著高于其他处理组(P<0.05);假丝酵母菌属(Candida)和Gibellulops分别是基质处理组膨大期(T5)和采收期(T7)的优势属,相对丰度分别为37.66%和55.83%,显著高于其他处理组(P<0.05)。对照组的优势属为Saitozyma、亚隔孢壳属(Didymella)、镰刀菌属(Fusarium)和附球菌属(Epicoccum)。Saitozyma在对照组出苗期(C3)和膨大期(C5)的相对丰度分别为24.81%和29.77%,显著高于基质处理组(P<0.05);亚隔孢壳属(Didymella)、镰刀菌属(Fusarium)和附球菌属(Epicoccum)在对照组采收期(C7)的相对丰度分别为29.61%、12.73%和9.55%,显著高于其他处理组(P<0.05)。茎点霉属(Phoma)在采收期(C7和T7)的相对丰度最高,分别为3.55%和5.11%,二者间差异不显著(P>0.05)。镰刀菌属(Fusarium)、亚隔孢壳属(Didymella)、附球菌属(Epicoccum)和茎点霉属(Phoma)等4个属是太子参生长期根腐病和叶斑病的关键病原菌,其丰度在对照组采收期的根际土壤样品中均显著升高,说明栽培基质改良土壤有利于调节土壤中的真菌群落结构,并抑制病原菌生长。
2.2.3 土壤中真菌群落的聚类分析
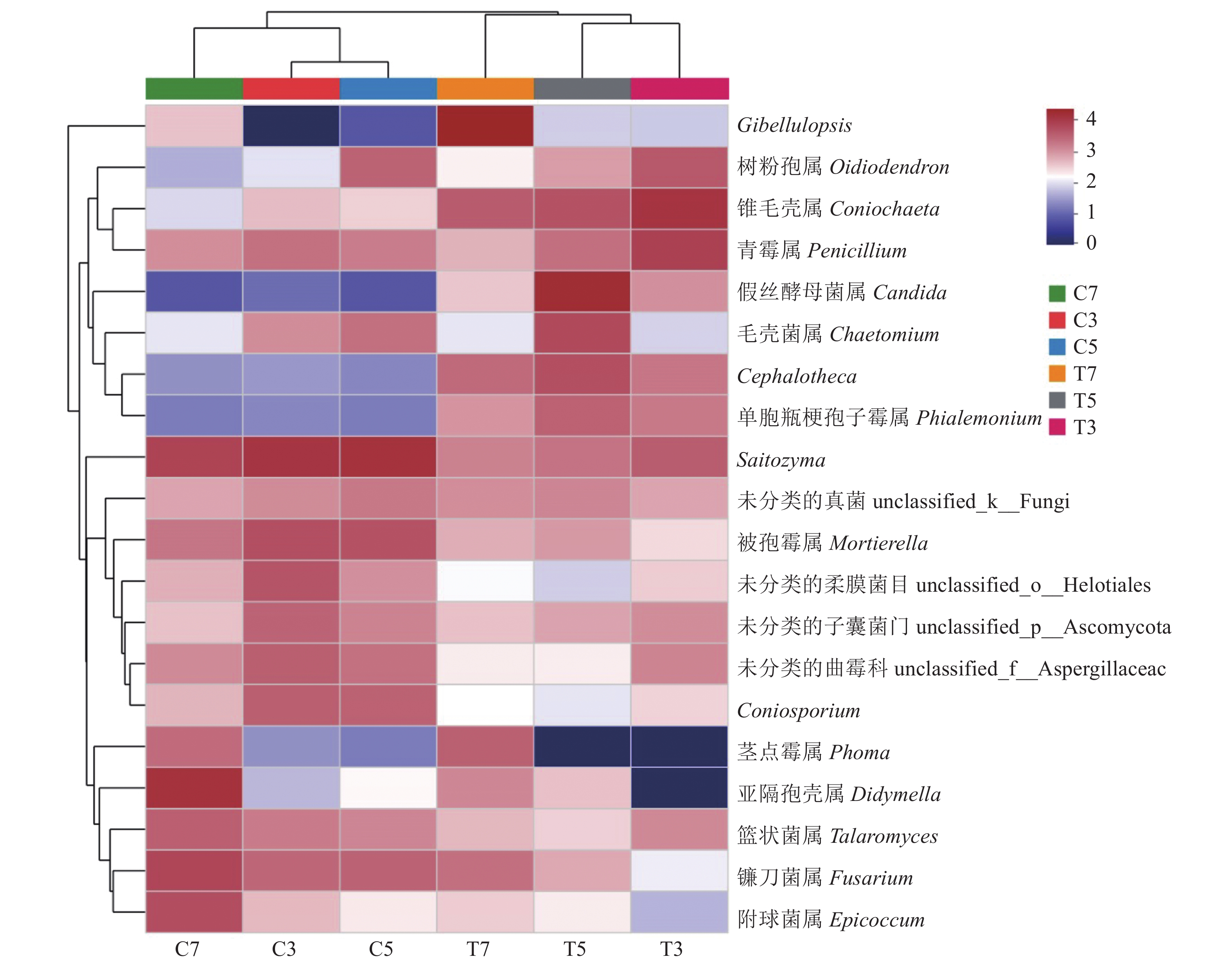
取丰度位于前20优势属的真菌物种进行Heatmap聚类分析(图5)。不同样品被聚为2类:对照组C3、C5和C7与基质处理组T3、T5和T7各自聚为1类,说明基质处理组和对照组的根际土壤真菌群落结构存在明显差异;其次,T3和T5、C3和C5又各自聚为1亚类,说明太子参出苗期和膨大期的物种群落结构较相似,采收期土壤中病原真菌数量的增加会改变其群落结构。不同物种被聚为3类:第一类仅包括Gibellulopsis,在基质处理组采收期(T7)中相对丰度最高;第二类包括树粉孢属(Oidiodendron)、锥毛壳属(Coniochaeta)、青霉属(Penicllium)、假丝酵母菌属(Candida)、毛壳菌属(Chaetomium)、Cephalotheca、单胞瓶梗孢子霉属(Phialemonium)等7个属,在基质处理组中的相对丰度高于对照组;第三类包括Saitozyma、未分类的真菌unclassified_k_Fungi、被孢霉属(Mortierella)、未分类的柔膜菌目unclassified_o_Helotiales、未分类的子囊菌门unclassified_p_Ascomycota、未分类的曲霉科unclassified_f_Aspergillaceae、Coniosporium、茎点霉属(Phoma)、亚隔孢壳属(Didymella)、篮状菌属(Talaromyces)、镰刀菌属(Fusarium)和附球菌属(Epicoccum)等12个属,在对照组中的相对丰度高于基质处理组。
![]() 图 5 太子参根际土壤真菌群落在属水平上的Heatmap图分析横向和纵向分别为各样本和各分类单元的聚类结果,红色和蓝色分别代表在对应样本中丰度较高和较低的属。Figure 5. Heatmap on fungal community at genus level in P. heterophylla rhizosphereClustering of samples is shown on x-axis and that of taxonomic units, on y-axis; samples of high abundance shown in red color and those of low abundance, in blue.
图 5 太子参根际土壤真菌群落在属水平上的Heatmap图分析横向和纵向分别为各样本和各分类单元的聚类结果,红色和蓝色分别代表在对应样本中丰度较高和较低的属。Figure 5. Heatmap on fungal community at genus level in P. heterophylla rhizosphereClustering of samples is shown on x-axis and that of taxonomic units, on y-axis; samples of high abundance shown in red color and those of low abundance, in blue.2.3 太子参的根腐病发病率、产量与根际真菌的相关性分析
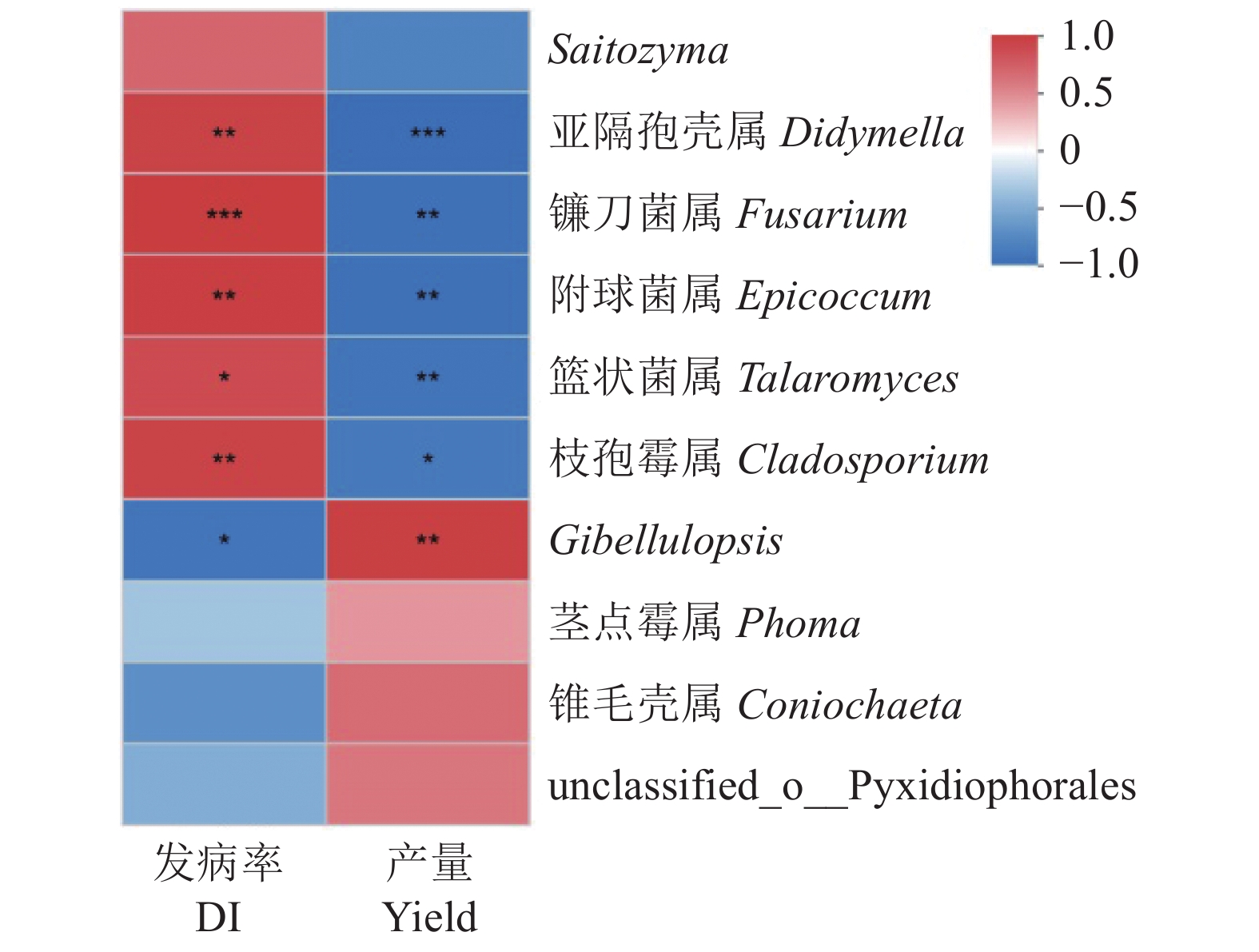
桦岭村山地试验区(HL)的发病率、产量与该地块采收期根际土壤优势真菌属的相关性分析表明(图6):根腐病的发病率与Gibellulopsis呈负相关(R=−
0.9095 ,P<0.05),与镰刀菌属(Fusarium)呈正相关(R=0.9802 ,P<0.001);太子参产量与Gibellulopsis呈正相关(R=0.9559 ,P<0.05),与镰刀菌属(Fusarium)呈负相关(R=−0.95013 ,P<0.01)。此外,根腐病的发病率、产量与亚隔孢壳属(Didymella)、附球菌属(Epicoccum)、篮状菌属(Talaromyces)和枝孢霉属(Cladosporium)等属也具有相关性。说明栽培基质改良土壤不仅能显著降低根腐病原菌镰刀菌属的丰度,也能降低其他潜在病原菌的丰度。3. 讨论与结论
栽培基质因含有丰富的有机质和适宜作物生长的营养元素,被广泛用于设施作物的无土栽培。基质栽培能促进作物生长、提高作物抗逆性和抗病性,并增加作物产量和耕地种植指数。陈慕松等[16]研究发现采用基质栽培太子参连作3年的产量较田园土的对照组增产113%。本研究结果也表明,采用栽培基质替换太子参根围部分原土,根腐病的发病率降低了4.84%~7.69%,产量提高了39.00%~109.31%,特别是对有机质含量较低和无法水旱轮作的山地土壤改良效果显著。其中,根腐病发病率降低是太子参增产的重要原因之一。根腐病原菌在作物生长早期易从幼嫩根系侵入、破坏根系生长,对以根及根茎入药的药材影响巨大[20]。本研究采用栽培基质替换太子参根围部分原土,隔离已产生连作障碍的土壤,能够改善根部生长环境,并有效防控土传病害,显著提高产量。
栽培基质的松散颗粒结构、丰富的有机质和土壤性质的改善可为微生物生长提供适宜的环境。土壤中的微生物通过参与有机质转化、养分循环和生物修复,在维持土壤功能方面也发挥着重要作用[21]。土壤中微生物的群落结构组成与作物的生长和产量密切相关,通过增施有机肥、生物炭和微生物肥等措施能调节作物根际土壤的真菌群落结构,并促进增产[22−23]。本研究以改良效果最佳的桦岭村山地试验区块作为代表性田块,发现栽培基质改良土壤的措施能够显著改变太子参根际真菌的种类和群落结构。该措施能提高子囊菌门真菌的丰度、降低担子菌门真菌的丰度,与管鸿智等[24]和罗俊等[25]的研究结果一致。锥毛壳属、青霉属、假丝酵母菌属和Gibellulopsis分别为基质处理组不同生长阶段的优势菌属且动态变化显著,可能与不同生长季节的温湿度、基质营养成份和太子参不同生长阶段根际分泌物有关。锥毛壳属真菌广泛存在于森林、农田和水体等生境中[26]。青霉属的许多种类是植物病害的生防菌,仅少数种类可引起植物病害[5]。假丝酵母菌属的部分种是食品和堆肥的发酵菌[27−28]。桂莎等[29]利用复合菌剂防控香蕉枯萎病的研究中发现,施用复合菌剂能显著提高Gibellulopsis属相对丰度,且其丰度与香蕉枯萎病病情指数显著负相关。本研究同样发现Gibellulopsis属在太子参采收期的土壤样本中为优势属,且能显得降低多种关键病原菌的相对丰度。因此,后续研究可以针对性地分离筛选Gibellulopsis属真菌并进行连作障碍修复产品的开发。
采用栽培基质改良土壤除了增加潜在的有益菌属丰度外,还能降低太子参生长过程中关键病原菌的丰度。如镰刀菌属是作物根腐病的主要病原菌,在连作地中其数量会显著增加[7, 30]。姜婷婷等研究发现土壤改良剂能够降低苹果种植过程中镰刀菌属的丰度[31]。本研究同样发现栽培基质改良土壤能降低太子参种植过程的镰刀菌属丰度,且其丰度与根腐病的发病率呈正相关,与产量呈负相关。亚隔孢壳属、茎点霉属和附球菌属可引起作物叶斑病[32−34],本研究发现这3个属在太子参采收期对照组的丰度显著增加。太子参采收期对照组的关键病原菌种类增加且丰度升高,说明病害的加重会造成土壤中真菌群落的多样性升高和丰富度降低;而基质处理组真菌群落的丰富度升高和多样性降低,且优势菌属的丰度显著增加,可能更有利于抑制病原真菌的种类和数量。
综上所述,本研究采用栽培基质替换太子参根围部分原土进行连作地块土壤改良是一种新的种植模式,能够降低太子参根腐病的发病率、调节根际微生物的群落结构并提高产量,有效缓解连作障碍。因此,后续将扩大试验区域,进一步研究该栽培基质改良措施对不同土壤类型的太子参连作障碍改良效果及其机制,以期获得更加全面的效果评价,进而指导生产。
-
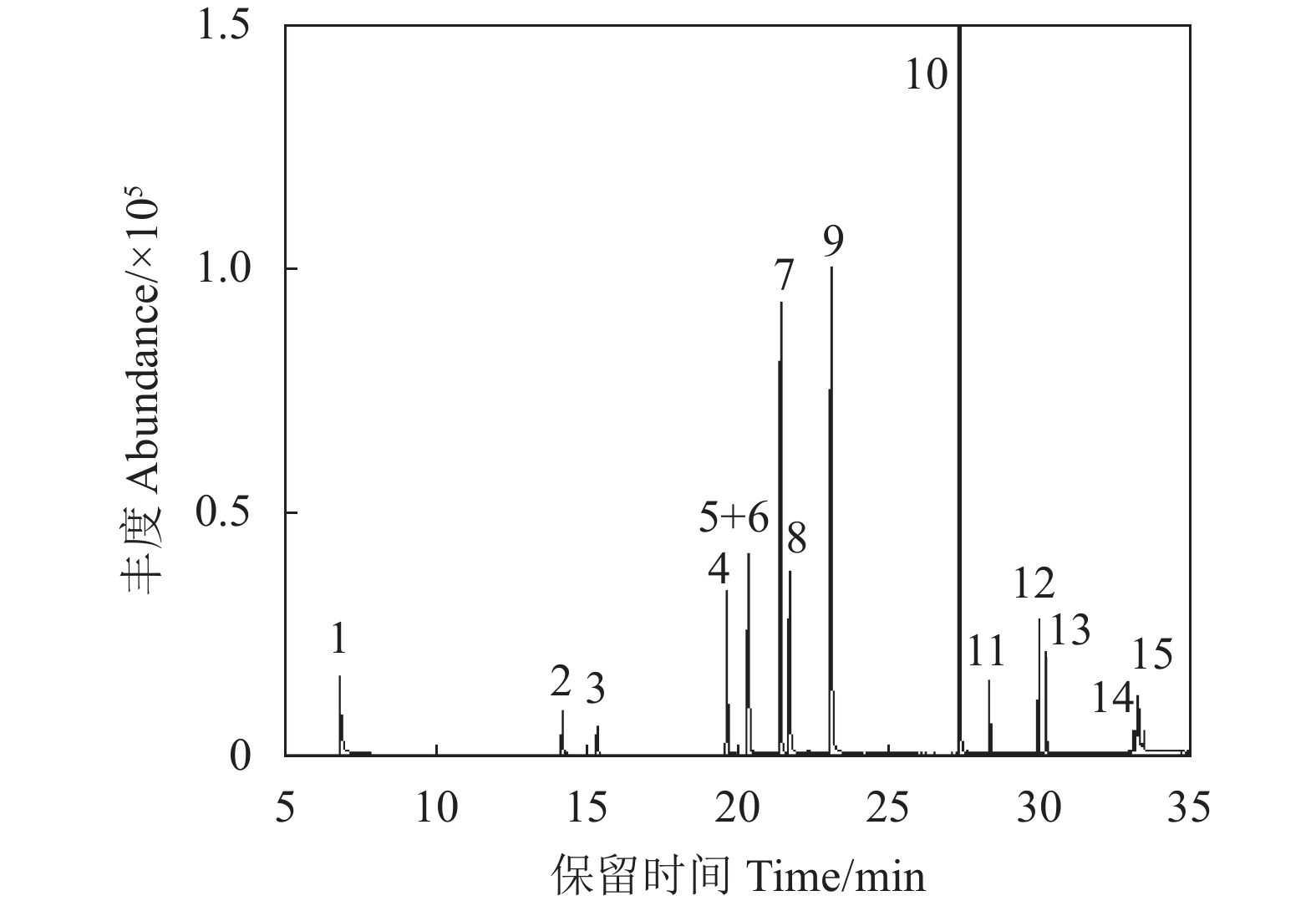
图 1 15种农药典型MRM色谱图
1. 敌敌畏;2.甲拌磷;3.五氯硝基苯;4.毒死蜱;5.马拉硫磷; 6.杀螟硫磷;7.甲基异柳磷; 8.水胺硫磷;9.腐霉利;10.杀扑磷; 11.联苯菊酯;12.甲氰菊酯;13.氯菊酯;14.溴氰菊酯;15.苯醚甲环唑。
Figure 1. Typical MRM chromatogram of 15 pesticide residues
1: dichlorvos; 2: phorate; 3: pentachloronitrobenzene; 4: chlorpyrifos; 5: malathion; 6: fenitrothion; 7: isofenphos-methy; 8: isocarbophos; 9: procymidone; 10: methidathion; 11: bifenthrin; 12: fenpropathrin; 13: permethrin; 14: deltamethrin; 15: difenoconazole.
表 1 15种农药名称、CAS号、色谱及质谱参数及定量限
Table 1 Chemical abstract service(CAS) number,GC-MS/MS parameters and limit of quantitation of 15 pesticide residues
序号
No.目标物
CompoundCAS号
CAS
number保留时间
Retention
time/min母离子
Precursor
ions(m/z)子离子
Product
ions(m/z)碰撞能量
Collision
energy/eV定量限
limit of quantitation/
(mg·kg−1)线性范围
Linear range/
(mg·kg−1)1 敌敌畏 Dichlorvos 62-73-7 6.81 109.0 79.0* 5 0.05 0.01~0.32 184.9 93.0 10 2 甲拌磷 Phorate 298-02-2 14.17 260.0 75.0* 5 0.01 0.01~0.32 230.9 128.9 25 3 五氯硝基苯 Pentachloronitrobenzene 82-68-8 15.32 295.0 237.0* 20 0.05 0.01~0.32 236.9 142.9 30 4 毒死蜱 Chlorpyrifos 2921-88-2 19.73 196.9 169.0* 15 0.05 0.01~0.32 198.9 171.0 15 5 马拉硫磷 Malathion 121-75-5 20.39 126.9 99.0* 5 0.05 0.01~0.32 172.9 99.0 15 6 杀螟硫磷 Fenitrothion 122-14-5 20.42 277.0 260.0* 5 0.05 0.01~0.32 277.0 109 20 7 甲基异柳磷 Isofenphos-methy 99675-03-3 21.44 199.0 121.0* 10 0.01 0.01~0.32 241.1 199.1 10 8 水胺硫磷 Isocarbophos 24353-61-5 21.74 135.9 108.0* 15 0.05 0.01~0.32 135.9 69.0 30 9 腐霉利 Procymidone 32809-16-8 23.10 96.0 67.1* 10 0.05 0.01~0.32 96.0 53.1 15 10 杀扑磷 Methidathion 950-37-8 23.11 144.9 85.0* 5 0.05 0.01~0.32 144.9 58.1 15 11 联苯菊酯 Bifenthrin 82657-04-3 27.35 181.2 165.2* 25 0.05 0.01~0.32 181.2 166.2 10 12 甲氰菊酯 Fenpropathrin 39515-41-8 28.34 207.9 181.0* 5 0.05 0.01~0.32 264.9 210.0 10 13 氯菊酯 Permethrin 51877-74-8 29.97 183.1 168.1* 10 0.05 0.01~0.32 183.1 153.0 15 14 溴氰菊酯 Deltamethrin 52918-63-5 33.13 252.9 93.0* 15 0.05 0.01~0.32 250.7 172.0 5 15 苯醚甲环唑 Difenoconazole 119446-68-3 33.25 322.8 264.8* 15 0.05 0.01~0.32 264.9 202.0 20 *定量离子对。
*: quantitative ion.表 2 6类茶叶中15种农药检测过程中产生的基质效应比较
Table 2 Matrix effects generated in detecting 15 pesticide residues in 6 types of tea
农药名称
Pesticide name基质效应 ME/% 绿茶
Green tea红茶
Black tea花茶
Scented tea黑茶
Dark tea白茶
White tea乌龙茶
Oolong绝对平均值
Absolute mean敌敌畏 Dichlorvos 1.35 31.59 8.81 27.06 35.20 38.15 23.69 甲拌磷 Phorate 6.13 43.31 23.75 72.32 56.16 60.19 43.64 五氯硝基苯 Pentachloronitrobenzene 47.35 23.34 45.46 39.95 48.73 60.08 44.15 毒死蜱 Chlorpyrifos 57.39 48.00 56.25 33.78 66.10 75.31 56.14 马拉硫磷 Malathion 101.11 148.50 123.92 154.93 161.75 153.84 140.68 杀螟硫磷 Fenitrothion 112.99 135.59 126.29 145.96 134.13 156.16 135.19 甲基异柳磷 Isofenphos-methy 66.55 44.65 60.34 61.92 64.59 70.01 61.34 水胺硫磷 Isocarbophos 108.10 140.04 115.11 152.66 158.59 178.60 142.18 腐霉利 Procymidone 57.67 34.95 53.11 73.39 55.28 61.84 56.04 杀扑磷 Methidathion 14.51 180.82 58.92 142.15 138.94 104.98 106.72 联苯菊酯 Bifenthrin 39.66 30.69 40.75 50.40 48.68 50.76 43.49 甲氰菊酯 Fenpropathrin 76.60 75.33 81.19 95.37 94.99 88.00 85.25 氯菊酯 Permethrin 85.72 79.55 83.41 110.82 103.12 107.78 95.07 溴氰菊酯 Deltamethrin 269.31 298.67 304.64 394.83 354.78 366.68 331.49 苯醚甲环唑 Difenoconazole 211.21 391.51 279.99 411.58 344.98 381.49 336.79 表 3 以红茶为代表基质时5类茶叶中15种农药检测过程中产生的基质效应比较
Table 3 Matrix effects generated in detecting 15 pesticides in 5 types of tea with black tea used as a representative matrix
农药名称
Pesticide name基质效应 ME/% 绿茶
Green tea花茶
Scented tea黑茶
Dark tea白茶
White tea乌龙茶
Oolong绝对平均值
Absolute mean敌敌畏 Dichlorvos −22.98 −17.31 −3.45 2.75 4.99 10.29 甲拌磷 Phorate −25.95 −13.65 20.24 8.96 11.78 16.12 五氯硝基苯 Pentachloronitrobenzene 19.47 17.93 13.46 20.58 29.79 20.25 毒死蜱 Chlorpyrifos 6.34 5.58 −9.61 12.23 18.45 10.44 马拉硫磷 Malathion −19.07 −9.89 2.59 5.33 2.15 7.81 杀螟硫磷 Fenitrothion −9.59 −3.95 4.40 −0.62 8.73 5.46 甲基异柳磷 Isofenphos-methy 15.14 10.84 11.93 13.78 17.53 13.85 水胺硫磷 Isocarbophos −13.30 −10.39 5.26 7.73 16.07 10.55 腐霉利 Procymidone 16.83 13.45 28.48 15.07 19.93 18.75 杀扑磷 Methidathion −59.22 −43.41 −13.77 −14.91 −27.01 31.66 联苯菊酯 Bifenthrin 6.87 7.70 15.09 13.76 15.36 11.75 甲氰菊酯 Fenpropathrin 0.73 3.34 11.43 11.22 7.23 6.79 氯菊酯 Permethrin 3.44 2.15 17.42 13.13 15.73 10.37 溴氰菊酯 Deltamethrin −7.37 1.50 24.12 14.07 17.06 12.82 苯醚甲环唑 Difenoconazole −36.68 −22.69 4.08 −9.47 −2.04 14.99 表 4 以混合茶为代表基质时6类茶叶中15种农药检测过程中产生的基质效应比较
Table 4 Matrix effects generated in detecting 15 pesticides in 6 types of tea with mixed tea used as a representative matrix
农药名称
Pesticide name基质效应 ME/% 绿茶
Green tea红茶
Black tea花茶
Scented tea黑茶
Dark tea白茶
White tea乌龙茶
Oolong绝对平均值
Absolute mean敌敌畏 Dichlorvos −26.54 −4.62 −21.14 −7.91 −2.00 0.13 10.39 甲拌磷 Phorate −31.54 −7.56 −20.18 11.15 0.73 3.33 12.41 五氯硝基苯 Pentachloronitrobenzene −4.26 −19.86 −5.49 −9.07 −3.37 4.01 7.68 毒死蜱 Chlorpyrifos −6.62 −12.19 −7.30 −20.63 −1.45 4.01 8.70 马拉硫磷 Malathion −18.27 0.98 −9.00 3.60 6.37 3.16 6.90 杀螟硫磷 Fenitrothion −13.33 −4.13 −7.92 0.09 −4.73 4.24 5.74 甲基异柳磷 Isofenphos-methy −1.50 −14.45 −5.17 −4.24 −2.66 0.54 4.76 水胺硫磷 Isocarbophos −28.59 −17.63 −26.18 −13.29 −11.26 −4.39 16.89 腐霉利 Procymidone −1.23 −15.46 −4.09 8.62 −2.73 1.39 5.59 杀扑磷 Methidathion −48.09 27.31 −27.95 9.78 8.33 −7.07 21.42 联苯菊酯 Bifenthrin −6.75 −12.74 −6.03 0.42 −0.73 0.66 4.55 甲氰菊酯 Fenpropathrin −5.92 −6.60 −3.48 4.08 3.88 0.15 4.02 氯菊酯 Permethrin −13.88 −16.75 −14.96 −2.25 −5.82 −3.65 9.55 溴氰菊酯 Deltamethrin −22.58 −16.43 −15.17 3.73 −4.66 −2.17 10.79 苯醚甲环唑 Difenoconazole −29.29 11.68 −13.66 16.24 1.11 9.40 13.56 表 5 添加水平为0.10 mg·kg−1时4种农药在两种定量方式下的平均回收率(n=6)
Table 5 Average recovery rates of 4 pesticides under two quantitative methods at an addition level of 0.10 mg·kg−1(n=6)
茶叶种类
Tea types标液类型
Standard liquid type马拉硫磷
Malathion水胺硫磷
Isocarbophos溴氰菊酯
Deltamethrin苯醚甲环唑
Difenoconazole平均回收率
Average
recovery
rate/%相对标准
偏差
RSD/%平均回收率
Average
recovery
rate/%相对标准
偏差
RSD/%平均回收率
Average
recovery
rate/%相对标准
偏差
RSD/%平均回收率
Average
recovery
rate/%相对标准
偏差
RSD/%绿茶
Green tea绿茶基质标
Green tea substrate114.99 3.18 114.84 2.14 112.75 2.16 109.71 2.14 混合茶基质标
Mixed tea substrate107.76 4.11 96.41 2.46 93.09 1.63 105.14 3.93 花茶
Scented tea花茶基质标
Scented tea substrate90.47 3.46 101.03 1.57 85.54 4.95 89.7 2.46 混合茶基质标
Mixed tea substrate91.9 2.51 94.55 1.83 90.55 3.10 89.77 2.68 红茶
Black tea红茶基质标
Black tea substrate76.57 3.10 104.14 4.71 87.78 3.33 79.19 4.31 混合茶基质标
Mixed tea substrate85.24 4.84 102.04 2.97 91.25 4.83 85.29 5.61 黑茶
Dark tea黑茶基质标
Dark tea substrate84.03 2.56 106.34 3.79 80.54 2.96 96.53 1.83 混合茶基质标
Mixed tea substrate94.83 2.85 101.44 2.11 87.11 2.49 99.48 3.11 白茶
White tea白茶基质标
White tea substrate78.88 3.62 98.74 3.82 107.18 5.10 85.81 4.34 混合茶基质标
Mixed tea substrate80.58 5.12 104.62 4.15 105.03 2.61 88.65 2.77 乌龙茶
Oolong乌龙茶基质标
Oolong substrate86.46 3.94 107.9 3.21 80.18 2.27 75.81 3.27 混合茶基质标
Mixed tea substrate88.6 3.81 108.47 4.19 83.23 3.15 86.41 2.68 -
[1] 马佳丽, 王晨, 陈红平, 等. 注射器内分散固相萃取-超高效液相色谱-串联质谱法快速测定茶叶中24种农药残留 [J]. 茶叶科学, 2021, 41(5):717−730. DOI: 10.3969/j.issn.1000-369X.2021.05.011 MA J L, WANG C, CHEN H P, et al. Rapid determination of 24 pesticide residues in tea by in-syringe dispersive solid phase extraction-ultra high performance liquid chromatography-tandem mass spectrometry [J]. Journal of Tea Science, 2021, 41(5): 717−730. (in Chinese) DOI: 10.3969/j.issn.1000-369X.2021.05.011
[2] 刘佳, 赵昌燕, 蔡滔, 等. 贵州省不同产区茶叶中7种农药的基质效应评价 [J]. 现代农药, 2023, 22(2):66−69,75. LIU J, ZHAO C Y, CAI T, et al. Matrix effect analysis of seven pesticide residues in tea from Guizhou Province [J]. Modern Agrochemicals, 2023, 22(2): 66−69,75. (in Chinese)
[3] 陈廷春, 林思思, 罗贵文, 等. 不同蔬菜品种中基质效应对5种杀虫剂农药残留检测影响的对比试验 [J]. 农业科技通讯, 2020, (9):159−162. DOI: 10.3969/j.issn.1000-6400.2020.09.052 CHEN T C, LIN S S, LUO G W, et al. Comparative experiment on the influence of matrix effect on the detection of pesticide residues of five pesticides in different vegetable varieties [J]. Bulletin of Agricultural Science and Technology, 2020(9): 159−162. (in Chinese) DOI: 10.3969/j.issn.1000-6400.2020.09.052
[4] 许炳雯, 孙程鹏, 葛祥武, 等. 气相色谱-串联质谱法测定30种果蔬中61种农药的基质效应及其克服方式 [J]. 食品安全质量检测学报, 2021, 12(15):6068−6076. XU B W, SUN C P, GE X W, et al. Matrix effects and their countermeasures of 61 kinds of pesticides in 30 kinds of fruits and vegetables by gas chromatography-tandem mass spectrometry [J]. Journal of Food Safety & Quality, 2021, 12(15): 6068−6076. (in Chinese)
[5] 朱作为, 张文中, 陈沙, 等. 气相色谱-三重四极杆串联质谱法测定大米、韭菜、茶叶3种基质中51种农药残留的研究 [J]. 食品安全质量检测学报, 2018, 9(6):1297−1307. DOI: 10.3969/j.issn.2095-0381.2018.06.012 ZHU Z W, ZHANG W Z, CHEN S, et al. Determination of 51 kinds of pesticide residues in 3 kinds of substrates(rice, garlic chives and tea) by gas chromatography-tandem mass spectrometry [J]. Journal of Food Safety & Quality, 2018, 9(6): 1297−1307. (in Chinese) DOI: 10.3969/j.issn.2095-0381.2018.06.012
[6] 刘继才, 林芳, 王建山, 等. QuEChERS-超高效液相色谱-串联质谱法测定桑叶中64种农药残留 [J]. 食品安全质量检测学报, 2021, 12(3):1048−1056. LIU J C, LIN F, WANG J S, et al. Determination of 64 kinds of pesticide residues in mulberry leaves by QuEChERS combined with ultra performance liquid chromatography-tandem mass spectrometry [J]. Journal of Food Safety & Quality, 2021, 12(3): 1048−1056. (in Chinese)
[7] 何冲, 孙亚南, 王彬, 等. 水果蔬菜中多种农药残留基质效应探讨 [J]. 食品工业, 2022, 43(12):104−106. HE C, SUN Y N, WANG B, et al. Research on matrix effects of mutiple pesticede residues in africultural products [J]. The Food Industry, 2022, 43(12): 104−106. (in Chinese)
[8] 蔡振辉. QuEChERS结合GC-MS/MS检测食用菌中20种有机磷农药的基质效应 [J]. 亚热带农业研究, 2022, 18(2):136−141. CAI Z H. Matrix effect of 20 kinds of organophosphorus pesticides in edible fungi by GC-MS/MS combined with QuEChERS [J]. Subtropical Agriculture Research, 2022, 18(2): 136−141. (in Chinese)
[9] 张圆圆, 刘磊, 李娜, 等. 农药残留检测中不同蔬菜的基质效应 [J]. 农药学学报, 2019, 21(3):327−337. ZHANG Y Y, LIU L, LI N, et al. Matrix effects in pesticide residue analysis in various vegetable samples [J]. Chinese Journal of Pesticide Science, 2019, 21(3): 327−337. (in Chinese)
[10] 侯雪, 易盛国, 韩梅, 等. 串联质谱法检测洋葱中36种例行监测农药及其基质效应的探讨 [J]. 现代科学仪器, 2012, (4):115−118. HOU X, YI S G, HAN M, et al. Study on detection and matrix effects of 36 routine monitoring pesticides in onion by gas chromatography-tandem mass spectrometry [J]. Modern Scientific Instruments, 2012(4): 115−118. (in Chinese)
[11] 靳雅楠, 魏昭, 贾红霞, 等. 农药残留检测中基质效应的研究 [J]. 食品安全导刊, 2022, (28):172−174. DOI: 10.3969/j.issn.1674-0270.2022.28.spaqdk202228057 JIN Y N, WEI Z, JIA H X, et al. Study of matrix effects in pesticide residue detection [J]. China Food Safety Magazine, 2022(28): 172−174. (in Chinese) DOI: 10.3969/j.issn.1674-0270.2022.28.spaqdk202228057
[12] 梁宜品. 蔬菜农药残留检测基质效应消除方法 [J]. 现代农村科技, 2022, (8):92. DOI: 10.3969/j.issn.1674-5329.2022.08.062 LIANG Y P. Elimination method of matrix effect in detection of pesticide residues in vegetables [J]. Modern Agricultural Science and Technology, 2022(8): 92. (in Chinese) DOI: 10.3969/j.issn.1674-5329.2022.08.062
[13] 鲍忠赞, 邓昭浦. 气相色谱法检测果蔬中30种有机磷类农药残留的基质效应 [J]. 湖北农业科学, 2019, 58(20):152−156. BAO Z Z, DENG Z P. Matrix effects on GC determination of 30 organophosphorus pesticides residues in fruits and vegetables [J]. Hubei Agricultural Sciences, 2019, 58(20): 152−156. (in Chinese)
[14] 封利会, 王硕, 安阳, 等. 分散固相萃取-气相色谱串联质谱法测定花类代用茶中的48种农药残留 [J]. 食品科技, 2021, 46(5):265−271. FENG L H, WANG S, AN Y, et al. Determination of 48 pesticides in flower substitute tea by dispersive solid-phase extraction and GC-MS/MS [J]. Food Science and Technology, 2021, 46(5): 265−271. (in Chinese)
[15] 黄松, 宋安华, 陈穗, 等. QuEChERS-气相色谱-串联质谱法测定油麦菜中农药多残留的基质效应 [J]. 食品安全质量检测学报, 2019, 10(12):3863−3868. DOI: 10.3969/j.issn.2095-0381.2019.12.038 HUANG S, SONG A H, CHEN S, et al. Determination of matrix effects of pesticide multi-residues in lettuces by QuEChERS-gas chromatography-tandem mass spectrometry [J]. Journal of Food Safety & Quality, 2019, 10(12): 3863−3868. (in Chinese) DOI: 10.3969/j.issn.2095-0381.2019.12.038
[16] 许洋, 叶善蓉, 唐祥凯, 等. 分散固相萃取-气相色谱-串联质谱法同时测定稻谷中三种烯虫酯类保幼激素类似物残留 [J]. 中国测试, 2023, 49(1):57−62. XU Y, YE S R, TANG X K, et al. Simultaneous determination of three methoprene juvenile hormone analogues in paddy by dispersive solid-phase extraction combined with gas chromatography-mass spectrometry [J]. China Measurement & Test, 2023, 49(1): 57−62. (in Chinese)
[17] 罗小娇, 魏新琦, 田翠, 等. 基于QuEChERS-气相色谱串联质谱法的43种农药残留基质效应研究 [J]. 现代农业科技, 2023, (7):85−87,90. LUO X J, WEI X Q, TIAN C, et al. Matrix effect of 43 pesticide residues based on QuEChERS-gas ChromatographyTandem mass spectrometry [J]. Modern Agricultural Science and Technology, 2023(7): 85−87,90. (in Chinese)
[18] 易盛国, 侯雪, 韩梅, 等. 气相色谱-串联质谱法检测蔬菜农药残留基质效应与基质分类的研究 [J]. 西南农业学报, 2012, 25(2):537−543. DOI: 10.3969/j.issn.1001-4829.2012.02.038 YI S G, HOU X, HAN M, et al. Study on matrix effects and matrix classification of pesticide residues in vegetable by gas chromatography-tandem mass spectrometry [J]. Southwest China Journal of Agricultural Sciences, 2012, 25(2): 537−543. (in Chinese) DOI: 10.3969/j.issn.1001-4829.2012.02.038
[19] 方海仙, 耿慧春, 梅文泉, 等. 气相色谱法测定农产品中农药残留的基质效应研究 [J]. 食品安全质量检测学报, 2018, 9(14):3770−3779. FANG H X, GENG H C, MEI W Q, et al. Study on matrix effect of determination of pesticide residues in agricultural products by gas chromatography [J]. Journal of Food Safety & Quality, 2018, 9(14): 3770−3779. (in Chinese)
[20] 鲍忠赞. 气相色谱法探究果蔬中有机氯和拟除虫菊酯类农药残留的基质效应 [J]. 农药, 2018, 57(12):890−894. BAO Z Z. Matrix effects of organochlorine and pyrethroid pesticides in fruits and vegetables using gas chromatography [J]. Agrochemicals, 2018, 57(12): 890−894. (in Chinese)




 下载:
下载: