High-throughput Sequencing on Microbial Community in Rhizosphere Soil of Chinese Narcissus
-
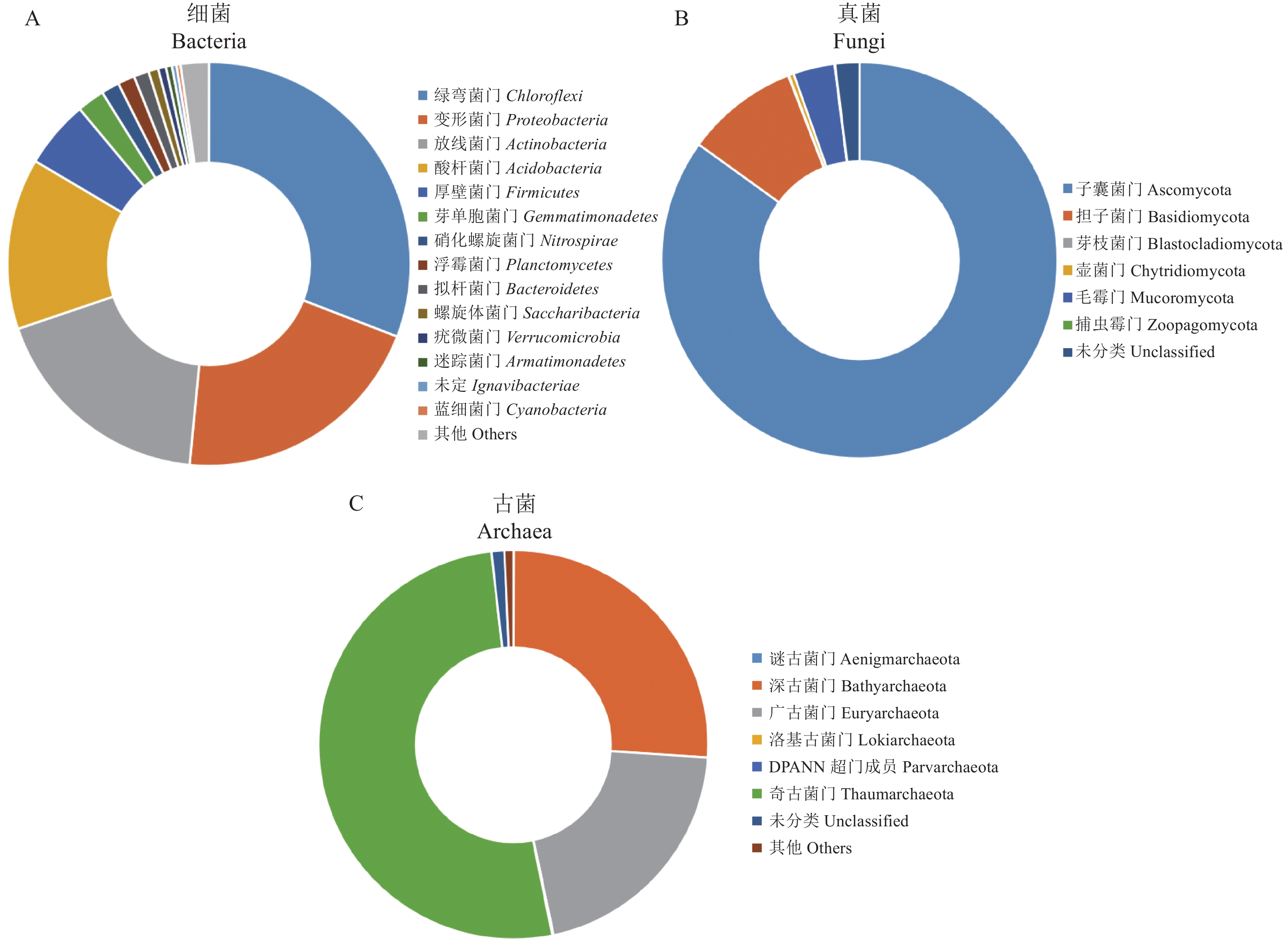
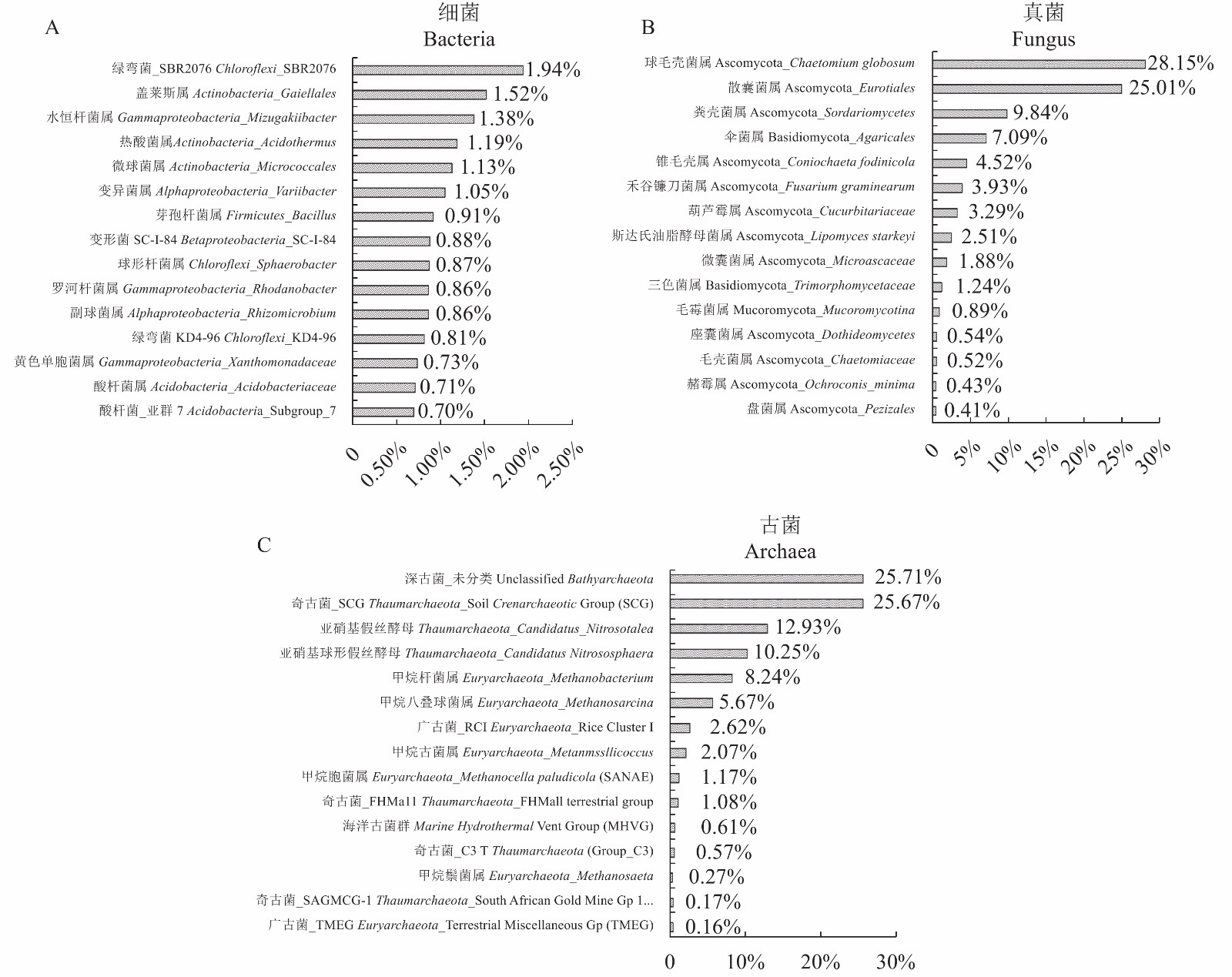
摘要:目的 明确中国水仙植株根际土壤微生物群落的组成特征。方法 采用Illumina Miseq高通量测序技术对水仙根际土壤微生物样品的保守基因区进行测序及生物信息学分析,阐明中国水仙根际土壤的细菌、真菌和古菌群落结构组成,并对水仙根际土壤微生物的优势菌属进行深入分析。结果 共获得优化序列175 840条,基于97%序列相似度,聚类为2 680个OTUs。优势细菌类群是绿弯菌门 Chloroflexi(30.86%)和变形菌门 Proteobacteria(20.67%),真菌以子囊菌门 Ascomycota(84.94%)为主,属水平上球毛壳菌 Chaetomium globosum(28.15%)和散子囊菌 Eurotiales(25.01%)占较高比例。古菌类群主要为奇古菌门 Thaumarchaeota(51.40%)、深古菌门 Bathyarchaeota(25.98%)和广古菌门 Euryarchaeota(20.65%)。其中,来自奇古菌门的SCG类群(25.67%)和嗜酸性氨氧化古菌 Candidatus_Nitrosotalea(12.93%)占较高比例。结论 中国水仙根际土壤微域具有丰富多样的微生物类群,这对于开发和利用水仙根际土壤微生物资源具有重要意义。Abstract:Objective The microbial community in rhizosphere soils of Chinese narcissuses was analyzed.Method The Illumina Miseq high-throughput sequencing technology was used to obtain the relevant conserved gene regions of the microbes in soil specimens from Chinese narcissus planting lots. The community structures and distributions of dominant species of bacteria, fungi, and archaea in the rhizosphere soils were analyzed.Result In total, 175 840 optimized sequences were obtained and clustered from the specimens into 2 680 representative OTUs with a 97% similarity. The dominant bacteria were Chloroflexi (30.86%) and Proteobacteria (20.67%). Among the fungi, Ascomycota (84.94%) significantly overshadowed the others, with Chaetomium globosum (28.15%) and Ascomycetes (25.01%) accounted for the greater proportions. On archaea, Thaumarchaeota (51.40%), Bathyarchaeota (25.98%), and Euryarchaeota (20.65%) were the major phyla that had 25.67% SCG and 12.93% acidophilic ammonia oxidizing members.Conclusion The rhizosphere soils of Chinese narcissuses harbored diverse and rich microbial species. The information obtained would aid the development and utilization of the natural resources.
-
Keywords:
- Chinese narcissuses /
- rhizosphere soil microorganisms /
- high-throughput sequencing /
- bacteria /
- fungi /
- archaea
-
茶树修剪是通过人为剪除部分枝条,改变茶树自然生长的分枝习性,使树冠向外围空间伸展,促进营养生长,塑造理想树形,并去除顶端优势,增加芽叶萌发,延长茶树经济年龄的一种通用方法[1]。修剪对茶树养分分配,根、茎比平衡,鲜叶生化成分等均会产生重要影响[2]。对以采摘嫩芽叶为主要经济目标的人工生态系统,茶园修剪枝叶往往作为废弃物而未引起足够重视,尤其在茶园生态系统中的服务功能与作用更鲜见研究报道。茶树经人为修剪后枝叶自动凋落而覆盖地表,故可借鉴生态系统“凋落物”的概念,对茶园生态系统凋落物的生态服务功能进行研究。
凋落物(Litter)又称枯落物或有机碎屑,是指生态系统内由地上植物组分产生并归还到地表,作为分解者的物质和能量来源,借以维持生态系统功能的所有有机质的总称[3-4]。凋落物的存在不仅可以减少对土壤的溅击侵蚀,亦能阻滞地表径流对土壤的冲蚀;还可促进土壤和大气之间的水分交换,有利于保持水分,减少地表蒸发,因而具有水土保持与水源涵养的功能[5]。同时凋落物的分解对生态系统的物质循环和养分平衡方面作用亦不小觑[6]。在茶园方面,吕文等[7]研究发现3、4年生茶树经修剪后的蒸散速率均大幅下降,分别降低了36.73%、48.32%,其原因不仅与茶株高度降低,导致界面层导度减小,减少水分从茶株向大气的传输有关。且与茶园经修剪后,凋落的枝、叶覆盖在茶行间,增加了行间的土壤遮蔽,降低了土壤的蒸发作用有关。由此可知,修剪能对茶园生态系统的水文功能产生一定影响。
日前鲜见有关茶园修剪枝叶作为凋落物,对其所具备生态水文功能的研究与报道。因此,本研究借鉴生态系统凋落物的概念,探讨不同修剪模式对茶树修剪枝、叶的产生量;并采用室内持水模拟试验对其持水特性进行研究,旨在揭示不同修剪模式茶树修剪凋落物及其组分的持水特性与拦蓄能力,以期为茶园生态系统水土保持、水源涵养功能的定量化研究与评估提供理论基础和科学依据。
1. 材料与方法
1.1 试验地概况
试验茶园位于福建省福安市社口镇,福建省农业科学院茶叶研究所2号山,地处119°34′E、27°13′N,属丘陵坡地,海拔约70 m,年无霜期285 d,年均降雨量1 646 mm,年均气温19.3℃,为典型的中亚热带季风气候。
1.2 试验设计
供试茶树品种黄观音,树龄14年,种植密度约55 000株·hm-2,树高约110 cm,树幅60 cm × 80 cm,生长较均匀一致。试验按照茶园惯用修剪方式,设不同修剪深度处理3个,分别为重度修剪(树冠面下约20 cm处平剪)、中度修剪(15 cm处平剪)和轻度修剪(7 cm处平剪)处理。每处理小区长为12 m、面积约15 m2,3个区组重复。修剪机具为单人修剪机(川崎牌PST80H)。
1.3 试验方法
1.3.1 修剪枝生物量统计
采用人工分拣,将每处理小区修剪枝收集完全,称重,计算生物量鲜重(fresh weight,FW);随后将一部分修剪物,分离枝、叶,统计枝叶比;并放置室内自然风干,风干时称重,计算自然含水率(Ro);将各小区自然风干后的枝、叶,分别置于80℃恒温干燥箱内烘干至恒重,称重,计算含水率和生物量干重(dry weight,DW),并换算成1 hm2茶园的修剪枝生物量。
1.3.2 修剪物持水特性测定
分别扦取一定量3个修剪处理的茶树枝叶,称重后装入15 cm×30 cm的尼龙网袋,进行0.5、1、1.5、2、4、6、8、10、12、16、24 h浸水处理,随后取出,静止5 min至修剪枝叶不滴水时分别称重,计算修剪枝叶不同浸水时间的持水量、持水率与吸水速率[8-9]。借鉴森林凋落物水文特征相关计算公式[10-13],进行茶树修剪凋落物持水特性、拦蓄能力的相关计算。
持水率R/%=[(浸泡t时间的凋落物重Wt-凋落物烘干重W0)/凋落物烘干重W0] ×100%
持水量Q/(t·hm-2)= 凋落物现存量M×凋落物持水率R
吸水速率V1/(g·g-1·h-1)=(浸泡时间的凋落物重Wt-凋落物烘干重W0)/(凋落物烘干重W0×浸泡时间t)
最大持水率Rm/%= 凋落浸泡24 h中最大持水率Rx
最大持水量Q/(t·hm-2)= 最大持水率Rm×凋落物现存量M
最大拦蓄率Lr/% = 最大持水率Rm-自然含水率R0
最大拦蓄量L/(t·hm-2)= 最大拦蓄率Lr×凋落物现存量M
有效拦蓄率W/% = 0.85Rm-自然含水率R0
有效拦蓄量L2/(t·hm-2)= 有效拦蓄率W×凋落物现存量M
1.4 数据分析
数据经Excel 2010处理;采用SPSS 22.0中单因素方差分析(One-Way ANOVA)的LSD(Least significant difference)法进行显著性分析;Origin Pro 8.5.1软件作图。
2. 结果与分析
2.1 不同修剪深度对茶树修剪凋落物生物量的影响
由表 1可知,不同修剪深度处理的修剪枝叶生物量,无论是总量、叶、枝的鲜重(FW),还是总量、叶、枝的干重,均表现为重度修剪>中度修剪>轻度修剪,其总量、叶、枝的鲜重,3个处理间的差异均达到显著水平,而总量、叶、枝的干重,处理间的差异,表现为轻度修剪与中度修剪、重度修剪之间差异显著,而中度修剪与重度修剪之间却无显著差异。在生物重构成上,鲜重和干重均表现为叶>枝,其中叶鲜重占比为65.27%~75.82%,叶干重占比降为62.24%~70.86%;枝叶干重仅为鲜重的33.62%~39.09%;茶枝修剪物烘干后,叶枝比值下降明显,降幅达12.23%~22.36%,且有随修剪深度的增大而下降的趋势,这与不同深度修剪枝叶的含水量差异有关,修剪深度越深,修剪枝叶的平均含水率越低。
表 1 不同修剪深度对茶树修剪枝叶生物量的影响Table 1. Biomass of leaf- and stem-clippings produced by various pruning practices处理 生物量-鲜重/(t·hm-2) 生物量-干重/(t·hm-2) 含水率
/%总量 叶 枝 叶/枝比 总量 叶 枝 叶/枝比 轻度修剪 4.59±0.07a 3.48±0.18a 1.11±0.18a 3.13±0.71 1.75±0.02a 1.24±0.04a 0.51±0.04a 2.43±0.27 66.38±5.27 中度修剪 6.48±0.05b 4.45±0.07b 2.03±0.07b 2.19±0.11 2.38±0.02b 1.53±0.04b 0.85±0.04b 1.80±0.12 63.25±0.25 重度修剪 7.40±0.01c 4.83±0.09c 2.57±0.09c 1.88±0.10 2.49±0.38b 1.55±0.03b 0.94±0.03b 1.65±0.08 61.91±0.55 注:同列不同小写字母表示不同处理间存在显著性差异(P< 0.05)。 2.2 不同修剪深度对茶树修剪凋落物及其组分持水能力的影响
2.2.1 持水率
3种修剪处理的修剪凋落物及其组分的持水率均随浸水时间的延长而呈增加趋势,尤以前4 h增加迅速,随后增势趋缓(图 1)。修剪凋落物混合样及其组分的最大持水率表现为:中度修剪(121.33%)>重度修剪(113.69%)>轻度修剪(106.16%);叶>枝,其中叶的平均最大持水率为137.47%,分别是混合组分和枝的平均最大持水率的1.2倍和1.49倍。由此可知,叶在修剪物组分中的持水能力最大,其分别是对应混合组分的1.14~1.34倍;而枝条的持水率较小,仅为对应混合组分的0.79~0.81倍。
2.2.2 持水量
由图 2可知,不同修剪处理凋落物及其组分的持水量变化趋势与持水率相一致,均随时间延长而呈增加趋势,尤其在前2 h内增加迅速,2 h后变化趋缓。3种修剪处理的混合组分饱和时间约在16 h;3处理修剪枝叶及其组分的最大持水量表现为:中度修剪(2.89 t·hm-2)>重度修剪(2.83 t·hm-2)>轻度修剪(1.86 t·hm-2),混合枝叶>叶>枝,枝条的持水量最少,且增幅较小。由此可见,枝叶比及其老嫩程度、生物量、持水率高低对其持水能力影响较大。
2.2.3 吸水速率
由图 3可知,3个处理凋落物各组分吸水速率的变化,表现为前0.5 h内最大,随后呈急剧下降趋势,至4 h后,下降趋势渐趋平缓,随时间延长变化趋于一致。3个处理的凋落物及其组分的最大吸水速率均表现为:叶>叶枝混合>枝,其中叶的平均最大吸水速率2.14 g·g-1·h-1,分别为枝叶混合的1.27倍、枝的1.95倍。同一组分不同处理的最大吸水速率,表现出明显差异,其中混合组为:中度修剪(1.78 g·g-1·h-1)>重度修剪(1.70 g·g-1·h-1)>轻度修剪(1.59 g·g-1·h-1); 叶组分: 轻度修剪(2.18 g·g-1·h-1)>中度修剪(2.13 g·g-1·h-1)>轻度修剪(2.12 g·g-1·h-1);枝条组分:中度修剪(1.28 g·g-1·h-1)>重度修剪(1.05 g·g-1·h-1)>轻度修剪(0.97 g·g-1·h-1)。
2.3 不同修剪深度下茶树修剪凋落物及其组分的拦蓄能力
2.3.1 修剪凋落物的拦蓄能力
研究结果(表 2)表明,3处理下的茶树修剪凋落物对降雨的拦蓄能力不同,其中混合组分的最大拦蓄率(量)及有效拦蓄率(量)均表现为:中度修剪>重度修剪>轻度修剪,而枝或叶组分不同处理间的变化不明朗。不同修剪处理下凋落物及其组分的最大持水量(率)>最大拦蓄量(率)>有效拦蓄量(率),其中中度修剪处理的单次修剪凋落物的有效拦蓄量为2.19 t·hm-2,分别比最大持水量、最大拦蓄量下降了24.22%和16.41%;同样,重度修剪的有效拦蓄量分别下降了24.03% 和9.19%,轻度修剪的有效拦蓄量分别下降了25.27%和10.75%。
表 2 不同深度下茶树修剪凋落物及其组分对降雨拦蓄能力的比较Table 2. Flood-intercepting capacity of litter from various pruning practices浸水时间 轻度修剪 中度修剪 重度修剪 叶 枝 混合 叶 枝 混合 叶 枝 混合 最大持水率R/% 141.98 83.97 106.16 138.12 99.29 121.33 132.32 92.64 113.69 最大持水量Q/(t·hm-2) 1.76 0.43 1.86 2.11 0.84 2.89 2.05 0.87 2.83 最大拦蓄率Lr/%t 133.71 77.60 95.12 130.83 92.58 110.12 124.22 84.67 103.41 最大拦蓄量L/(t·hm-2) 1.66 0.40 1.66 2.00 0.79 2.62 1.93 0.8 2.57 有效拦蓄率W/% 112.41 65.01 79.19 110.11 77.68 91.92 104.37 70.77 86.35 有效拦蓄量L2/(t·hm-2) 1.39 0.33 1.39 1.68 0.66 2.19 1.62 0.67 2.15 2.3.2 修剪凋落物各组分的蓄水能力
由表 2看出,不同修剪处理下凋落物枝、叶组分对降雨的拦蓄能力不同。3种修剪处理下叶组分凋落物最大持水量、最大拦蓄量、有效拦蓄量表现为:中度修剪>重度修剪>轻度修剪;而最大持水率、最大拦蓄率、有效拦蓄率均表现为:轻度修剪>中度修剪>重度修剪。枝条组分则与之不同,其最大持水率、最大拦蓄率、有效拦蓄率表现为:中度修剪>重度修剪>轻度修剪,最大持水量、最大拦蓄量、有效拦蓄量为:重度修剪>中度修剪>轻度修剪。不同处理下凋落物及其组分的最大持水率、最大拦蓄率及有效拦蓄率均表现为:叶>混合>枝,其凋落物组分的最大持水量、最大拦蓄量及有效拦蓄量均呈现叶占比最大,枝次之。由此可说明凋落物中以叶组分对降雨的拦蓄能力最强。
3. 讨论与结论
陆地植被生态系统中凋落物对截持降水、防止土壤溅蚀、阻延地表径流、抑制土壤水分蒸发、增强土壤抗冲效能等方面都具有非常重要的意义[14-15]。另有研究表明,修剪不仅是茶树培育树冠的一项重要农艺措施,还可使昆虫失去部分栖息地,对采食嫩芽叶的病虫害有一定的抑制作用[16]。但作为修剪凋落物本身其所具有的生态水文功能则一直被忽略。
本研究表明,3种修剪处理下凋落物生物量(DW)为1.75~2.49 t·hm-2,仅为鲜重的33.62%~39.09%。若以轻度修剪每年2次计算,则由修剪产生的凋落物的生物量约为3.5 t·hm-2,加上茶树生长过程中自然形成的凋落物,而其实际生物量应略大。然而,由于茶园生态系统人为干扰强烈其现存量应低于两者之和,因此仍远小于森林生态系统凋落物的产生量。如远低于15年生马占相思林和湿地松林的年凋落量(11.14、7.30 t·hm-2)[17];低于同气候带处于顶级群落演替阶段的木荷、细柄阿丁枫、浙江桂、观光木林等(5.96~7.22 t·hm-2),接近于杉木人工林(3.47、4.82 t·hm-2)[12, 18];与苦竹林、慈竹林、撑绿杂交竹林、苦竹+光皮桦混交林等人工林的凋落物蓄积量(0.95~2.21 t·hm-2)大致相当[19],其差异主要与植被类型及树种组分、植被密度、树龄、水热条件不同有关。
当前研究表明凋落物的现存量、分解状态及持水性能对生态系统含蓄水源的功能具有重要影响。本研究发现,3个不同深度修剪的凋落物混合样的最大持水率表现为:中度修剪(121.33%)>重度修剪(113.69%)>轻度修剪(106.16%),且均以叶组分的持水率最大,其平均最大持水率为137.47%,是混合枝叶组分平均最大持水率的1.2倍,枝的1.49倍。该结果与前人研究规律一致[12, 20]。但其混合枝叶组分持水率小于同气候带的6种天然林枯落物最大持水率(159.34%~196.02%),接近浙江桂(159.34%)[18];亦小于亚热带阔叶林(158%~309%)[20]和温带森林(265.19%~525.36%)[11];与6年生桉树人工林叶、枝最大持水率(139.99%、66.21%)[21]相当。
本研究表明,凋落物持水作用主要表现在降雨前期的2 h内,特别是前30 min,这一结果与前人研究一致[12, 19, 22]。3种修剪深度的凋落物及其组分的最大吸水速率均表现为:叶>混合>枝,这一结果与其持水率较为一致。各组分的最大持水量均表现为:混合>叶>枝,混合组分最大持水量以中度修剪为大、其次为重度修剪与轻度修剪(1.86~2.89 t·hm-2)。该结果小于杉木人工林(4.24~11.60 t·hm-2)[12],远小于亚热带阔叶林(13.37~17.71 t·hm-2)[23],接近同属亚热带的3种人工林(3.3~6.8 t·hm-2)[24],差异原因主要与植被类型、生物量、凋落物组分持水特性有关。
不同修剪程度的茶树修剪物对降雨的拦蓄能力不同。本研究表明,3种处理下混合组分的最大拦蓄率(95.12%~110.12%),有效拦蓄率(79.19%~91.91%)。与彭玉华等[13]报道的5种植被类型凋落物的最大拦蓄率(95.13%~147.49%),有效拦蓄率(75.41%~122.77%)相当。混合组分的最大持水量、最大拦蓄量及有效拦蓄量均表现为:中度修剪>重度修剪>轻度修剪。中度修剪下的单次修剪凋落物的有效拦蓄量(2.19 t·hm-2),比最大持水量、最大拦蓄量分别下降24.22%和16.41%,小于同气候带杉木林的最大拦蓄量(3.44~9.92 t·hm-2),介于有效拦蓄量(1.88~5.93 t·hm-2)[12],远小于彭华等[13]报道的植被类型最大拦蓄量(377.55~520.62 t·hm-2)和有效拦蓄量(313.54~430.74 t·hm-2)。本研究表明茶园生态系统凋落物的拦蓄降水能力明显小于森林生态系统,两者相差悬殊主要为各自生态系统内的凋落物现存量及及持水率差别巨大所致。
生产茶园内的茶树每年都要进行1~3次修剪,考虑茶树枝叶自然凋落的存在茶园实际凋落物及其蓄水能力要大于单纯修剪凋落物的统计量,加之凋落物存在自然分解过程其持水特性非恒定,故有关人为管理导致的茶树凋落物分解与养分循环、生态水文功能的动态变化还有待进一步深入研究。在茶树修剪凋落物组分中,叶组分由于其生物学特性及生物量占比较大等原因,成为茶园生态系统凋落物中涵养水源功能的主要承担者。本研究仅从单一凋落物的生态水文功能角度分析,表明茶园生态系统凋落物所具备的生态水文功能弱于森林生态系统,这与茶园人工生态系统存在较强的水土流失现象相一致。尤其对于新建茶园,在合理选择栽植方式外(如:等高条栽),应加强水土保持的生态(如生草覆盖)和工程技术措施(设置缓路横沟、等高梯层、外埂内沟,保持梯面适度内倾等)。
此外,从土地利用类型对生态服务功能影响角度出发,植被类型由林/灌丛地转变为茶园降低了地表覆盖度、凋落物现存量及持水量,其必然对生态系统的水土保持、水源涵养的功能产生显著及长期影响。因此,在规划茶叶种植时不应盲目增加种植面积,而应进行经济和生态效益的均衡考虑。
-
表 1 中国水仙根际土壤微生物高通量测序数据及其多样性指数
Table 1 Summarized high-throughput sequences and diversity index of microorganisms in Chinese narcissus rhizosphere soil
微生物类型
Microorganism
Type测序序列数
Total sequence
number平均序列长度
Mean
length/bpOTUs
(97%)代表
OTUsChao
指数Ace
指数香农均匀度
Shannon
evenness辛普森均匀度
Simpson
evenness香农多样性指数
Shannon
diversity index辛普森多样性指数
Simpson
diversity index细菌 Bacteria 39 188 413.7 29 447 2 453 3 089 3 133 0.845 0 0.125 8 6.595 8 0.003 2 真菌 Fungi 66 216 381.8 49 162 109 109 109 0.523 8 0.056 6 2.455 1 0.162 0 古菌 Archaea 70 436 428.5 44 517 118 118 118 0.544 2 0.078 6 2.596 6 0.107 8 -
[1] CHAPARRO J M, BADRI D V, VIVANCO J M. Rhizosphere microbiome assemblage is affected by plant development [J]. ISME Journal, 2014, 8(4): 790−803. DOI: 10.1038/ismej.2013.196
[2] MENDES R, GARBEVA P, RAAIJMAKERS J M. The rhizosphere microbiome: Significance of plant beneficial, plant pathogenic, and human pathogenic microorganisms [J]. FEMS Microbiology Reviews, 2013, 37(5): 634−663. DOI: 10.1111/1574-6976.12028
[3] BARDGETT R D, CARUSO T. Soil microbial community responses to climate extremes: Resistance, resilience and transitions to alternative states [J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2020, 375(1794): 20190112. DOI: 10.1098/rstb.2019.0112
[4] 王鑫鑫, 杨珍珍, 周婉柔, 等. 水仙根围细菌群落组成 [J]. 微生物学通报, 2017, 44(5):1081−1088. WANG X X, YANG Z Z, ZHOU W R, et al. Identification of rhizosphere bacterial communities of Narcissus tazetta [J]. Microbiology China, 2017, 44(5): 1081−1088.(in Chinese)
[5] 杨明俊, 李娟, 王永刚, 等. 水仙内生真菌的分离鉴定及聚类分析 [J]. 中草药, 2014, 6(11):1625−1630. YANG M J, LI J, WANG Y G, et al. Isolation and cluster analysis of endophytic fungi in Narcissus tazetta var. chinensis [J]. Chinese Herbal Medicines, 2014, 6(11): 1625−1630.(in Chinese)
[6] RYU C M, FARAG, MOHAMED A, et al. Bacterial volatiles promote growth in Arabidopsis [J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(8): 4927−4932. DOI: 10.1073/pnas.0730845100
[7] MENDES R, KRUIJT M, DE BRUIJIN I, et al. Deciphering the Rhizosphere Microbiome for Disease-Suppressive Bacteria [J]. Science, 2011, 332(6033): 1097−1100. DOI: 10.1126/science.1203980
[8] HU J, WEI Z, FRIMAN V P, et al. Probiotic diversity enhances rhizosphere microbiome function and plant disease suppression [J]. American Society for Microbiology, 2016, 7(6): e01790−16.
[9] 黄秋斌, 张颖, 刘凤英, 等. 蜡样芽孢杆菌B3-7在大田小麦根部的定殖动态及其对小麦纹枯病的防治效果 [J]. 生态学报, 2014, 34(10):2559−2566. HUANG Q B, ZHANG Y, LIU F Y, et al. Colonization dynamics of Bacillus cereus B3-7 on wheat roots and control efficiency against sharp eyespot of wheat [J]. Acta Ecologica Sinica, 2014, 34(10): 2559−2566.(in Chinese)
[10] 杨光柱, 黄文静, 李云国, 等. 苹果根腐病根际土壤真菌组成及多样性研究 [J]. 果树学报, 2020, 37(6):875−881. YANG G Z, HUANG W J, LI Y G, et al. Fungal community and diversity in rhizospheric soil with root rot in an apple orchard [J]. Journal of Fruit Science, 2020, 37(6): 875−881.(in Chinese)
[11] 李得铭, 翟子翔, 邓涛, 等. 番茄青枯菌分离与三重PCR体系建立 [J]. 分子植物育种, 2020, 18(11):209−215. LI D M, ZHAI Z X, DENG T, et al. Isolation of ralstonia solanacearum and establishment of triple PCR system [J]. Molecular Plant Breeding, 2020, 18(11): 209−215.(in Chinese)
[12] BACH E M, WILLIAMS R J, HARGREAVES S K, et al. Greatest soil microbial diversity found in micro-habitats [J]. Soil Biology and Biochemistry, 2018, 118: 217−226. DOI: 10.1016/j.soilbio.2017.12.018
[13] 钱宝, 刘凌, 肖潇. 土壤有机质测定方法对比分析 [J]. 河海大学学报(自然科学版), 2011, 39(1):34−38. QIAN B, LIU L, XIAO X. Comparative tests on different methods for content of soil organic matter [J]. Journal of Hohai University (Natural Sciences Edition), 2011, 39(1): 34−38.(in Chinese)
[14] 马丹. 凯氏定氮法测定食品中蛋白质含量 [J]. 计量与测试技术, 2008, 35(6):57−58. DOI: 10.3969/j.issn.1004-6941.2008.06.030 MA D. Kjeldahl determination of protein content [J]. Measurement and Testing Technology, 2008, 35(6): 57−58.(in Chinese) DOI: 10.3969/j.issn.1004-6941.2008.06.030
[15] 叶祥盛, 赵竹青. 流动注射法与碱解扩散法测定土壤有效氮的比较 [J]. 安徽农业科学, 2011, 20:12166−12167, 12178. DOI: 10.3969/j.issn.0517-6611.2011.20.073 YE X S, ZHAO Z Q. Comparison of soil available nitrogen concentration between flow injection method and alkali-diffusion method [J]. Journal of Anhui Agricultural Sciences, 2011, 20: 12166−12167, 12178.(in Chinese) DOI: 10.3969/j.issn.0517-6611.2011.20.073
[16] BOWMAN R A, COLE C V. An exploratory method for fractionation of organic phosphorus from grassland soils [J]. Soil science, 1978, 125(2): 95−101. DOI: 10.1097/00010694-197802000-00006
[17] SIMARD R R. Ammonium acetate-extractable elements. In Soil sampling and methods of analysis[M]. Lewis Publisher: Boca Raton, FL, USA, 1993(1): 39-42.
[18] MEIER L P, KAHR G. Determination of the cation exchange capacity (CEC) of clay minerals using the complexes of copper(II) ion with triethylenetetramine and tetraethylenepentamine [J]. Clays and Clay Minerals, 1999, 47(3): 386−388. DOI: 10.1346/CCMN.1999.0470315
[19] 梁淑轩, 孙汉文. 石墨炉原子吸收光谱法分析药用植物中微量营养元素的含量 [J]. 光谱学与光谱分析, 2002, 22(5):847−849. DOI: 10.3321/j.issn:1000-0593.2002.05.042 LIANG S X, SUN H W. Determination of trace elements in medicinal plants by Grapphite Furnace atomic absorption spectrometry [J]. Spectroscopy and Spectral Analysis, 2002, 22(5): 847−849.(in Chinese) DOI: 10.3321/j.issn:1000-0593.2002.05.042
[20] CHEN C, ZHANG J N, LU M, et al. Microbial communities of an arable soil treated for 8 years with organic and inorganic fertilizers [J]. Biology and Fertility of Soils, 2016, 52(4): 455−467. DOI: 10.1007/s00374-016-1089-5
[21] LI B X, CHEN H L, LI N N, et al. Spatio-temporal shifts in the archaeal community of a constructed wetland treating river water [J]. The Science of the Total Environment, 2017, 605/606: 269−275. DOI: 10.1016/j.scitotenv.2017.06.221
[22] ZHAO S C, QIU S J, XU X P, et al. Change in straw decomposition rate and soil microbial community composition after straw addition in different long-term fertilization soils [J]. Applied Soil Ecology, 2019, 138: 123−133. DOI: 10.1016/j.apsoil.2019.02.018
[23] BOLGER A M, LOHSE M, USADEL B, et al. Trimmomatic: a flexible trimmer for Illumina sequence data [J]. Bioinformatics, 2014, 30(15): 2114−2120. DOI: 10.1093/bioinformatics/btu170
[24] MAGOČ T, SALZBERG S L. FLASH: fast length adjustment of short reads to improve genome assemblies [J]. Bioinformatics, 2011, 27(21): 2957−2963. DOI: 10.1093/bioinformatics/btr507
[25] EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads [J]. Nature Methods, 2013, 10(10): 996−998. DOI: 10.1038/nmeth.2604
[26] LAN Y M, WANG Q, COLE J R, et al. Using the RDP classifier to predict taxonomic novelty and reduce the search space for finding novel organisms [J]. PLoS One, 2012, 7(3): e32491. DOI: 10.1371/journal.pone.0032491
[27] QUAST C, PRUESSE E, YILMAZ P, et al. The SILVA ribosomal RNA gene database project: Improved data processing and web-based tools [J]. Nucleic Acids Research, 2013, 41(D1): D590−D596.
[28] SCHLOSS P D, WESTCOTT S L, RYABIN T, et al. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities [J]. Applied and Environmental Microbiology, 2009, 75: 7537−7541. DOI: 10.1128/AEM.01541-09
[29] 伍海兵, 张青青, 梁晶. 城市绿地土壤肥力质量综合评价方法初探 [J]. 土壤通报, 2020, 51(4):795−800. WU H B, ZHANG Q Q, LIANG J. A comprehensive evaluation method of soil fertility quality in urban green space [J]. Chinese Journal of Soil Science, 2020, 51(4): 795−800.(in Chinese)
[30] 赖焕雄, 郑小琴. 漳州市近48年气候变化特征分析 [J]. 安徽农业科学, 2010, 38(15):8056−8060. DOI: 10.3969/j.issn.0517-6611.2010.15.129 LAI H X, ZHENG X Q. Characteristics of climate change in Zhangzhou City in Recent 48 years [J]. Journal of Anhui Agricultural Sciences, 2010, 38(15): 8056−8060.(in Chinese) DOI: 10.3969/j.issn.0517-6611.2010.15.129
[31] DAVIS K E R, SANGWAN P, JANSSEN P H. Acidobacteria, Rubrobacteridae and Chloroflexi are abundant among very slow-growing and mini-colony-forming soil bacteria [J]. Environmental Microbiology, 2011, 13(3): 798−805. DOI: 10.1111/j.1462-2920.2010.02384.x
[32] FAN K K, DELGADO-BAQUERIZO M, GUO X S, et al. Biodiversity of key-stone phylotypes determines crop production in a 4-decade fertilization experiment [J]. The ISME Journal, 2021, 15: 550−561. DOI: 10.1038/s41396-020-00796-8
[33] HAN Q, MA Q, CHEN Y, et al. Variation in rhizosphere microbial communities and its association with the symbiotic efficiency of rhizobia in soybean [J]. The ISME Journal, 2020, 14(8): 1915−1928. DOI: 10.1038/s41396-020-0648-9
[34] WALTERS W A, JIN Z, YOUNGBLUT N, et al. Large-scale replicated field study of maize rhizosphere identifies heritable microbes [J]. PNAS, 2018, 115(28): 7368−7373. DOI: 10.1073/pnas.1800918115
[35] XU J, ZHANG Y, ZHANG P, et al. The structure and function of the global citrus rhizosphere microbiome [J]. Natural Communication, 2018, 9(1): 4894. DOI: 10.1038/s41467-018-07343-2
[36] 雷旭, 李冰, 李晓, 等. 复合垂直流人工湿地系统中不同植物根际微生物群落结构 [J]. 生态学杂志, 2015, 34(5):1373−1381. LEI X, LI B, LI X, et al. Rhizosphere microbial community of three plants in vertical-flow constructed wetland [J]. Chinese Journal of Ecology, 2015, 34(5): 1373−1381.(in Chinese)
[37] 杨美玲, 张霞, 王绍明, 等. 基于高通量测序的裕民红花根际土壤细菌群落特征分析 [J]. 微生物学通报, 2018, 45(11):2429−2438. YANG M L, ZHANG X, WANG S M, et al. High throughput sequencing analysis of bacterial communities in Yumin safflower [J]. Microbiology China, 2018, 45(11): 2429−2438.(in Chinese)
[38] CHEN S J, ZHU Y, SHAO T Y, et al. Relationship between rhizosphere soil properties and disease severity in highbush blueberry (Vaccinium corymbosum) [J]. Applied Soil Ecology, 2019, 127: 187−194.
[39] GAO L, WANG R, GAO J M, et al. Analysis of the structure of bacterial and fungal communities in disease suppressive and disease conducive tobacco-planting soils in China [J]. Soil Research, 2019, 58(1): 35−40.
[40] QI G F, CHEN S, KE L X, et al. Cover crops restore declining soil properties and suppress bacterial wilt by regulating rhizosphere bacterial communities and improving soil nutrient contents [J]. Microbiological Research, 2020, 238: 126505. DOI: 10.1016/j.micres.2020.126505
[41] TEDERSOO L, BAHRAM M, PÕLME S, et al. Global diversity and geography of soil fungi [J]. Science, 2014, 346(6213): 1078.
[42] EGIDI E, DELGADO-BAQUERIZO M, PLETT J M, et al. A few Ascomycota taxa dominate soil fungal communities worldwide [J]. Nature Communication, 2019, 10: 2369. DOI: 10.1038/s41467-019-10373-z
[43] PIETRO A D, RELLA M G, PACHLATKO J P, et al. Role of antibiotics produced by Chaetomium globosum in biocontrol of Pythium ultimum, a causal agent of damping-off [J]. Physiology and Biochemistry, 1992, 8(2): 131−135.
[44] PARK J H, CHOI G J, JANG K S, et al. Antifungal activity against plant pathogenic fungi of chaetoviridins isolated from Chaetomium globosum [J]. FEMS Microbiology Letters, 2005, 252(2): 309−313. DOI: 10.1016/j.femsle.2005.09.013
[45] ANGEL R, SOARES M I M, UNGAR E D, et al. Biogeography of soil Archaea and bacteria along a steep precipitation gradient [J]. The ISME Journal, 2010, 4(4): 553−563. DOI: 10.1038/ismej.2009.136
[46] HONG J K, CHO J C. Environmental variables shaping the ecological niche of thaumarchaeota in soil: Direct and indirect causal effects [J]. PLoS One, 2015, 10(8): e0133763. DOI: 10.1371/journal.pone.0133763
[47] SHAO K Q, JIANG X Y, HU Y, et al. Thaumarchaeota affiliated with Soil Crenarchaeotic Group are prevalent in the alkaline soil of an alpine grassland in northwestern China [J]. Annals of Microbiology, 2019, 69(8): 867−870. DOI: 10.1007/s13213-019-01492-5
[48] JIAO S, XU Y Q, ZHANG J, et al. Environmental filtering drives distinct continental atlases of soil Archaea between dryland and wetland agricultural ecosystems [J]. Microbiome, 2019, 7(1): 1−13. DOI: 10.1186/s40168-018-0604-3
[49] 段昌海, 张翠景, 孙艺华, 等. 新型产甲烷古菌研究进展 [J]. 微生物学报, 2019, 59(6):981−995. DUAN C H, ZHANG C J, SUN Y H, et al. Recent advances on the novel methanogens [J]. Acta Microbiologica Sinica, 2019, 59(6): 981−995.(in Chinese)
-
期刊类型引用(1)
1. 董照锋. 茶树修剪技术对北方茶园病虫控制的效应. 茶叶. 2017(04): 207-209 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载: