Amplification and Expression of a Lectin Gene from Agaricus bisporus AS2796
-
摘要:目的 获得双孢蘑菇凝集素基因,了解双孢蘑菇凝集素家族蛋白的功能。方法 根据已报道的双孢蘑菇凝集素基因序列设计引物,以总DNA为模板扩增双孢蘑菇凝集素基因。将长432 bp的基因亚型克隆后连接至携带His标签的原核表达载体pET-28a,转化大肠杆菌BL21(DE3),经IPTG诱导表达,表达产物经亲和层析纯化后,进行Western blot印迹分析。结果 扩增的凝集素基因大小为432 bp,重组表达质粒pET-Lectin构建正确,重组凝集素蛋白在大肠杆菌BL21(DE3)中的表达产物约为18 kDa,重组蛋白纯化后纯度达95%以上。结论 本研究首次扩增双孢蘑菇凝集素基因,并获得纯度较高的双孢蘑菇凝集素蛋白,可利用凝集试验检测其生物学活性,为目的基因的深入研究提供参考依据。Abstract:Objective A lectin gene from Agaricus bisporus AS2796 was isolated to study the functions of the agglutinin protein in mushrooms.Method Based upon the reported sequences, a primer was designed to amplify the lectin gene with the total DNA as templates. A 432 bp PCR product was purified and connected to the prokaryotic expression vector pET-28a carrying the His label, then transformed into E. coli BL21 (DE3). The IPTG-induced expression product was subsequently purified by affinity chromatography and identified by Western blot.Result The amplified lectin gene was 432 bp with correctly constructed recombinant expression plasmid, pET-lectin. The recombinant agglutinin protein was about 18 kDa and more than 95% pure after purification,Conclusion For the first time, a lectin gene was successfully isolated from A. bisporus and amplified. The agglutinin protein obtained could be used to further study its bioactivity and biosynthesis.
-
Keywords:
- Agaricus bisporus /
- lectin /
- vector construction /
- prokaryotic expression
-
0. 引言
【研究意义】凝集素是一类非免疫起源、无酶活性、可专一识别多糖并与之非共价可逆结合的蛋白,含有一个或者多个非催化结构,能凝集细胞、沉淀糖蛋白,具有多种生物学、生理学和免疫学功能[1-3]。凝集素具有结合特异性,能识别细胞内、细胞间或组织间的效应分子。凝集素根据分子结构可分为C-型凝集素、S-型凝集素、P-型凝集素、I-型凝集素。C-型凝集素是依赖Ca2+的凝集素;S-型凝集素可以和β-半乳糖苷键特异性结合;P-型凝集素对6-磷酸甘露糖具有特异识别能力;而I-型凝集素类似于免疫球蛋白。凝集素在动物[4]、昆虫、植物、真菌以及不同的器官和组织中含量都比较丰富,甚至在细菌和病毒中也有凝集素的报道 [5-7]。真菌凝集素普遍存在于大型真菌中,分子量为12~190 kD,一般由2~4个相同亚基组成,是食(药)用真菌中一种重要的药理成分,含量丰富,虽然从子实体、菌丝、菌核、孢子等器官中均能提取,但大多数蘑菇凝集素为从子实体和菌丝中提取,仅少量从菌核中提取,而且不同发育阶段真菌中凝集素的含量也不同[8]。双孢蘑菇(Agaricus bisporus)又名白蘑菇、纽扣蘑菇,是一种常见的食用蘑菇,在世界范围内均有栽培种植,其具有风味鲜美、营养丰富等特性,在食用菌市场中占据着重要份额[9]。【前人研究进展】前人研究表明,凝集素具有促进植物有丝分裂以及防御病虫害、细胞免疫活性、杀菌、降血压、活化淋巴细胞、抑制肿瘤生长等功能[10-16]。凝集素参与了高等动物的发育、癌变以及细胞识别与信息传递等重要过程;不仅在动物自身的器官发育分化与防御机制中有重要作用,而且还能增强高等动物的免疫能力。因此,蘑菇凝集素目前已成为细胞学、肿瘤学以及免疫学领域研究的热点。吴恩奇和图力古尔(2006)综述了蘑菇凝集素的分布、结构、性质、作用与功能、提取方法和应用进展[3],目前已知大约80%以上蘑菇中的凝集素具有凝血活性[17-18]。张迪等对双孢蘑菇2796凝集素提取和理化特性的初步研究发现,该凝集素在pH 3.0~10.0范围内均保持较高的凝集活性,且不依赖于二价金属离子[19],稳定性强。目前关于凝集素基因研究的报道较多,主要体现在天南星和石蒜[13]、拟南芥[20]、绿藻石莼属孔石莼[21]、新疆黄精[22]、家蚕[23]、大豆[24]、荔枝[25]、金针菇[26]、柞蚕[27]、掌叶半夏[28]等植物和昆虫凝集素基因的克隆和表达研究上,并探索凝集素基因与蘑菇原基形成的关系,挖掘其潜在的转录调控因子,以求阐明子实体形成的分子调控机理[26]。彭博等(2019)虽对双孢蘑菇转录组进行了测序并对褐变相关基因展开挖掘,但并未对凝集素基因进行相关研究[29]。【本研究切入点】而双孢蘑菇凝集素基因的扩增及原核表达目前尚未有相关研究报道,其基因功能的研究更是缺乏理论依据。【拟解决的关键问题】本研究根据已报道的双孢蘑菇凝集素基因序列设计引物,以总DNA为模板扩增双孢蘑菇凝集素基因,并构建原核表达载体转化大肠杆菌,经IPTG诱导表达、Western blot技术鉴定,获得凝集素重组蛋白,有助于目的基因的深入研究,也为进一步深入挖掘凝集素家族基因、明确其生物学功能奠定理论基础。
1. 材料与方法
1.1 试验材料
1.1.1 菌株
双孢蘑菇Agaricus bisporus(Lange)Singer 2796菌株由福建农业科学院食用菌研究所提供。表达载体pET-28a、大肠杆菌(Escherichia coli)DH5α、BL21(DE3)均由福建省农业科学院食用菌研究所保存。
1.1.2 酶和试剂
限制性内切酶以及其他工具酶均购自上海生工生物工程有限公司;克隆载体pMD18-T Vector Systems购自日本TaKaRa公司,QIAEXⅡ Gel Extration Kit购自QIAGEN公司。其他试剂均为国产分析纯。
1.2 试验方法
1.2.1 双孢蘑菇基因组DNA的提取
采用CTAB法[30],从双孢蘑菇中提取双孢蘑菇基因组DNA。
1.2.2 引物设计及序列扩增
根据基因文库设计特异性扩增引物。引物序列如下:正向引物5′-GGATCCATGTCTTACACCGTCAGCGTTCG-3′;反向引物5′-CTCGAGTTATCCGATGATGAGATTGGC-3′。取上述提取的双孢蘑菇DNA采用PCR法特异扩增基因序列,反应条件为:94℃ 5 min,预变性;94℃ 1 min,变性,55℃ 1 min,退火,72℃延伸1 min,30个循环;72℃延伸10 min。将PCR产物进行1%琼脂糖凝胶电泳(TAE电泳缓冲液、电压120 V)后,与Marker对照判断无误后,切下特异性扩增条带,扩增产物按照QIAEXⅡGel Extration Kit(QIAGEN公司产品)回收纯化说明书进行。回收产物连接到pMD18-T载体,筛菌验证后送华大基因测序,最终得到中间质粒pMD18-lectin。
1.2.3 凝集素基因原核表达载体的构建
将pMD18-lectin和pET28-α原核表达载体限制性内切酶XhoI/Bam HI进行双酶切处理。取适量酶切产物于1%琼脂糖凝胶电泳检测,切胶回收,回收产物进行连接,转化至克隆菌株DH5α感受态中,挑取长出的菌落,进行菌液PCR鉴定,将检测出目的条带的菌液提取质粒进行酶切鉴定,最终得到表达质粒pET28-lectin。
1.2.4 重组质粒pET28-lectin在大肠杆菌中的诱导表达
取1 μg上述测序鉴定正确的重组质粒,转入50~100 μL大肠杆菌BL21(DE3)感受态细胞中。挑取长出的菌落,进行菌液PCR鉴定,得到最终表达菌株。
取上述PCR鉴定正确的菌液30 μL分别接种到含有3 mL新鲜的LK液体培养基的玻璃管中,37℃振荡培养至OD600nm≈0.6,在培养基中加入IPTG至终浓度1 mmol·L−1,以诱导外源基因在大肠杆菌中表达。以IPTG培养基作为未诱导的对照。上述处理后的菌液在37℃下250 r·min−1继续振荡培养3 h或更长时间,使外源基因在大肠杆菌中充分表达。
1.2.5 表达产物的Western blot检测
制备SDS-PAGE凝胶(12%分离胶和5%浓缩胶),分别上样经ITPG诱导的菌体蛋白、未诱导的菌体蛋白以及空白菌体蛋白,电泳至溴酚蓝跑出玻璃板即可终止。电泳结束前30 min,将PDVF在甲醇中浸润3~10 s,移至电转液中放置20~30 min,在60 V恒压、4℃条件下转膜1 h至PVDF膜上,将电转好的PDVF膜放在离子水中去除SDS,接着用PBST进行洗涤10 min,洗涤4次;5%脱脂奶粉封闭1 h。制备的组氨酸(His)抗体作为一抗,室温下摇床孵育2 h,PBST进行洗涤10 min,洗涤4次;用HRP标记的羊抗兔IgG作为二抗,室温下摇床孵育2 h,PBST进行洗涤10 min,洗涤4次;洗涤结束后去除洗涤液,加入DAB染色工作液染色。
2. 结果与分析
2.1 PCR扩增双孢蘑菇凝集素基因
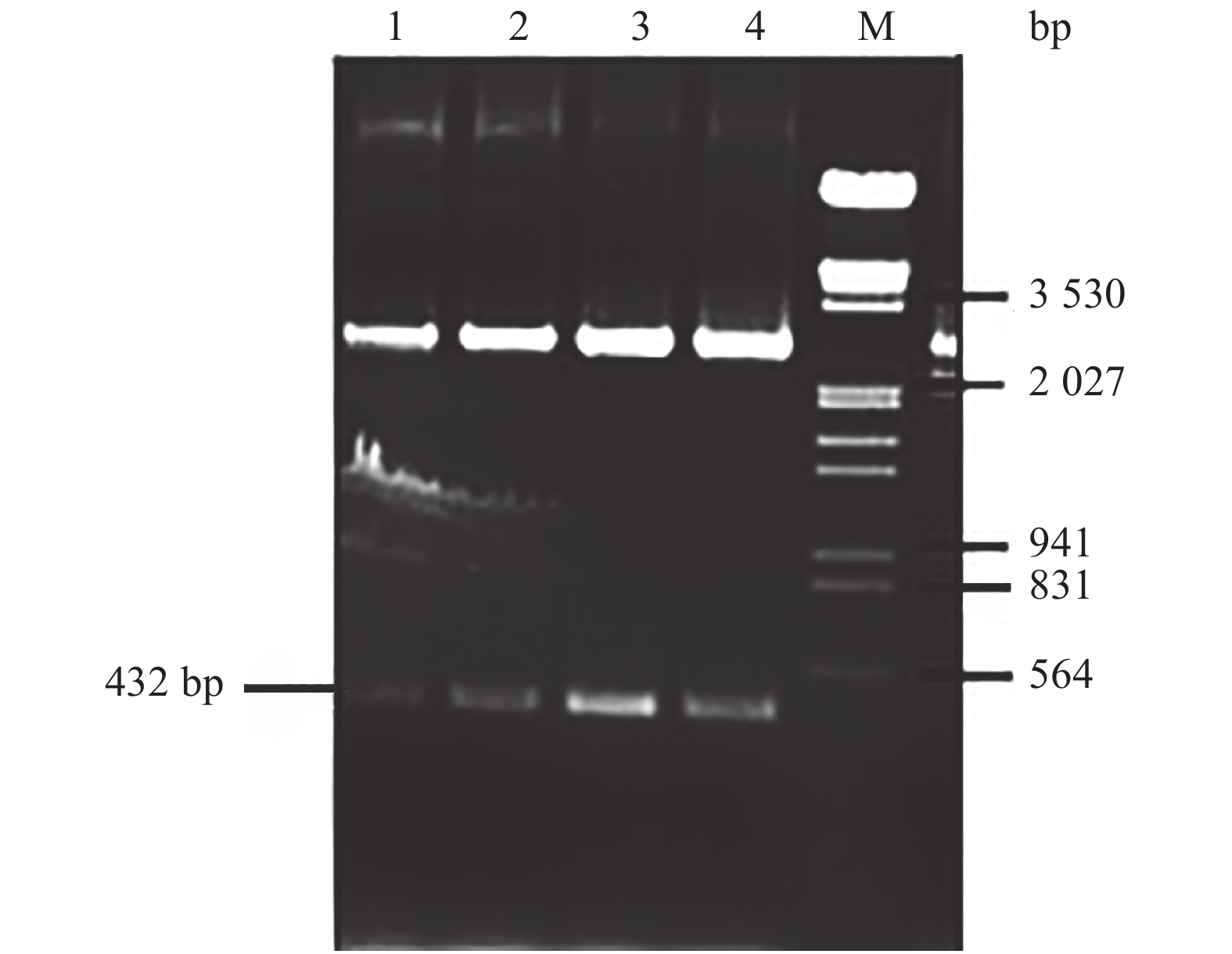
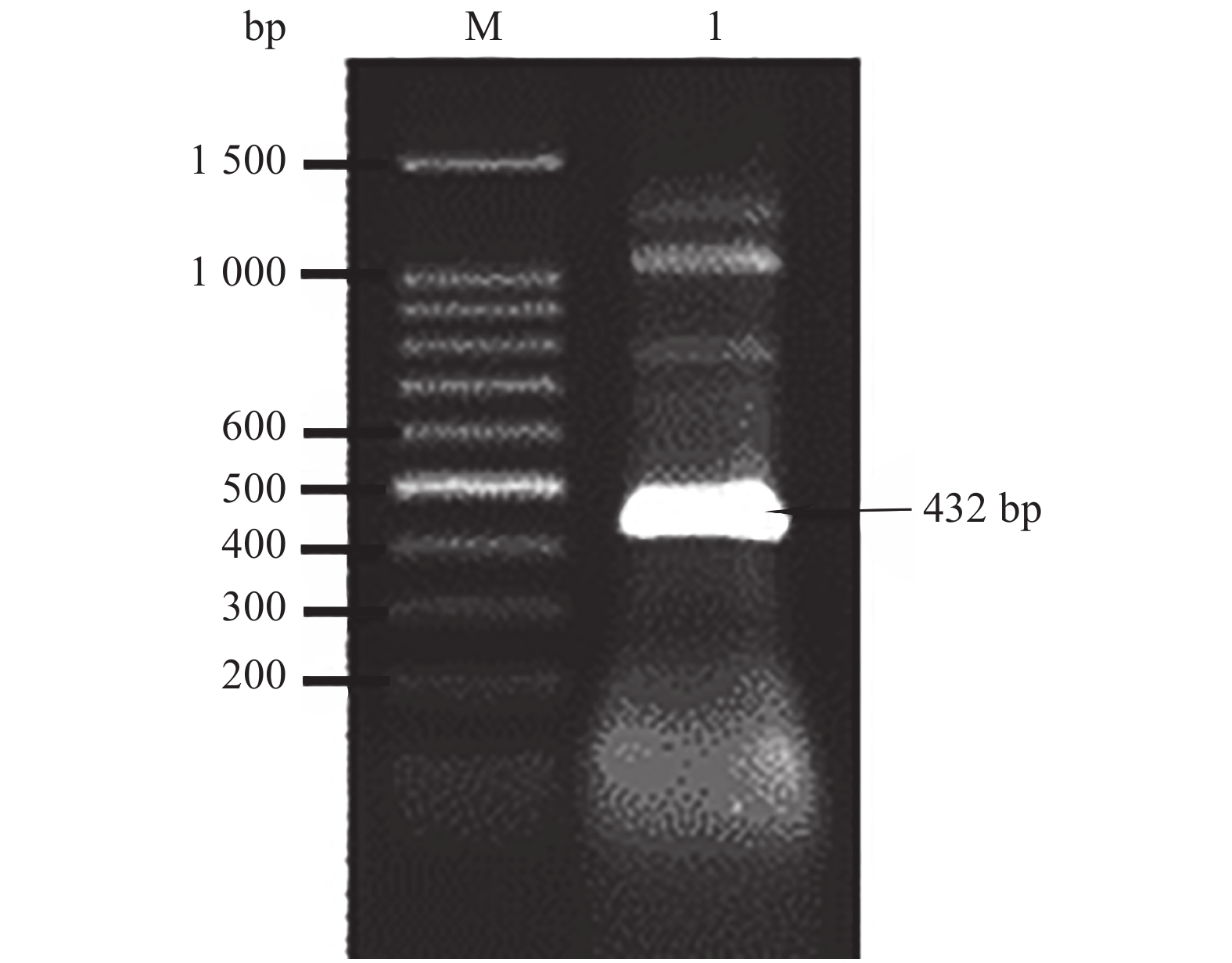
通过与双孢蘑菇基因组数据库比对发现,凝集素基因不含有内含子,所以无需通过反转录PCR扩增凝集素基因,可直接以双孢蘑菇总DNA为模板,PCR扩增凝集素基因。根据基因文库设计特异性扩增引物。琼脂糖凝胶电泳和测序结果表明,得到大小432 bp的条带,与目的基因大小一致(图1)。
2.2 凝集素基因克隆载体的构建
割胶回收PCR扩增的凝集素基因,与pMD18-T载体连接后转化大肠杆菌DH5α,转化产物涂布LB平板后于37℃下培养至克隆菌落出现,挑取菌落摇菌后提取质粒,双酶切鉴定插入片段是否正确。琼脂糖电泳后观察酶切结果,发现插入片段与PCR产物大小一致(如图2所示)。阳性克隆送交公司测序。经Blast比对发现,测序结果序列与GenBank中已知序列高度同源(99%),确定插入片段为双孢蘑菇凝集素基因,重组质粒pMD18-lectin构建正确。
2.3 双孢蘑菇凝集素基因表达载体的构建
BamHⅠ和XhoⅠ酶切重组子pMD18-lectin,回收插入片段后将其与同样酶切回收的pET-28α载体相连,转化大肠杆菌DH5α,转化产物涂布LB平板后于37℃下培养至克隆菌落出现,挑取菌落摇菌后提取质粒,构建重组质粒pET28-lectin。重组子pET28-lectin经质粒PCR确定插入片段大小正确(图3)。
2.4 凝集素基因在大肠杆菌中的表达
重组子pET28-lectin转入BL21(DE3)后,IPTG诱导表达。SDS-PAGE电泳检测表达产物。结果显示:重组凝集素蛋白在BL21(DE3)中的表达产物大约为18 kDa(图4)。
![]() 图 4 凝集素融合基因表达产物的SDS-聚丙烯酰胺电泳分析注:M:低分子量标准蛋白;1:含诱导空载体pET-28a的菌体总蛋白;2:含未诱导空载体pET-28α的菌体总蛋白;3~4:含未诱导重组载体pET-lectin的菌体总蛋白;5~8:含诱导重组载体pET-lectin的菌体总蛋白。Figure 4. SDS-PAGE on expression product of lectin fusion geneNote: M: Protein Marker; 1: expression products of induced pET-28α; 2: expression products of pET-28α without induction; 3 and 4: expression products of recombinant pET-lectin without induction; 5–8: expression products of induced recombinant carrier pET-lectin.
图 4 凝集素融合基因表达产物的SDS-聚丙烯酰胺电泳分析注:M:低分子量标准蛋白;1:含诱导空载体pET-28a的菌体总蛋白;2:含未诱导空载体pET-28α的菌体总蛋白;3~4:含未诱导重组载体pET-lectin的菌体总蛋白;5~8:含诱导重组载体pET-lectin的菌体总蛋白。Figure 4. SDS-PAGE on expression product of lectin fusion geneNote: M: Protein Marker; 1: expression products of induced pET-28α; 2: expression products of pET-28α without induction; 3 and 4: expression products of recombinant pET-lectin without induction; 5–8: expression products of induced recombinant carrier pET-lectin.2.5 表达产物的Western blot分析
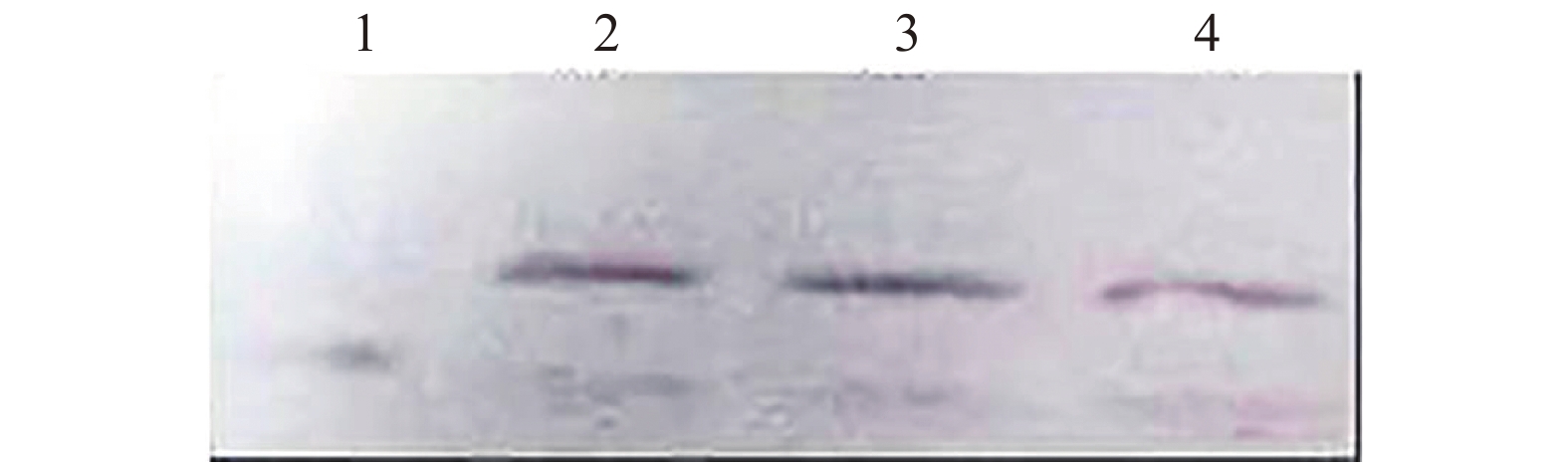
原核表达载体中携带6个丝氨酸(His)的标签,其表达的凝集素中亦融合了6个His氨基酸的标签。所以用6×His抗体可以检测凝集素的表达情况。结果表明(如图5所示),凝集素融合基因的表达产物均能与His抗体特异性结合,说明凝集素融合基因得到了表达。
3. 讨论与结论
本研究获得的凝集素基因大小为432 bp,均小于目前已知的荔枝凝集素基因468 bp[25]、新疆黄精凝集素基因550 bp[22]、大豆凝集素基因800 bp[24]、掌叶半夏凝集素基因729~777 bp[28]以及家蚕凝集素基因810 bp[23],但是凝集素基因序列大小与其生物学功能差异机理目前尚不清楚。本研究应用的pET-28α载体是带有载体6个His标签的融合表达系统,而融合蛋白中的His标签不会影响蛋白的活性,便于蛋白纯化。根据相关研究报道,其他植物凝集素基因中还存在家族成员且同源性较高,通过诱导表达发现在相同时间、相同浓度的IPTG诱导下,融合蛋白的表达量各不相同[28],因此,项目组后续还需通过生物信息学手段进一步挖掘其基因组中家族成员基因及其他潜在的功能基因,为分析双孢蘑菇子实体形成的分子调控机理提供理论依据。
双孢蘑菇子实体中存在大量的凝集素,而凝集素的含量和分布与双孢蘑菇不同的发育阶段也有一定的相关性,在原基期含量很少,在子实体成熟期内数量增加[8]。因此,可以推测在子实体形成过程中凝集素基因的表达量也逐渐增加,凝集素基因的表达量是否与子实体中营养成分含量有关有待进一步研究。大量的研究表明,许多植物中分离的凝集素或被克隆和鉴定出来的凝集素基因表达产物均具有抗虫活性[31-33, 16],但是凝集素基因相关研究在双孢蘑菇中未见报道,仅见于提取双孢蘑菇凝集素对血红细胞凝集活性的研究[27]。课题组前期开展了双孢蘑菇凝集素的抗氧化活性、对植物病菌和海洋微藻的抑制等方面的工作,均具有较好的作用效果。因此,本研究后续研究将重点开展双孢蘑菇凝集素基因功能方面的工作,比如凝集素基因与双孢蘑菇品质改良基因的相关性研究;同时,双孢蘑菇凝集素的应用也可借鉴植物凝集素的应用研究方法,特别是通过转基因技术将双孢蘑菇凝集素基因转化到作物中,发挥其抗虫性和抗病性方面的巨大潜力。也可利用基因编辑技术从双孢蘑菇中克隆编码具有免疫调节或抗肿瘤功能的凝集素基因,通过导入微生物合成重组蛋白并检测蛋白的免疫或抗肿瘤生理活性,为进一步筛选和开发新型先导药物提供依据。
本研究选择最常见的双孢蘑菇作为研究对象,通过PCR扩增双孢蘑菇凝集素基因,构建双孢蘑菇凝集素基因克隆载体和基因表达载体等手段使双孢蘑菇凝集素基因在大肠杆菌中表达,为今后稳定、大量获得双孢蘑菇凝集素奠定基础,为进一步深入研究凝集素基因和蛋白功能特性提供依据。
-
图 4 凝集素融合基因表达产物的SDS-聚丙烯酰胺电泳分析
注:M:低分子量标准蛋白;1:含诱导空载体pET-28a的菌体总蛋白;2:含未诱导空载体pET-28α的菌体总蛋白;3~4:含未诱导重组载体pET-lectin的菌体总蛋白;5~8:含诱导重组载体pET-lectin的菌体总蛋白。
Figure 4. SDS-PAGE on expression product of lectin fusion gene
Note: M: Protein Marker; 1: expression products of induced pET-28α; 2: expression products of pET-28α without induction; 3 and 4: expression products of recombinant pET-lectin without induction; 5–8: expression products of induced recombinant carrier pET-lectin.
-
[1] 孙册, 朱政,莫汉庆. 凝集素[M]. 北京: 科学出版社, 1986. [2] SHARON N. History of lectins: from hemagglutinins to biological recognition molecules [J]. Glycobiology, 2004, 14(11): 53R−62R. DOI: 10.1093/glycob/cwh122
[3] 吴恩奇, 图力古尔. 蘑菇凝集素及其研究进展 [J]. 菌物研究, 2006, 4(4):69−76. DOI: 10.3969/j.issn.1672-3538.2006.04.014 WU E Q, BAU TOLGOR. A review of lectins from mushrooms [J]. Journal of Fungal Research, 2006, 4(4): 69−76.(in Chinese) DOI: 10.3969/j.issn.1672-3538.2006.04.014
[4] 林玉满, 苏爱华. 长裙竹荪凝集素的分离纯化与部分生化性质 [J]. 中国生物化学与分子生物学报, 2003, 19(2):261−263. DOI: 10.3969/j.issn.1007-7626.2003.02.023 LIN Y M, SU A H. Isolation, purification and characterization of lectin from Dictyophora indusiata fisch [J]. Chinese Journal of Biochemistry and Molecular Biology, 2003, 19(2): 261−263.(in Chinese) DOI: 10.3969/j.issn.1007-7626.2003.02.023
[5] 王贺祥, 黄荣春, 吴子斌, 等. 蕈菌凝集素 [J]. 中国食用菌, 1997, 16(1):3−4. WANG H X, HUANG R C, WU Z B, et al. Mushroom lectins [J]. Edible Fungi of China, 1997, 16(1): 3−4.(in Chinese)
[6] WANG H X, NG T B, OOI V E C. Lectins from mushrooms [J]. Mycological Research, 1998, 102(8): 897−906. DOI: 10.1017/S0953756298006200
[7] 李燕娥, 朱祯, 上官小霞, 等. 棉花转凝集素基因的研究进展 [J]. 中国棉花, 2004, 31(6):5−6. DOI: 10.3969/j.issn.1000-632X.2004.06.002 LI Y E, ZHU Z, SHANGGUAN X X, et al. Advances in the study of cotton lectin gene [J]. China Cotton, 2004, 31(6): 5−6.(in Chinese) DOI: 10.3969/j.issn.1000-632X.2004.06.002
[8] 孙慧, 赵辰光, 仝鑫, 等. 杨树菇凝集素AAVP具有抗病毒和促进菌丝分化功能 [J]. 中国生物化学与分子生物学报, 2003, 19(2):210−214. DOI: 10.3969/j.issn.1007-7626.2003.02.014 SUN H, ZHAO C G, TONG X, et al. Agrocybe aegerita lectin AAVP with antivirus and mycelium differentiation promotion activities [J]. Chinese Journal of Biochemistry and Molecular Biology, 2003, 19(2): 210−214.(in Chinese) DOI: 10.3969/j.issn.1007-7626.2003.02.014
[9] MOKOCHINSKI J B, LÓPEZ B G C, SOVRANI V, et al. Production of Agaricus brasiliensis mycelium from food industry residues as a source of antioxidants and essential fatty acids [J]. International Journal of Food Science & Technology, 2015, 50(9): 2052−2058.
[10] KINO K, MIZUMOTO K, SONE T, et al. An immunomodulating protein, Ling Zhi-8 (LZ-8) prevents insulitis in non-obese diabetic mice [J]. Diabetologia, 1990, 33(12): 713−718. DOI: 10.1007/BF00400340
[11] PEUMANS W J, BARRE A, HAO Q, et al. Higher plants developed structurally different motifs to recognize foreign glycans [J]. Trends in Glycoscience and Glycotechnology, 2000, 12(64): 83−101. DOI: 10.4052/tigg.12.83
[12] SUN H, ZHAO C G, TONG X, et al. A lectin with mycelia differentiation and antiphytovirus activities from the edible mushroom Agrocybe aegerita [J]. BMB Reports, 2003, 36(2): 214−222. DOI: 10.5483/BMBRep.2003.36.2.214
[13] 赵秀云. 天南星凝集素和石蒜凝集素基因的克隆及抗虫研究 [D]. 上海: 复旦大学, 2003. ZHAO X Y. Cloning of lectin genes from Arisaema hoterophyllum and Lycoris radiate and the insect resistance research of their protein production [D]. Shanghai: Fudan University, 2003.(in Chinese)
[14] NGAI P H K, NG T. A mushroom (Ganoderma capense) lectin with spectacular thermostability, potent mitogenic activity on splenocytes, and antiproliferative activity toward tumor cells [J]. Biochemical and Biophysical Research Communications, 2004, 314(4): 988−993. DOI: 10.1016/j.bbrc.2003.12.196
[15] XIANG Y, SONG M, WEI Z Y, et al. A jacalin-related lectin-like gene in wheat is a component of the plant defence system [J]. Journal of Experimental Botany, 2011, 62(15): 5471−5483. DOI: 10.1093/jxb/err226
[16] 周英, 谢红卫, 刘长爱, 等. 豆科凝集素基因Le4的克隆及其表达产物对蚜虫的抗性 [J]. 基因组学与应用生物学, 2016, 35(12):3474−3480. ZHOU Y, XIE H W, LIU C A, et al. Cloning of lectin Le4 gene from leguminosae and the aphid resistance effect of its protein production [J]. Genomics and Applied Biology, 2016, 35(12): 3474−3480.(in Chinese)
[17] FURUKAWA K, YING R, NAKAJIMA T, et al. Hemagglutinins in fungus extracts and their blood group specificity [J]. Experimental and Clinical Immunogenetics, 1995, 12(4): 223−231.
[18] 刘艳如, 余萍, 郑怡. 12种食用菌凝集素的筛选 [J]. 福建师范大学学报(自然科学版), 2003, 19(2):65−68. LIU Y R, YU P, ZHENG Y. Screening of lectins from twelve varieties of edible mushroom [J]. Journal of Fujian Normal University(Natural Science Edition), 2003, 19(2): 65−68.(in Chinese)
[19] 张迪, 林勇, 杨晓钦, 等. 双孢蘑菇2796凝集素的提取及其部分理化性质研究 [J]. 福建农业学报, 2011, 26(3):457−461. DOI: 10.3969/j.issn.1008-0384.2011.03.024 ZHANG D, LIN Y, YANG X Q, et al. Extraction and partial characterization of a lectin from Agaricus bisporus strain AS2796 [J]. Fujian Journal of Agricultural Sciences, 2011, 26(3): 457−461.(in Chinese) DOI: 10.3969/j.issn.1008-0384.2011.03.024
[20] 陈卓. 拟南芥类凝集素基因AtLECLl的功能研究 [D]. 石家庄 河北农业大学, 2013. CHEN Z. Functional analysis of putative lectin gene AtLECLl in Arabidopsis thaliana [D].. Shijiazhuang: Agricultural University of Hebei, 2013. (in Chinese)
[21] 郑璐平, 谢荔岩, 姚锦爱, 等. 孔石莼凝集素蛋白基因的克隆与表达 [J]. 激光生物学报, 2008, 17(6):762−767. DOI: 10.3969/j.issn.1007-7146.2008.06.011 ZHENG L P, XIE L Y, YAO J A, et al. Cloning and expression of lectin gene of Ulva pertusa [J]. Acta Laser Biology Sinica, 2008, 17(6): 762−767.(in Chinese) DOI: 10.3969/j.issn.1007-7146.2008.06.011
[22] 孙素荣, 张智, 李素丽, 等. 新疆黄精凝集素基因的克隆、序列分析和表达 [J]. 生物工程学报, 2008, 24(3):387−394. DOI: 10.3321/j.issn:1000-3061.2008.03.008 SUN S R, ZHANG Z, LI S L, et al. Cloning, sequencing analysis and expression of a putative mannose-binding lectin gene from Polygonatum roseum in Xinjiang [J]. Chinese Journal of Biotechnology, 2008, 24(3): 387−394.(in Chinese) DOI: 10.3321/j.issn:1000-3061.2008.03.008
[23] 郭旭. 两种新型家蚕凝集素基因的克隆及表达 [D]. 武汉: 华中师范大学, 2010. GUO X. cDNA cloning and expression analysis of two novel C-type lectins from the silkworm [D]. Wuhan: Central China Normal University, 2010.(in Chinese)
[24] 方标, 王丕武, 于雷, 等. 大豆凝集素基因Le2克隆及转化 [J]. 大豆科学, 2011, 30(4):706−709. FANG B, WANG P W, YU L, et al. Cloning and transformation of soybean lectin gene Le2 into tobacco [J]. Soybean Science, 2011, 30(4): 706−709.(in Chinese)
[25] 孙科源, 纠敏, 张新春, 等. 无核荔枝凝集素基因的克隆与表达分析 [J]. 热带作物学报, 2011, 32(7):1309−1313. DOI: 10.3969/j.issn.1000-2561.2011.07.024 SUN K Y, JIU M, ZHANG X C, et al. Cloning and expression analysis of a lectin gene from Wuhe Litchi [J]. Chinese Journal of Tropical Crops, 2011, 32(7): 1309−1313.(in Chinese) DOI: 10.3969/j.issn.1000-2561.2011.07.024
[26] 陈仁良, 王威, 严俊杰, 等. 金针菇凝集素基因Fv-mJRL1的生物信息学分析及其共表达 [J]. 厦门大学学报(自然科学版), 2016, 55(3):323−329. CHEN R L, WANG W, YAN J J, et al. Bioinformatic analysis and co-expression study of jacalin-related lectin gene Fv-mJRL1 in Flammulina velutipes [J]. Journal of Xiamen University(Natural Science Edition), 2016, 55(3): 323−329.(in Chinese)
[27] 吕明珠. 柞蚕凝集素基因ApCTL的克隆及表达分析 [D]. 大连: 大连理工大学, 2018. LÜ M Z. Cloning and expression analysis of ApCTL gene from Antheraea pernyi [D]. Dalian: Dalian University of Technology, 2018.(in Chinese)
[28] 王洪乐, 齐连芬, 杨超沙, 等. 掌叶半夏凝集素基因克隆及原核表达 [J]. 华北农学报, 2018, 33(1):109−114. DOI: 10.7668/hbnxb.2018.01.017 WANG H L, QI L F, YANG C S, et al. The agglutinin gene cloning of Pinellia pedatisecta and prokaryotic expression [J]. Acta Agriculturae Boreali-Sinica, 2018, 33(1): 109−114.(in Chinese) DOI: 10.7668/hbnxb.2018.01.017
[29] 彭博, 李炳娟, 关文强, 等. 双孢蘑菇转录组测序及褐变相关基因的挖掘 [J]. 食品科学, 2019, 40(2):126−132. DOI: 10.7506/spkx1002-6630-20180510-154 PENG B, LI B J, GUAN W Q, et al. Transcriptome sequencing of Agaricus bisporus and mining of genes involved in browning [J]. Food Science, 2019, 40(2): 126−132.(in Chinese) DOI: 10.7506/spkx1002-6630-20180510-154
[30] 李河, 周国英, 刘君昂. 双孢蘑菇褐腐病病原菌的分离及分子鉴定 [J]. 食用菌学报, 2009, 16(2):74−76. DOI: 10.3969/j.issn.1005-9873.2009.02.014 LI H, ZHOU G Y, LIU J A. Isolation and molecular identification of a pathogen causing brown rot in Agaricus bisporus [J]. Acta Edulis Fungi, 2009, 16(2): 74−76.(in Chinese) DOI: 10.3969/j.issn.1005-9873.2009.02.014
[31] HILDER V A, POWELL K S, GATEHOUSE A M R, et al. Expression of snowdrop lectin in transgenic tobacco plants results in added protection against aphids [J]. Transgenic Research, 1995, 4(1): 18−25. DOI: 10.1007/BF01976497
[32] POWELL K S, GATEHOUSE A M R, HILDER V A, et al. Antimetabolic effects of plant lectins and plant and fungal enzymes on the nymphal stages of two important rice pests, Nilaparvata lugens and Nephotettix cinciteps [J]. Entomologia Experimentalis et Applicata, 1993, 66(2): 119−126. DOI: 10.1111/j.1570-7458.1993.tb00699.x
[33] TANG K, ZHAO E, SUN X, et al. Production of transgenic rice homozygous lines with enhanced resistance to the rice brown planthopper [J]. Acta Biotechnologica, 2001, 21(2): 117−128. DOI: 10.1002/1521-3846(200105)21:2<117::AID-ABIO117>3.0.CO;2-Y
-
期刊类型引用(2)
1. 林平发,林勇,林婷婷. 双孢蘑菇凝集素对兔耳创面愈合增生性瘢痕的作用研究. 福建轻纺. 2023(09): 17-20 .  百度学术
百度学术
2. 刘主,康林芝,蔡爱群,叶璐瑶,霍海霞,刘静华. 草菇菌丝体凝集素凝血活性及其氨基酸残基化学修饰. 食用菌学报. 2021(05): 96-103 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: