Construction and Biofilm Formation of yibT-and-csgD-deleted Salmonella typhimurium
-
摘要:目的 通过构建鼠伤寒沙门菌(Salmonella typhimurium)yibT、csgD双基因缺失株及缺失株的回补株,探究其对鼠伤寒沙门菌生物膜形成的影响,以期为沙门菌的有效防控提供新策略。方法 以鼠伤寒沙门菌野生株CVCC541(wild-type, WT)为研究对象,利用λ-red同源重组技术构建yibT和csgD基因缺失株;利用重组载体技术构建其基因回补株;利用结晶紫染色法比较鼠伤寒沙门菌突变株生物膜形成能力的差异;通过苯酚-硫酸法测定胞外多糖含量、半固体平板测定运动能力的变化;比较不同突变菌株自聚集能力的变化;通过扫描电镜观察生物膜结构;最后利用荧光定量PCR技术鉴定生物膜形成过程中关键基因的mRNA表达水平。结果 成功构建了鼠伤寒沙门菌yibT和csgD的双基因缺失株WTΔyibTΔcsgD和csgD基因单缺失株WTΔcsgD及基因缺失株的回补株WTΔcsgDΔyibT/pcsgD和WTΔcsgD/pcsgD。 yibT和csgD基因的缺失降低了生物膜的形成能力、胞外多糖含量和自聚集能力,增强了运动能力;invF和sdiA基因的mRNA表达水平下降。结论 yibT和csgD基因缺失会降低鼠伤寒沙门菌的生物膜形成能力。Abstract:Objective Strains of Salmonella typhimurium with yibT and/or csgD deleted were created to observe the effect on its biofilm formation for effective prevention and control of the foodborne pathogen.Method The λ-red homologous recombination technique was applied to create the gene-deleted mutants, WTΔyibTΔcsgD and WTΔcsgD, of WT S. typhimurium (CVCC541). Subsequently, the gene-complemented strains were also obtained using recombinant vector technology. Differences of the mutants in biofilm formation were determined by crystal violet staining, content of exopolysaccharide measured by phenol-sulfuric acid, mobility tested on semi-solid agar plates, and self-aggregation monitored. Under a scanning electron microscope, biofilm structure was observed. Finally, mRNA expressions of the target genes in the biofilm were identified by fluorescence quantitative PCR.Result A double-gene deleted WTΔyibTΔcsgD, a WTΔcsgD without csgD, and their respective complemented strains, WTΔcsgDΔyibT/pcsgD and WTΔcsgD/pcsgD, were successfully obtained. The double-gene deletion significantly reduced the ability in forming biofilm, the content of exopolysaccharide, and the aggregation of the genes to targets, and the mRNA expressions of invF and sdiA in WT S. typhimurium.Conclusion Deletion of yibT and csgD significantly impacted some critical biofunctions of S. typhimurium that could become a new approach for control of the foodborne disease.
-
Keywords:
- Salmonella typhimurium /
- yibT /
- csgD /
- biofilm
-
0. 引言
【研究意义】太子参(Pseudostellaria heterophylla)隶属于石竹科(Caryophyllaceae)假繁缕属(Pseudostellaria),是一种以块根入药的中药材,具有益气健脾和生津润肺的功效[1]。我国的福建、贵州和安徽等省是其主要种植区。随着人工栽培面积的扩大和种植年限的增加,太子参连作障碍逐年加重,重茬3年以上的地块几乎绝产[2]。土壤微生物结构失衡和土传病原微生物增加是太子参发生连作障碍的重要原因[3−4]。连作土壤中病原菌数量增加,太子参生长过程中受病原菌侵染的机率也相应增加[5]。镰刀菌属(Fusarium)真菌是引起太子参根腐病的主要病原菌,也是太子参产生连作障碍的关键致病菌之一[6−7]。长期和过量地施用化肥会破坏土壤生境、改变根际土壤微生物群落结构和功能,使得土传病原菌的活性受到激发,导致作物病害越发严重,形成连作障碍[8]。因此,探究有效缓解连作障碍的措施对太子参产业的可持续发展具有重要意义。【前人研究进展】目前,缓解作物连作障碍的措施主要有土壤灭菌、土壤改良、轮作和休耕等。在药用植物栽培中,药材道地性的要求决定了该类药材须在特定的区域内进行生长或种植[9−10]。但是,福建省太子参种植区域以山地居多,水旱轮作受限,大多数采取休耕措施,使得适宜太子参种植的耕地也日益减少。土壤改良通常采用增施有机肥、微生物肥和生物炭等措施改善土壤肥力,调整微生物群落结构,减缓连作障碍并实现增收[11−14]。近年来,基质栽培作为一种新兴的生态无土栽培技术,可有效地改善作物根系微环境和通气性,并且发挥促长防病和缓解连作障碍的作用,在设施蔬菜栽培中已广泛应用[15]。陈慕松等[16]采用栽培基质种植太子参,发现连作3年仍能有效阻止土传病害的发生,且产量未见明显降低。【本研究切入点】由于纯基质栽培成本高,水肥管理严格,使得目前采用栽培基质种植太子参的研究与应用仍然较少,栽培基质改良土壤对太子参根际土壤微生物群落结构影响也有待深入研究。【拟解决的关键问题】采用栽培基质替换太子参根围部分原土进行连作地块的土壤改良,并调查该措施对太子参的根腐病发病率、产量及根际土壤真菌群落变化的影响,分析内在相关性,以期为探索并建立太子参的可持续栽培模式,并为原位使用栽培基质改良土壤以缓解连作障碍和提高复种指数提供理论依据。
1. 材料与方法
1.1 试验材料
栽培基质购自厦门市江平生物基质技术股份有限公司,由基质化木纤维、发酵谷壳、泥炭和发酵菇渣等组成,N+P2O5+K2O≥3%、有机质≥45%、pH值5.5~6.5,用量为150 m3·hm−2;狮马复合肥15-15-15S型,购自中化化肥有限公司,用量为400 kg·hm−2;供试栽培品种为太子参柘参1号,为农户自留种,并剔除发病和破损种参,用量450 kg·hm−2。
1.2 试验地点
试验地位于福建省宁德市柘荣县(119°43'E, 27°05'N),气候温和湿润,年平均气温15.5 ℃,年总积温
5000 ~6500 ℃,年平均日照时数1634.2 h;年平均降水量为1600 ~2400 mm。3个代表性试验区块分别选在英山乡桦岭村(HL),山地、黄壤土;富溪镇富溪村(FX),水田地、砂壤土;城郊乡际头村(JT),水田地、黑壤土。不同田块的理化性质差异显著(表1)。表 1 不同地块土壤理化性质Table 1. Physicochemical properties of soils at different types of fields试验地块
Test field全氮
Total N/%全磷
Total P/(g·kg−1)全钾
Total K/(g·kg−1)有机质
organic matter/(g·kg−1)酸碱度
pHHL 0.06±0.01 b 0.45±16.05 c 10.76±0.77 b 8.39±0.12 b 5.18±0.11 a FX 0.07±0.01 b 0.78±13.32 b 14.42±0.86 a 8.90±0.44 b 4.07±0.07 b JT 0.14±0.00 a 1.21±36.06 a 14.08±1.07 a 17.37±0.46 a 5.38±0.13 a 同列不同小写字母表示差异显著(P<0.05)。HL、FX和JT分别代表桦岭村、富溪村和际头村试验地。下同。
Data with different lowercase letters on same column indicate significant difference (P<0.05). HL, FX, and JT refer to test fields at Hualing, Fuxi, and Jitou Villages, respectively. Same for below.1.3 试验设计
试验于2020~2022年在3个代表性试验区块开展,前一茬商品参收获后休耕5个月左右,于当年12月初再次种植。每个试验区块面积0.4 hm2,分别设置栽培基质处理组(T,简称基质处理组)和常规对照组(C,简称对照组)。每垄宽70 cm,垄间沟宽30 cm。每垄面上开2条深15 cm、上口宽17 cm左右的V型沟,并在沟底施入复合肥作为底肥。在V型沟两侧排放种参,株距5 cm。基质处理组(T)先用5 cm厚度的栽培基质覆盖底肥后排放种参,再用基质完全覆盖种参,最后覆盖10 cm厚度的原土;对照组(C)先用原土覆盖底肥后排放种参,继续用原土覆盖。每个处理重复3次,其他栽培管理措施均一致。
1.4 栽培基质改良对太子参根腐病发病率和产量的影响
3个试验区块分别进行太子参块根的根腐病发病率调查和产量测定。根腐病的症状和调查方法参照文献[6, 17]。根腐病典型症状见图1。发病率调查:于采收前10 d,挖取整株太子参,抖净粘连土块,调查根腐病发病块根数和总块根数,每个处理组采集6株(获得的有效块根数平均达100根以上)。产量测定:每个处理组取20 m2,于7月上旬采挖,收获的太子参洗净后,晾干至表面无水分后称取鲜重,并按柘荣地区太子参的通用折干率27%计算[18]。以上各调查项目均重复3次。块根发病率和干重产量计算公式如下。
块根发病率/%=(发病块根数/调查总块根数)×100 (1) 干重产量/(kg⋅hm−2)=每平方米鲜重产量(kg)×104×27% (2) 1.5 栽培基质改良对太子参根际土壤真菌菌落结构的影响
1.5.1 土壤样品采集
选择无法水旱轮作的英山乡桦岭村山地试验区块作为代表性田块,采用5点取样法分别于太子参出苗期(3月2日)、块根膨大期(5月2日)和采收期(7月2日)采集土壤。选择长势健壮的太子参植株,除去植株周边约5 cm表层土壤,将整株连根挖出,然后抖动去除与根系或块根结合较松的土壤,收集根系或块根上的土壤。每个样点取3株,将15株太子参根际土壤样品均匀混合后放入无菌袋中待用。每个处理组取3个重复。基质处理组(T)的出苗期、膨大期和采收期的土壤样品分别记为T3、T5和T7,对照组(C)样品分别记为C3、C5和C7。标记好的土壤样品立即放入液氮冻存,返回实验室保存于−80 ℃超低温冰箱。
1.5.2 土壤真菌群落结构的ITS高通量测序
采用E.Z.N.A. Soil DNA Kit(Omega Bio-tek, USA)试剂盒提取供试土壤样本的基因组DNA。使用Nanodrop 2000(ThermoFisher Scientific, USA)检测DNA浓度和纯度。以样品DNA为模板,进行真菌ITS1区测序,引物为ITS1(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2(5′-GCTGCGTTCTTCATCGATGC-3′)[19]。PCR 扩增体系为20 μL:5×Fast Pfu缓冲液4 μL,2.5 mol·L−1 dNTPs 2 μL,5 μmol·L−1上、下游引物各0.8 μL,Fast Pfu 聚合酶0.4 μL,20 ng ·μL−1模板DNA 1 μL,BSA(牛血清白蛋白)0.2 μL,灭菌ddH2O 10.8 μL。PCR反应程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃复性45 s,35个循环;最后72 ℃延伸10 min。PCR产物经2%琼脂糖凝胶电泳检测,纯化后送上海美吉生物医药科技有限公司利用Miseq PE300平台进行高通量测序,原始数据上传至NCBI SRA数据库。
1.5.3 太子参的根腐病发病率、产量与根际真菌的相关性分析
选择英山乡桦岭村山地试验区基质处理组(T)和对照组(C)的太子参发病率和产量,与该地块太子参采收期根际土壤中相对丰度位于前10的优势真菌属,采用Pearson相关系数法分析因子间的相关性。
1.5.4 数据处理与分析
剔除下机数据中的标签及引物序列,进行序列拼接得到原始数据。使用Usearch软件(Version 7.0)过滤和去嵌合体序列得到有效序列;利用Mothur软件(version v.1.30.1)绘制稀释度曲线,分析根际土壤真菌群落中物种的Coverage(覆盖度)、Sobs和Chao1(丰富度指数)、Shannon和Simpson(多样性指数)等指数;利用Uparse软件在97%相似性水平上进行OTUs聚类分析;利用RDP classifier软件和Silva数据库进行物种分类注释。将序列进行物种分类,对每个样本和每个物种进行序列丰度计算,并构建样本和物种分类单元序列丰度矩阵。基于物种分类,绘制门和属水平的群落柱形图、属水平的群落Heatmap图。其他数据采用DPS 20.05版软件的最小显著性差异法(LDS)进行方差分析。
2. 结果与分析
2.1 栽培基质改良对太子参根腐病发病率和产量的影响
发病率调查结果表明(图2a):基质处理组(T)在3个试验地块(桦岭村HL、富溪村FX和际头村JT)的根腐病发病率依次为8.76%、2.66%和6.70%,较对照组分别降低6.56%、4.84%和7.69%。产量测定结果表明(图2b):3个试验地块基质处理组的产量依次为
1921.50 、3753.00 、3087.00 kg·hm−2,较对照组分别提高109.31%、39.00%和80.53%。说明采用栽培基质改良土壤能显著降低太子参的根腐病发病率并提高产量,且对山地(HL)的改良效果最为显著。2.2 栽培基质改良对太子参根际土壤真菌菌落结构的影响
2.2.1 对土壤真菌群落多样性的影响
测序原始数据在NCBI SRA数据库的登录号为SRX26416204-SRX26416221,分析结果见表2。所有样品的测序覆盖度均大于0.99,表明测序结果能够真实地反映各样本的真菌群落情况。对照组C3和C5的Sobs指数均显著高于处理组T3和T5(P<0.05),Simpson和Shannon指数与处理组T3和T5的无显著差异(P>0.05);对照组C7的Chao1和Simpson指数显著低于处理组T7(P<0.05),而Shannon指数结果反之。说明太子参出苗期和膨大期的对照组真菌群落丰富度高于基质处理组,但多样性无显著差异;而采收期的对照组真菌群落丰富度降低且多样性升高。
表 2 太子参根际土壤真菌群落Alpha多样性指数Table 2. Alpha diversity of fungal communities in P. heterophylla rhizosphere取样时间Sampling time 样品编号Sample group 丰富度指数Richness index 多样性指数Diversity index 覆盖度Coverage Sobs Chao1 Simpson Shannon Coverage 出苗期 T3 433.33±39.82 b 506.72±52.79 a 0.12±0.02 a 3.14±0.18 a 0.998±0.000 a Seedling stage C3 607.33±32.68 a 658.19±19.23 a 0.11±0.06 a 3.66±0.43 a 0.998±0.000 a 膨大期 T5 386.33±29.59 b 608.16±53.87 a 0.14±0.05 a 2.88±0.25 a 0.997±0.000 a Expanding period C5 514.33±46.27 a 607.33±70.91 a 0.11±0.02 a 3.52±0.11 a 0.998±0.001 a 采收期 T7 447.33±31.42 a 614.59±18.27 a 0.33±0.02 a 2.29±0.09 b 0.997±0.000 a Harvest period C7 351.67±17.70 a 458.68±45.84 b 0.14±0.00 b 2.80±0.04 a 0.997±0.000 a 同一取样时间同列不同小写字母表示差异显著(P<0.05)。
Data with different lowercase letters on same column at same sampling time indicate significant difference (P< 0.05).2.2.2 对土壤真菌群落组成的影响
桦岭村山地试验区采集的2个处理组18个根际土壤样本测序后共注释到13个门、48个纲、118个目、279个科、597个属、946个种。
门水平的分析结果表明(图3):在基质处理组T和对照组C的根际土壤中检测到物种相对丰度大于1%的门有4个,分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)和毛霉门(Mucoromycota)。子囊菌门(Ascomycota)和担子菌门(Basidiomycota)在基质处理组和对照组的相对丰度均在85%以上,为优势真菌门。这两个门在太子参出苗期(T3、C3)和膨大期(T5、C5)根际土壤中的相对丰度较为稳定,但在对照组采收期(C7)根际土壤中的变化明显。
属水平的分析结果表明(图4):在基质处理组T和对照组C的根际土壤中检测到物种相对丰度大于1%的属有24个,其丰度比例超过60%。基质处理组的优势属为锥毛壳属(Coniochaeta)、假丝酵母菌属(Candida)、Gibellulopsis和青霉属(Penicillium)。锥毛壳属(Coniochaeta)和青霉属(Penicillium)是基质处理组出苗期(T3)的优势属,相对丰度分别为26.04%和15.33%,显著高于其他处理组(P<0.05);假丝酵母菌属(Candida)和Gibellulops分别是基质处理组膨大期(T5)和采收期(T7)的优势属,相对丰度分别为37.66%和55.83%,显著高于其他处理组(P<0.05)。对照组的优势属为Saitozyma、亚隔孢壳属(Didymella)、镰刀菌属(Fusarium)和附球菌属(Epicoccum)。Saitozyma在对照组出苗期(C3)和膨大期(C5)的相对丰度分别为24.81%和29.77%,显著高于基质处理组(P<0.05);亚隔孢壳属(Didymella)、镰刀菌属(Fusarium)和附球菌属(Epicoccum)在对照组采收期(C7)的相对丰度分别为29.61%、12.73%和9.55%,显著高于其他处理组(P<0.05)。茎点霉属(Phoma)在采收期(C7和T7)的相对丰度最高,分别为3.55%和5.11%,二者间差异不显著(P>0.05)。镰刀菌属(Fusarium)、亚隔孢壳属(Didymella)、附球菌属(Epicoccum)和茎点霉属(Phoma)等4个属是太子参生长期根腐病和叶斑病的关键病原菌,其丰度在对照组采收期的根际土壤样品中均显著升高,说明栽培基质改良土壤有利于调节土壤中的真菌群落结构,并抑制病原菌生长。
2.2.3 土壤中真菌群落的聚类分析
取丰度位于前20优势属的真菌物种进行Heatmap聚类分析(图5)。不同样品被聚为2类:对照组C3、C5和C7与基质处理组T3、T5和T7各自聚为1类,说明基质处理组和对照组的根际土壤真菌群落结构存在明显差异;其次,T3和T5、C3和C5又各自聚为1亚类,说明太子参出苗期和膨大期的物种群落结构较相似,采收期土壤中病原真菌数量的增加会改变其群落结构。不同物种被聚为3类:第一类仅包括Gibellulopsis,在基质处理组采收期(T7)中相对丰度最高;第二类包括树粉孢属(Oidiodendron)、锥毛壳属(Coniochaeta)、青霉属(Penicllium)、假丝酵母菌属(Candida)、毛壳菌属(Chaetomium)、Cephalotheca、单胞瓶梗孢子霉属(Phialemonium)等7个属,在基质处理组中的相对丰度高于对照组;第三类包括Saitozyma、未分类的真菌unclassified_k_Fungi、被孢霉属(Mortierella)、未分类的柔膜菌目unclassified_o_Helotiales、未分类的子囊菌门unclassified_p_Ascomycota、未分类的曲霉科unclassified_f_Aspergillaceae、Coniosporium、茎点霉属(Phoma)、亚隔孢壳属(Didymella)、篮状菌属(Talaromyces)、镰刀菌属(Fusarium)和附球菌属(Epicoccum)等12个属,在对照组中的相对丰度高于基质处理组。
![]() 图 5 太子参根际土壤真菌群落在属水平上的Heatmap图分析横向和纵向分别为各样本和各分类单元的聚类结果,红色和蓝色分别代表在对应样本中丰度较高和较低的属。Figure 5. Heatmap on fungal community at genus level in P. heterophylla rhizosphereClustering of samples is shown on x-axis and that of taxonomic units, on y-axis; samples of high abundance shown in red color and those of low abundance, in blue.
图 5 太子参根际土壤真菌群落在属水平上的Heatmap图分析横向和纵向分别为各样本和各分类单元的聚类结果,红色和蓝色分别代表在对应样本中丰度较高和较低的属。Figure 5. Heatmap on fungal community at genus level in P. heterophylla rhizosphereClustering of samples is shown on x-axis and that of taxonomic units, on y-axis; samples of high abundance shown in red color and those of low abundance, in blue.2.3 太子参的根腐病发病率、产量与根际真菌的相关性分析
桦岭村山地试验区(HL)的发病率、产量与该地块采收期根际土壤优势真菌属的相关性分析表明(图6):根腐病的发病率与Gibellulopsis呈负相关(R=−
0.9095 ,P<0.05),与镰刀菌属(Fusarium)呈正相关(R=0.9802 ,P<0.001);太子参产量与Gibellulopsis呈正相关(R=0.9559 ,P<0.05),与镰刀菌属(Fusarium)呈负相关(R=−0.95013 ,P<0.01)。此外,根腐病的发病率、产量与亚隔孢壳属(Didymella)、附球菌属(Epicoccum)、篮状菌属(Talaromyces)和枝孢霉属(Cladosporium)等属也具有相关性。说明栽培基质改良土壤不仅能显著降低根腐病原菌镰刀菌属的丰度,也能降低其他潜在病原菌的丰度。3. 讨论与结论
栽培基质因含有丰富的有机质和适宜作物生长的营养元素,被广泛用于设施作物的无土栽培。基质栽培能促进作物生长、提高作物抗逆性和抗病性,并增加作物产量和耕地种植指数。陈慕松等[16]研究发现采用基质栽培太子参连作3年的产量较田园土的对照组增产113%。本研究结果也表明,采用栽培基质替换太子参根围部分原土,根腐病的发病率降低了4.84%~7.69%,产量提高了39.00%~109.31%,特别是对有机质含量较低和无法水旱轮作的山地土壤改良效果显著。其中,根腐病发病率降低是太子参增产的重要原因之一。根腐病原菌在作物生长早期易从幼嫩根系侵入、破坏根系生长,对以根及根茎入药的药材影响巨大[20]。本研究采用栽培基质替换太子参根围部分原土,隔离已产生连作障碍的土壤,能够改善根部生长环境,并有效防控土传病害,显著提高产量。
栽培基质的松散颗粒结构、丰富的有机质和土壤性质的改善可为微生物生长提供适宜的环境。土壤中的微生物通过参与有机质转化、养分循环和生物修复,在维持土壤功能方面也发挥着重要作用[21]。土壤中微生物的群落结构组成与作物的生长和产量密切相关,通过增施有机肥、生物炭和微生物肥等措施能调节作物根际土壤的真菌群落结构,并促进增产[22−23]。本研究以改良效果最佳的桦岭村山地试验区块作为代表性田块,发现栽培基质改良土壤的措施能够显著改变太子参根际真菌的种类和群落结构。该措施能提高子囊菌门真菌的丰度、降低担子菌门真菌的丰度,与管鸿智等[24]和罗俊等[25]的研究结果一致。锥毛壳属、青霉属、假丝酵母菌属和Gibellulopsis分别为基质处理组不同生长阶段的优势菌属且动态变化显著,可能与不同生长季节的温湿度、基质营养成份和太子参不同生长阶段根际分泌物有关。锥毛壳属真菌广泛存在于森林、农田和水体等生境中[26]。青霉属的许多种类是植物病害的生防菌,仅少数种类可引起植物病害[5]。假丝酵母菌属的部分种是食品和堆肥的发酵菌[27−28]。桂莎等[29]利用复合菌剂防控香蕉枯萎病的研究中发现,施用复合菌剂能显著提高Gibellulopsis属相对丰度,且其丰度与香蕉枯萎病病情指数显著负相关。本研究同样发现Gibellulopsis属在太子参采收期的土壤样本中为优势属,且能显得降低多种关键病原菌的相对丰度。因此,后续研究可以针对性地分离筛选Gibellulopsis属真菌并进行连作障碍修复产品的开发。
采用栽培基质改良土壤除了增加潜在的有益菌属丰度外,还能降低太子参生长过程中关键病原菌的丰度。如镰刀菌属是作物根腐病的主要病原菌,在连作地中其数量会显著增加[7, 30]。姜婷婷等研究发现土壤改良剂能够降低苹果种植过程中镰刀菌属的丰度[31]。本研究同样发现栽培基质改良土壤能降低太子参种植过程的镰刀菌属丰度,且其丰度与根腐病的发病率呈正相关,与产量呈负相关。亚隔孢壳属、茎点霉属和附球菌属可引起作物叶斑病[32−34],本研究发现这3个属在太子参采收期对照组的丰度显著增加。太子参采收期对照组的关键病原菌种类增加且丰度升高,说明病害的加重会造成土壤中真菌群落的多样性升高和丰富度降低;而基质处理组真菌群落的丰富度升高和多样性降低,且优势菌属的丰度显著增加,可能更有利于抑制病原真菌的种类和数量。
综上所述,本研究采用栽培基质替换太子参根围部分原土进行连作地块土壤改良是一种新的种植模式,能够降低太子参根腐病的发病率、调节根际微生物的群落结构并提高产量,有效缓解连作障碍。因此,后续将扩大试验区域,进一步研究该栽培基质改良措施对不同土壤类型的太子参连作障碍改良效果及其机制,以期获得更加全面的效果评价,进而指导生产。
-
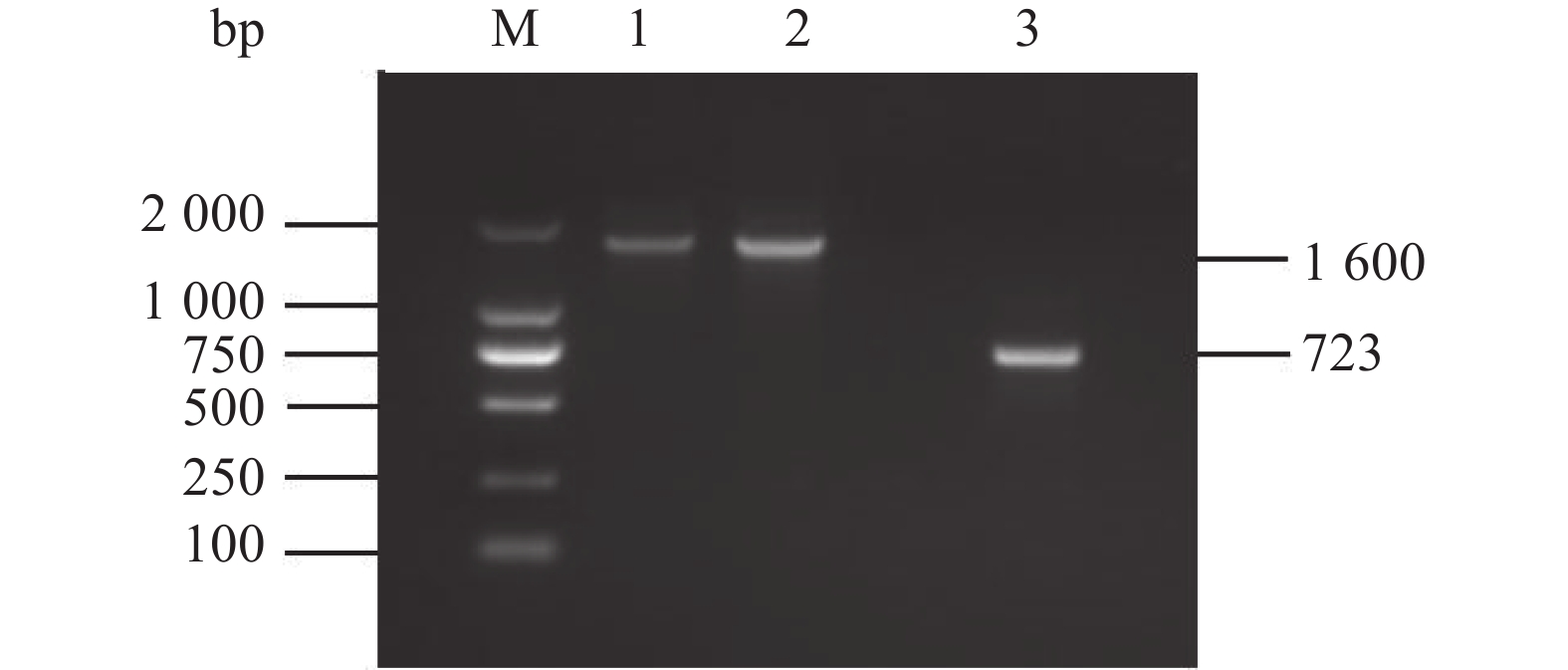
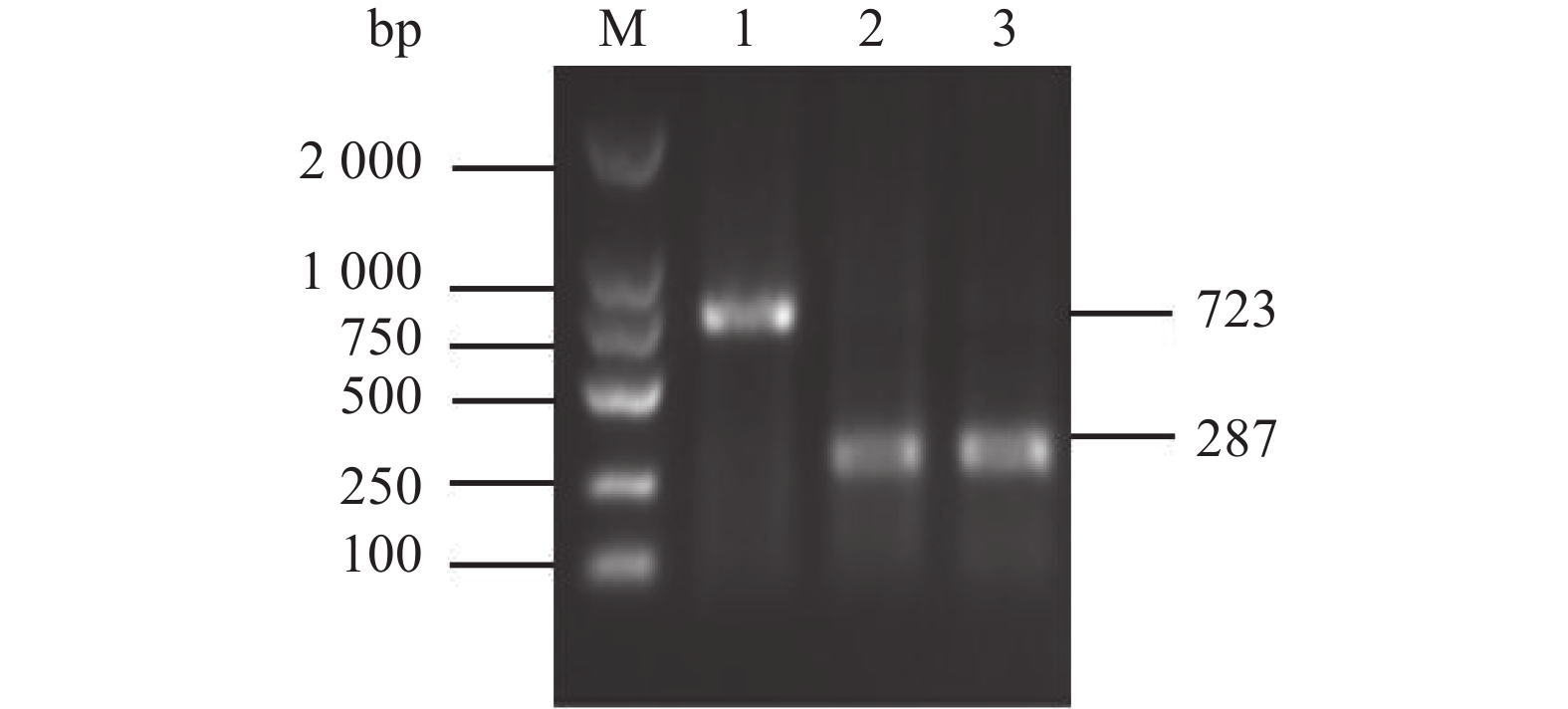
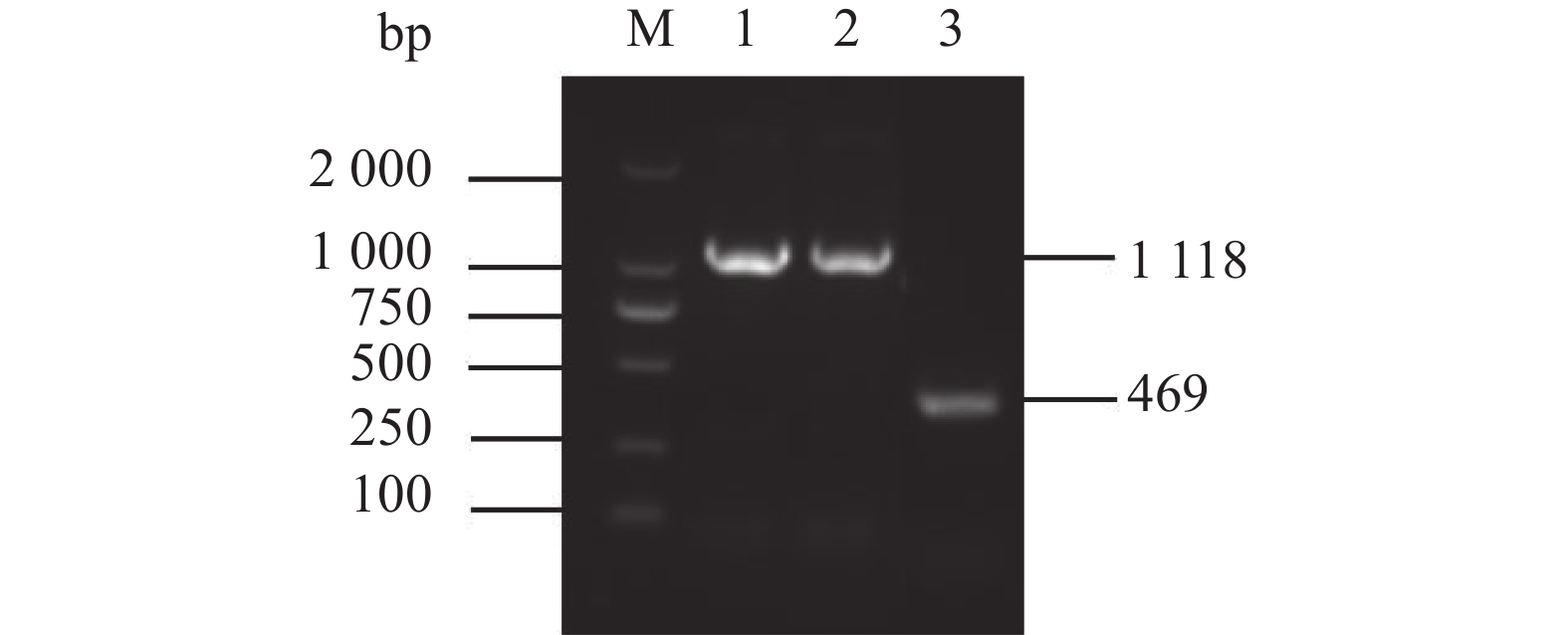
图 3 WTΔyibTΔcsgD/pcsgD和WTΔcsgD/pcsgD的PCR鉴定
M:D2000 Marker;1:WTΔyibTΔcsgD/pcsgD的PCR产物;2:WTΔcsgD/pcsgD的PCR产物;3:转入空质粒pET28a的菌 PCR产物。
Figure 3. PCR identification for WTΔyibTΔcsgD/pcsgD and WTΔcsgD/pcsgD
M: D2000 marker; 1: PCR product of WTΔyibTΔcsgD/pcsgD; 2: PCR product of WTΔcsgD/pcsgD; 3: PCR product of bacteria transferred to empty plasmid pET28a.
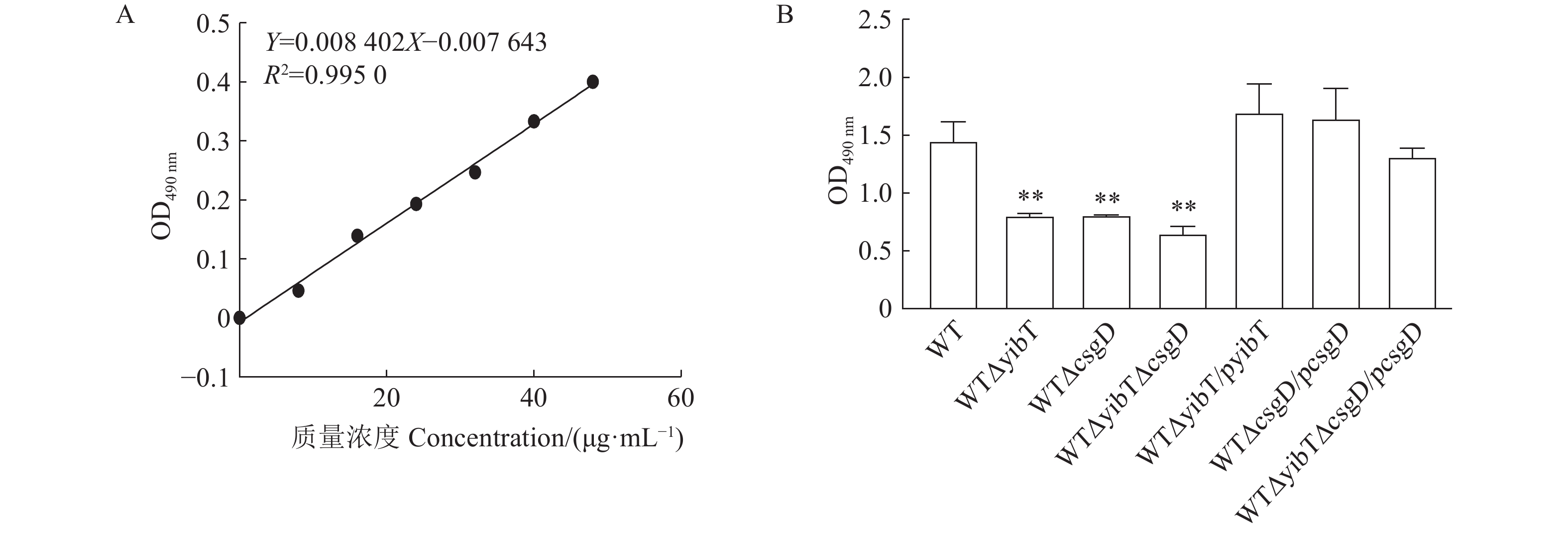
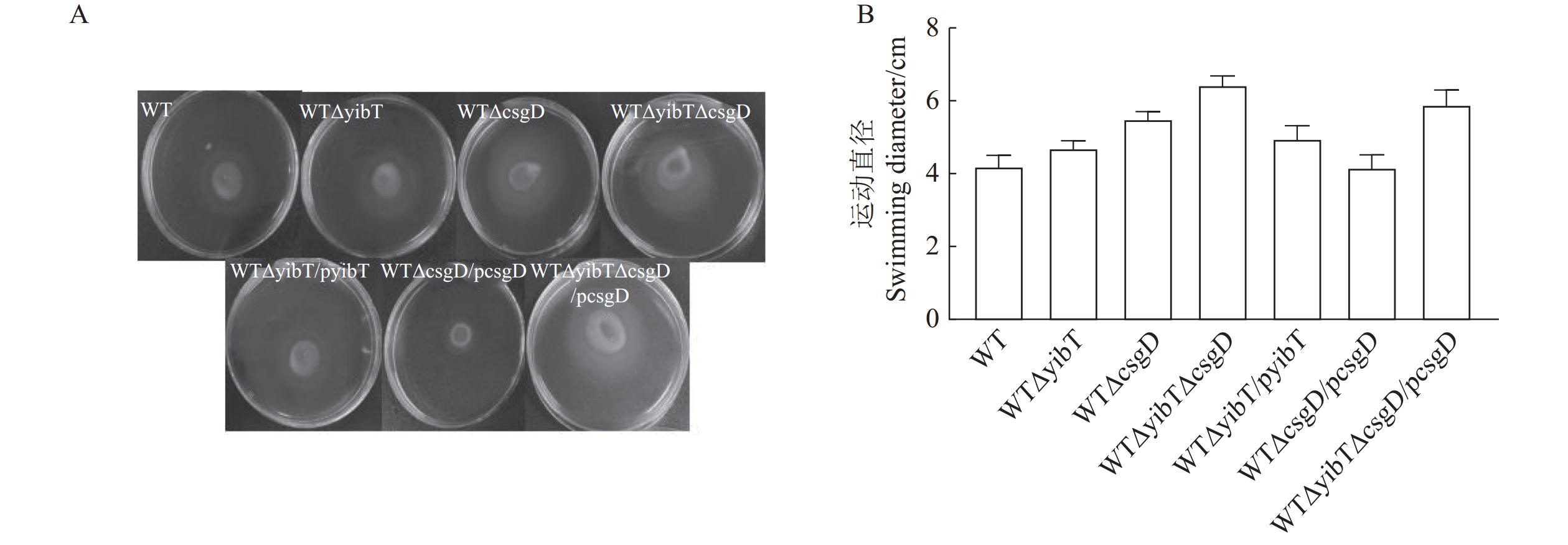
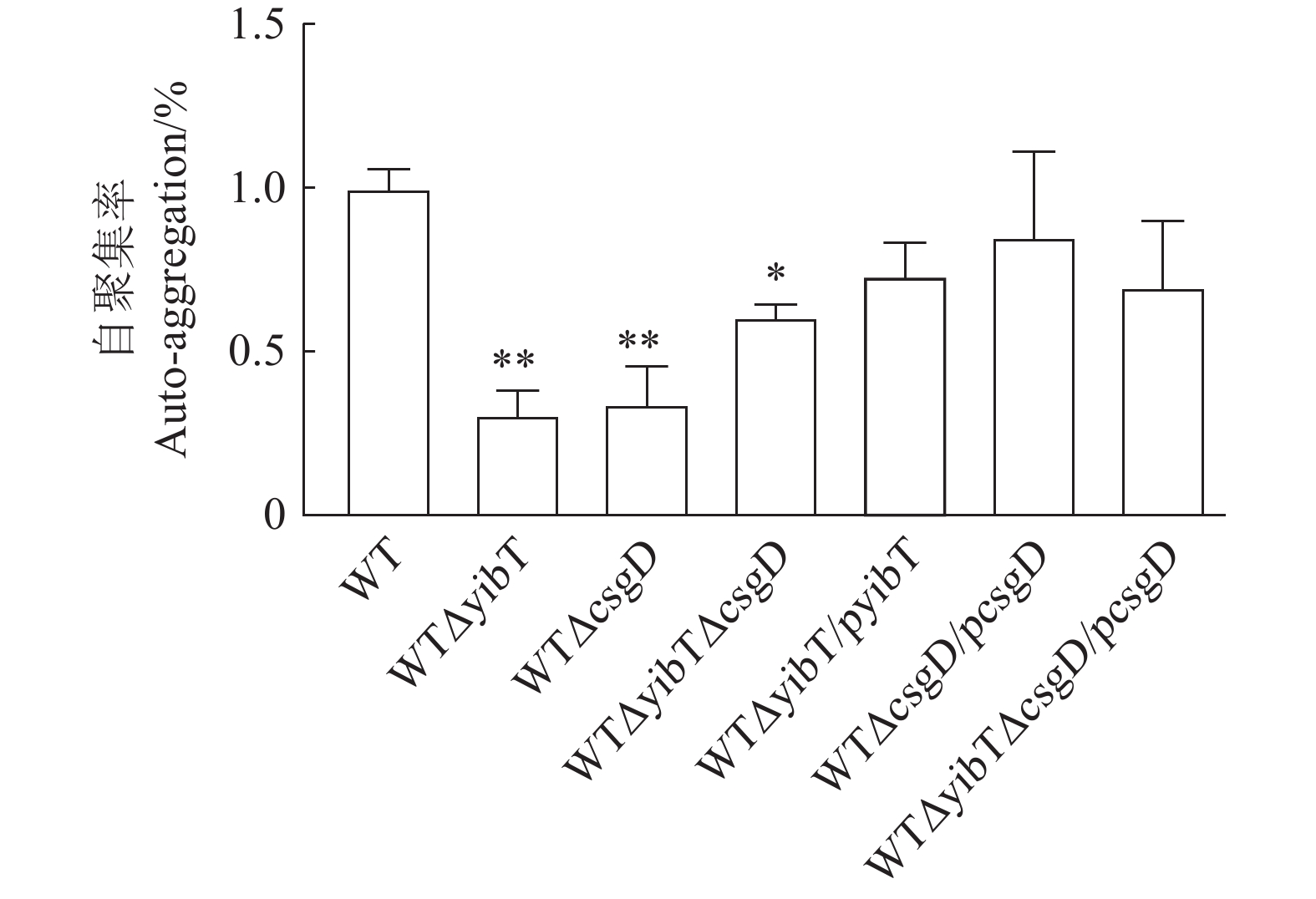
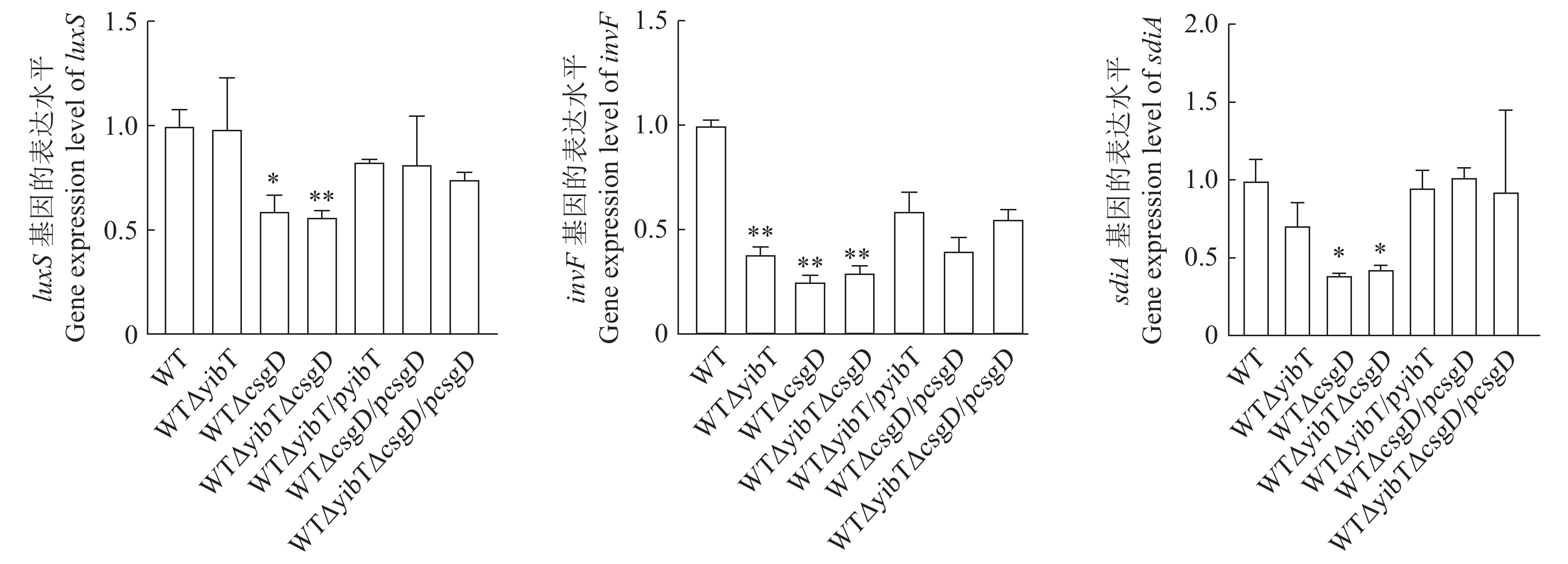
图 4 鼠伤寒沙门菌突变株的生物膜形成
A:试管法测定生物膜能力;B:二十四孔板测定生物膜能力;C:生物膜的结晶紫量化。*表示与WT差异显著(P<0.05),**表示与WT差异极显著(P<0.01)。下同。
Figure 4. Biofilm formation of S. typhimurium mutants
A: test tube method for determining biofilm formation; B: 24-well plates for determining biofilm formation; C: crystal violet quantization of biofilm. Results are comparisons with WT; *: significant difference at P<0.05; **: extremely significant difference at P<0.01. Same for below.
表 1 PCR扩增引物
Table 1 Primers applied for PCR
引物名称
Primer names引物序列5′-3′
Primer sequences引物长度
Primer length/bp反应长度
Reaction length/bpP1 TTTCATCATGTTTAATGAAGTCCATAGTAGTCATGGTCAGTGTAGGCTGGAGCTGCTTC 59 1600 P2 ATCTTTTTGAAAAGATTATAAAGATGTGTCTTAACCGTACATATGAATATCCTCCTTAG 59 P3 GCTGTCAGATGTGCGATT 18 723 P4 TGCTACAATCCAGGTCAGA 19 P5 CCGCTCGAGCCGCCTGAGATTATCGTTTG 29 649 P6 CGCGGATCCATGTTTAATGAAGTCCATAG 29 P7 CAGCCAGGCGTTCCGTGAAT 20 469 P8 AGCCGCCGGTAATATTCCAGAC 22 表 2 荧光定量PCR引物序列
Table 2 Primers applied for qRT-PCR
引物名称
Primer names引物序列5′-3′
Primer sequences引物长度
Primer length/bpluxS-F ACTGATGGGCTGCCTGTATC 20 luxS-R
sdiA-F
sdiA-R
invF-F
invF-R
16S-F
16S-RGCCTCTTCGCTATTACGCCA
ATGAAGCGAAGGCGATGT
CGAGGAGCAGCGTAAACT
ACGATGAGAATGCTGGGAGA
TATGTGAAGGCGATGAGTAAC
TTACCCGCAGAAGAAGCACC
CTCAAGGGCACAACCTCCAA20
18
18
20
20
20
20 -
[1] TOBOLOWSKY F A, CUI Z H, HOEKSTRA R M, et al. Salmonella serotypes associated with illnesses after thanksgiving holiday, United States, 1998-2018 [J]. Emerging Infectious Diseases, 2022, 28(1): 210−213. DOI: 10.3201/eid2801.211986
[2] JERTBORN M, HAGLIND P, IWARSON S, et al. Estimation of symptomatic and asymptomatic Salmonella infections [J]. Scandinavian Journal of Infectious Diseases, 1990, 22(4): 451−455. DOI: 10.3109/00365549009027077
[3] LAN Y B, WANG S Z, YIN Y G, et al. Using a surface plasmon resonance biosensor for rapid detection of Salmonella typhimurium in chicken carcass [J]. Journal of Bionic Engineering, 2008, 5(3): 239−246. DOI: 10.1016/S1672-6529(08)60030-X
[4] BORIPUN R, SAENGSAWANG P, INTONGEAD S, et al. Molecular characterization and nucleotide substitution of antibiotic resistance genes in multidrug-resistant Escherichia coli isolated from environmental swine farms [J]. Emerging Contaminants, 2023, 9(4): 100249. DOI: 10.1016/j.emcon.2023.100249
[5] KURTZ J R, GOGGINS J A, MCLACHLAN J B. Salmonella infection: Interplay between the bacteria and host immune system [J]. Immunology Letters, 2017, 190: 42−50. DOI: 10.1016/j.imlet.2017.07.006
[6] CHEN L, GU L P, GENG X F, et al. A novel Cis antisense RNA AsfD promotes Salmonella enterica serovar Typhi motility and biofilm formation [J]. Microbial Pathogenesis, 2020, 142: 104044. DOI: 10.1016/j.micpath.2020.104044
[7] JEFFERSON K K. What drives bacteria to produce a biofilm? [J]. FEMS Microbiology Letters, 2004, 236(2): 163−173. DOI: 10.1111/j.1574-6968.2004.tb09643.x
[8] RÖMLING U, ROHDE M, OLSÉN A, et al. AgfD, the checkpoint of multicellular and aggregative behaviour in Salmonella typhimurium regulates at least two independent pathways [J]. Molecular Microbiology, 2000, 36(1): 10−23. DOI: 10.1046/j.1365-2958.2000.01822.x
[9] JAMES G, SWOGGER E, WOLCOTT R, et al. Biofilms in chronic wounds [J]. Wound Repair and regeneration, 2008, 16(1): 37−44. DOI: 10.1111/j.1524-475X.2007.00321.x
[10] HAESLER E, SWANSON T, OUSEY K, et al. Clinical indicators of wound infection and biofilm: Reaching international consensus [J]. Journal of Wound Care, 2019, 28(Sup3b): s4−s12. DOI: 10.12968/jowc.2019.28.Sup3b.S4
[11] LIU J L, JIA R, ZHOU E Z, et al. Antimicrobial Cu-bearing 2205 duplex stainless steel against MIC by nitrate reducing Pseudomonas aeruginosa biofilm [J]. International Biodeterioration & Biodegradation, 2018, 132: 132−138.
[12] LI W K, ZHENG T L, MA Y Q, et al. Current status and future prospects of sewer biofilms: Their structure, influencing factors, and substance transformations [J]. Science of the Total Environment, 2019, 695: 133815. DOI: 10.1016/j.scitotenv.2019.133815
[13] OJIMA-KATO T, YAMAMOTO N, NAGAI S, et al. Application of proteotyping Strain Solution™ ver. 2 software and theoretically calculated mass database in MALDI-TOF MS typing of Salmonella serotype [J]. Applied Microbiology and Biotechnology, 2017, 101(23/24): 8557−8569.
[14] FUKUYAMA Y, OJIMA-KATO T, NAGAI S, et al. Improved MALDI-MS method for the highly sensitive and reproducible detection of biomarker peaks for the proteotyping of Salmonella serotypes [J]. Journal of Mass Spectrometry, 2019, 54(12): 966−975. DOI: 10.1002/jms.4469
[15] SI H M, ZHANG F, WU A N, et al. DNA microarray of global transcription factor mutant reveals membrane-related proteins involved in n-butanol tolerance in Escherichia coli [J]. Biotechnology for Biofuels, 2016, 9: 114. DOI: 10.1186/s13068-016-0527-9
[16] WANG Z Q, XUE T L, HU D S, et al. A novel butanol tolerance-promoting function of the transcription factor rob in Escherichia coli [J]. Frontiers in Bioengineering and Biotechnology, 2020, 8: 524198. DOI: 10.3389/fbioe.2020.524198
[17] 岳敏, 赵威, 王涛, 等. YibT介导鼠伤寒沙门氏菌生物膜形成的分子机制研究 [J]. 动物医学进展, 2022, 43(6):46−51. DOI: 10.3969/j.issn.1007-5038.2022.06.009 YUE M, ZHAO W, WANG T, et al. Molecular regulatory mechanism of biofilm formation of Salmonella mediated by protein yibT [J]. Progress in Veterinary Medicine, 2022, 43(6): 46−51. (in Chinese) DOI: 10.3969/j.issn.1007-5038.2022.06.009
[18] 王涛, 赵威, 裴芳樱, 等. 鼠伤寒沙门菌yibT基因缺失株的构建及其生物学特性分析 [J]. 中国兽医科学, 2020, 50(3):338−345. WANG T, ZHAO W, PEI F Y, et al. Construction of a Salmonella typhimurium CVCC541 ΔyibT strain and study on its biological characteristics [J]. Chinese Veterinary Science, 2020, 50(3): 338−345. (in Chinese)
[19] MANGWANI N, KUMARI S, DAS S. Bacterial biofilms and quorum sensing: Fidelity in bioremediation technology [J]. Biotechnology & Genetic Engineering Reviews, 2016, 32(1/2): 43−73.
[20] RUPP M E, ULPHANI J S, FEY P D, et al. Characterization of the importance of polysaccharide intercellular adhesin/hemagglutinin of Staphylococcus epidermidis in the pathogenesis of biomaterial-based infection in a mouse foreign body infection model [J]. Infection and Immunity, 1999, 67(5): 2627−2632. DOI: 10.1128/IAI.67.5.2627-2632.1999
[21] OBE T, NANNAPANENI R, SHARMA C S, et al. Homologous stress adaptation, antibiotic resistance, and biofilm forming ability of Salmonella enterica serovar Heidelberg ATCC8326 on different food-contact surfaces following exposure to sublethal chlorine concentrations1 [J]. Poultry Science, 2018, 97(3): 951−961. DOI: 10.3382/ps/pex346
[22] HE S K, ZHAN Z Q, SHI C L, et al. Ethanol at subinhibitory concentrations enhances biofilm formation in Salmonella enteritidis [J]. Foods, 2022, 11(15): 2237. DOI: 10.3390/foods11152237
[23] GOMES L C, MERGULHÃO F J. SEM analysis of surface impact on biofilm antibiotic treatment [J]. Scanning, 2017, 2017: 2960194.
[24] AKIYAMA H, HUH W K, YAMASAKI O, et al. Confocal laser scanning microscopic observation of glycocalyx production by Staphylococcus aureus in mouse skin: Does S. aureus generally produce a biofilm on damaged skin? [J]. British Journal of Dermatology, 2002, 147(5): 879−885. DOI: 10.1046/j.1365-2133.2002.04962.x
[25] KALAI CHELVAM K, CHAI L C, THONG K L. Variations in motility and biofilm formation of Salmonella enterica serovar Typhi [J]. Gut Pathogens, 2014, 6(1): 2. DOI: 10.1186/1757-4749-6-2
[26] RAMESH N, JOSEPH S W, CARR L E, et al. Evaluation of chemical disinfectants for the elimination of Salmonella biofilms from poultry transport containers [J]. Poultry Science, 2002, 81(6): 904−910. DOI: 10.1093/ps/81.6.904
[27] KARYGIANNI L, REN Z, KOO H, et al. Biofilm matrixome: Extracellular components in structured microbial communities [J]. Trends in Microbiology, 2020, 28(8): 668−681. DOI: 10.1016/j.tim.2020.03.016
[28] MAN L L, XIANG D J. Effect of Lu xS/AI-2-mediated quorum sensing system on bacteriocin production of Lactobacillus plantarum NMD-17 [J]. Folia Microbiologica, 2023, 68(6): 855−866. DOI: 10.1007/s12223-023-01060-0
[29] CHOI J, SHIN D, KIM M, et al. LsrR-mediated quorum sensing controls invasiveness of Salmonella typhimurium by regulating SPI-1 and flagella genes [J]. PLoS One, 2012, 7(5): e37059. DOI: 10.1371/journal.pone.0037059
[30] CARNEIRO D G, ALMEIDA F A, AGUILAR A P, et al. Salmonella enterica optimizes metabolism after addition of acyl-homoserine lactone under anaerobic conditions [J]. Frontiers in Microbiology, 2020, 11: 1459. DOI: 10.3389/fmicb.2020.01459




 下载:
下载: