Genetic Diversity and Principal Components of Tea Germplasms from Shiting Plantations in Nan'an
-
摘要:目的
深入了解南安石亭群体种茶树种质资源(Camellia sinensis)的遗传多样性及其直接利用价值,为南安石亭群体种茶树种质资源的创新利用提供科学依据。
方法利用SNP分子标记技术对17份南安石亭群体种茶树种质资源及福建6个代表性品种进行亲缘关系及遗传多样性分析。进一步采用高效液相色谱法(HPLC)和超高效液相色谱-串联质谱法(UPLC-MS/MS)测定代表性的10份南安石亭群体种茶树种质资源儿茶素及游离氨基酸等组分含量。
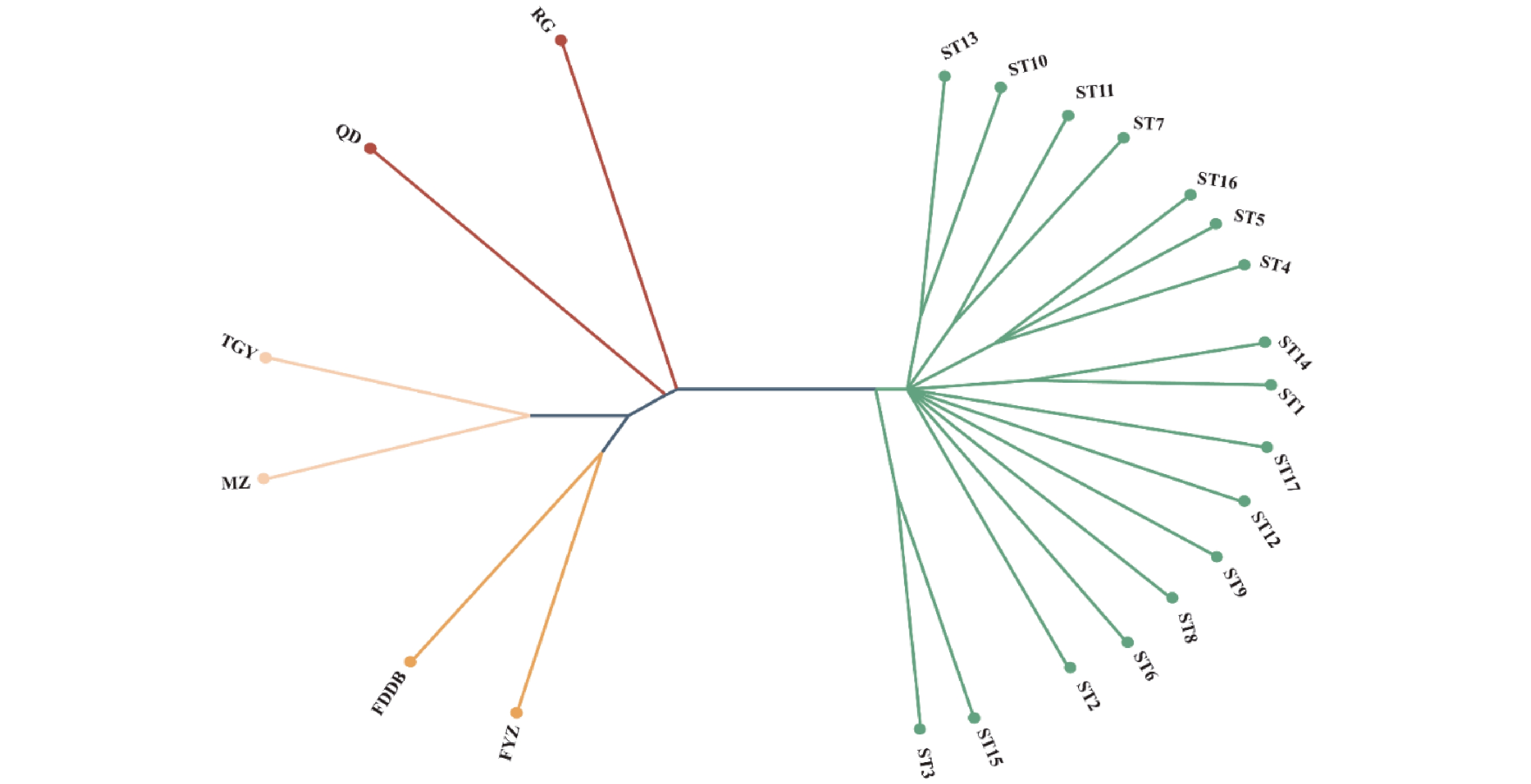
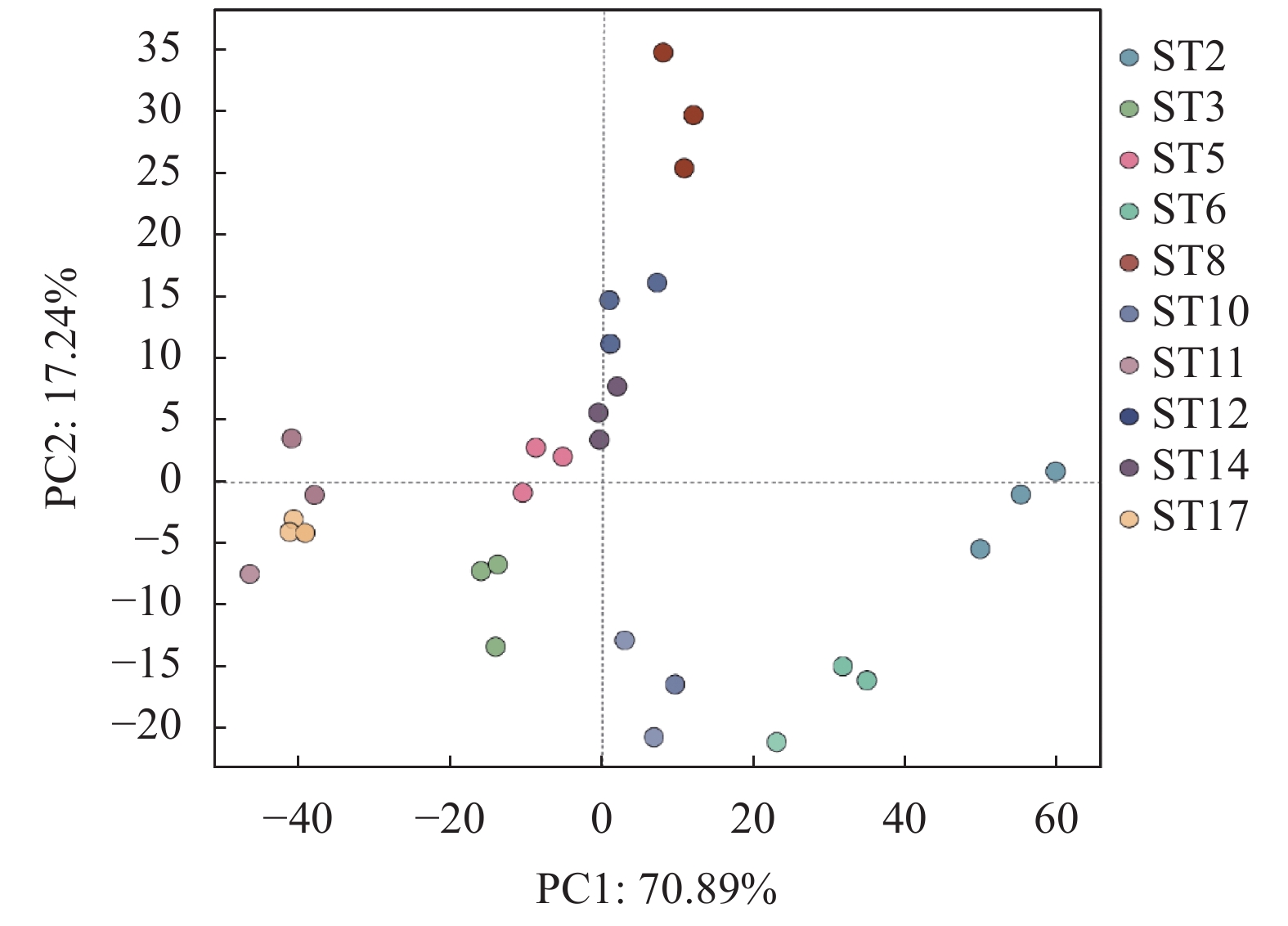
结果筛选出44个适用于鉴定南安石亭群体种茶树种质资源的SNP位点,构建南安石亭群体种茶树种质资源SNP指纹图谱。通过UPGMA进化树构建,发现23个样品可分为4个亚群,南安石亭群体种茶树种质资源与闽北地区的肉桂、奇丹亲缘关系较近。此外,进行了氨基酸,儿茶素含量分析,发现南安石亭群体种茶树种质资源的主要品质成分含量差异显著(P<0.05)。儿茶素总量为107.55~177.47 mg·g−1,游离氨基酸总量为8.35~32.32 mg·g−1。其中ST2、ST3、ST6、ST17种质具有较高的EGCG或EGCG3"Me含量,ST3种质氨基酸含量最高、儿茶素苦涩味指数最低。
结论南安石亭群体种茶树种质资源丰富,与闽北地区茶树资源亲缘关系较为亲密。ST2、ST3、ST6和ST17具有较高的EGCG或EGCG3"Me含量,ST3适制绿茶,可进一步开展选育工作。
Abstract:ObjectiveGenetic diversity of the tea germplasms preserved at Shiting plantations in Nan’an was studied for promoting the utilization of the local specialty.
MethodsSNP molecular marker technology was applied to analyze the genetic diversity and relationships of 17 tea germplasms from the Shiting plantations and 6 representative varieties from Fujian. HPLC and UPLC-MS/MS were employed to determine the contents of catechins and free amino acids in 10 selected samples for a comparison among the tea varieties.
ResultsForty-four SNP loci suitable for identifying the tea plants were selected. An SNP fingerprint profile of the germplasms was constructed. The UPGMA evolutionary tree divided the 23 germplasms into 4 subgroups, which showed a close relation with Rougui and Qidan teas from northern Fujian. Significant differences were found on the contents of major amino acids and catechins among the varieties (P<0.05) with total free amino acids from 8.46 mg·g−1 to 32.66 mg·g−1 and catechins ranging from 107.56 mg·g−1 to 177.60 mg·g−1. The germplasms coded ST2, ST3, ST6, and ST17 had high contents of EGCG or EGCG3"Me, while ST3 the most on amino acids and the least on catechin bitterness index.
ConclusionShiting plantations in Nan’an had a rich collection of tea germplasms that were closely related to those in northern Fujian. Among them, ST2, ST3, ST6, and ST17 teas had high contents of either EGCG or EGCG3"Me. ST3, specifically, appeared to be suitable for making green tea as well as in breeding programs.
-
Keywords:
- Shiting, Nan’an /
- Camellia sinensis /
- germplasm /
- genetic diversity /
- component analysis /
- SNP
-
茶树修剪是通过人为剪除部分枝条,改变茶树自然生长的分枝习性,使树冠向外围空间伸展,促进营养生长,塑造理想树形,并去除顶端优势,增加芽叶萌发,延长茶树经济年龄的一种通用方法[1]。修剪对茶树养分分配,根、茎比平衡,鲜叶生化成分等均会产生重要影响[2]。对以采摘嫩芽叶为主要经济目标的人工生态系统,茶园修剪枝叶往往作为废弃物而未引起足够重视,尤其在茶园生态系统中的服务功能与作用更鲜见研究报道。茶树经人为修剪后枝叶自动凋落而覆盖地表,故可借鉴生态系统“凋落物”的概念,对茶园生态系统凋落物的生态服务功能进行研究。
凋落物(Litter)又称枯落物或有机碎屑,是指生态系统内由地上植物组分产生并归还到地表,作为分解者的物质和能量来源,借以维持生态系统功能的所有有机质的总称[3-4]。凋落物的存在不仅可以减少对土壤的溅击侵蚀,亦能阻滞地表径流对土壤的冲蚀;还可促进土壤和大气之间的水分交换,有利于保持水分,减少地表蒸发,因而具有水土保持与水源涵养的功能[5]。同时凋落物的分解对生态系统的物质循环和养分平衡方面作用亦不小觑[6]。在茶园方面,吕文等[7]研究发现3、4年生茶树经修剪后的蒸散速率均大幅下降,分别降低了36.73%、48.32%,其原因不仅与茶株高度降低,导致界面层导度减小,减少水分从茶株向大气的传输有关。且与茶园经修剪后,凋落的枝、叶覆盖在茶行间,增加了行间的土壤遮蔽,降低了土壤的蒸发作用有关。由此可知,修剪能对茶园生态系统的水文功能产生一定影响。
日前鲜见有关茶园修剪枝叶作为凋落物,对其所具备生态水文功能的研究与报道。因此,本研究借鉴生态系统凋落物的概念,探讨不同修剪模式对茶树修剪枝、叶的产生量;并采用室内持水模拟试验对其持水特性进行研究,旨在揭示不同修剪模式茶树修剪凋落物及其组分的持水特性与拦蓄能力,以期为茶园生态系统水土保持、水源涵养功能的定量化研究与评估提供理论基础和科学依据。
1. 材料与方法
1.1 试验地概况
试验茶园位于福建省福安市社口镇,福建省农业科学院茶叶研究所2号山,地处119°34′E、27°13′N,属丘陵坡地,海拔约70 m,年无霜期285 d,年均降雨量1 646 mm,年均气温19.3℃,为典型的中亚热带季风气候。
1.2 试验设计
供试茶树品种黄观音,树龄14年,种植密度约55 000株·hm-2,树高约110 cm,树幅60 cm × 80 cm,生长较均匀一致。试验按照茶园惯用修剪方式,设不同修剪深度处理3个,分别为重度修剪(树冠面下约20 cm处平剪)、中度修剪(15 cm处平剪)和轻度修剪(7 cm处平剪)处理。每处理小区长为12 m、面积约15 m2,3个区组重复。修剪机具为单人修剪机(川崎牌PST80H)。
1.3 试验方法
1.3.1 修剪枝生物量统计
采用人工分拣,将每处理小区修剪枝收集完全,称重,计算生物量鲜重(fresh weight,FW);随后将一部分修剪物,分离枝、叶,统计枝叶比;并放置室内自然风干,风干时称重,计算自然含水率(Ro);将各小区自然风干后的枝、叶,分别置于80℃恒温干燥箱内烘干至恒重,称重,计算含水率和生物量干重(dry weight,DW),并换算成1 hm2茶园的修剪枝生物量。
1.3.2 修剪物持水特性测定
分别扦取一定量3个修剪处理的茶树枝叶,称重后装入15 cm×30 cm的尼龙网袋,进行0.5、1、1.5、2、4、6、8、10、12、16、24 h浸水处理,随后取出,静止5 min至修剪枝叶不滴水时分别称重,计算修剪枝叶不同浸水时间的持水量、持水率与吸水速率[8-9]。借鉴森林凋落物水文特征相关计算公式[10-13],进行茶树修剪凋落物持水特性、拦蓄能力的相关计算。
持水率R/%=[(浸泡t时间的凋落物重Wt-凋落物烘干重W0)/凋落物烘干重W0] ×100%
持水量Q/(t·hm-2)= 凋落物现存量M×凋落物持水率R
吸水速率V1/(g·g-1·h-1)=(浸泡时间的凋落物重Wt-凋落物烘干重W0)/(凋落物烘干重W0×浸泡时间t)
最大持水率Rm/%= 凋落浸泡24 h中最大持水率Rx
最大持水量Q/(t·hm-2)= 最大持水率Rm×凋落物现存量M
最大拦蓄率Lr/% = 最大持水率Rm-自然含水率R0
最大拦蓄量L/(t·hm-2)= 最大拦蓄率Lr×凋落物现存量M
有效拦蓄率W/% = 0.85Rm-自然含水率R0
有效拦蓄量L2/(t·hm-2)= 有效拦蓄率W×凋落物现存量M
1.4 数据分析
数据经Excel 2010处理;采用SPSS 22.0中单因素方差分析(One-Way ANOVA)的LSD(Least significant difference)法进行显著性分析;Origin Pro 8.5.1软件作图。
2. 结果与分析
2.1 不同修剪深度对茶树修剪凋落物生物量的影响
由表 1可知,不同修剪深度处理的修剪枝叶生物量,无论是总量、叶、枝的鲜重(FW),还是总量、叶、枝的干重,均表现为重度修剪>中度修剪>轻度修剪,其总量、叶、枝的鲜重,3个处理间的差异均达到显著水平,而总量、叶、枝的干重,处理间的差异,表现为轻度修剪与中度修剪、重度修剪之间差异显著,而中度修剪与重度修剪之间却无显著差异。在生物重构成上,鲜重和干重均表现为叶>枝,其中叶鲜重占比为65.27%~75.82%,叶干重占比降为62.24%~70.86%;枝叶干重仅为鲜重的33.62%~39.09%;茶枝修剪物烘干后,叶枝比值下降明显,降幅达12.23%~22.36%,且有随修剪深度的增大而下降的趋势,这与不同深度修剪枝叶的含水量差异有关,修剪深度越深,修剪枝叶的平均含水率越低。
表 1 不同修剪深度对茶树修剪枝叶生物量的影响Table 1. Biomass of leaf- and stem-clippings produced by various pruning practices处理 生物量-鲜重/(t·hm-2) 生物量-干重/(t·hm-2) 含水率
/%总量 叶 枝 叶/枝比 总量 叶 枝 叶/枝比 轻度修剪 4.59±0.07a 3.48±0.18a 1.11±0.18a 3.13±0.71 1.75±0.02a 1.24±0.04a 0.51±0.04a 2.43±0.27 66.38±5.27 中度修剪 6.48±0.05b 4.45±0.07b 2.03±0.07b 2.19±0.11 2.38±0.02b 1.53±0.04b 0.85±0.04b 1.80±0.12 63.25±0.25 重度修剪 7.40±0.01c 4.83±0.09c 2.57±0.09c 1.88±0.10 2.49±0.38b 1.55±0.03b 0.94±0.03b 1.65±0.08 61.91±0.55 注:同列不同小写字母表示不同处理间存在显著性差异(P< 0.05)。 2.2 不同修剪深度对茶树修剪凋落物及其组分持水能力的影响
2.2.1 持水率
3种修剪处理的修剪凋落物及其组分的持水率均随浸水时间的延长而呈增加趋势,尤以前4 h增加迅速,随后增势趋缓(图 1)。修剪凋落物混合样及其组分的最大持水率表现为:中度修剪(121.33%)>重度修剪(113.69%)>轻度修剪(106.16%);叶>枝,其中叶的平均最大持水率为137.47%,分别是混合组分和枝的平均最大持水率的1.2倍和1.49倍。由此可知,叶在修剪物组分中的持水能力最大,其分别是对应混合组分的1.14~1.34倍;而枝条的持水率较小,仅为对应混合组分的0.79~0.81倍。
2.2.2 持水量
由图 2可知,不同修剪处理凋落物及其组分的持水量变化趋势与持水率相一致,均随时间延长而呈增加趋势,尤其在前2 h内增加迅速,2 h后变化趋缓。3种修剪处理的混合组分饱和时间约在16 h;3处理修剪枝叶及其组分的最大持水量表现为:中度修剪(2.89 t·hm-2)>重度修剪(2.83 t·hm-2)>轻度修剪(1.86 t·hm-2),混合枝叶>叶>枝,枝条的持水量最少,且增幅较小。由此可见,枝叶比及其老嫩程度、生物量、持水率高低对其持水能力影响较大。
2.2.3 吸水速率
由图 3可知,3个处理凋落物各组分吸水速率的变化,表现为前0.5 h内最大,随后呈急剧下降趋势,至4 h后,下降趋势渐趋平缓,随时间延长变化趋于一致。3个处理的凋落物及其组分的最大吸水速率均表现为:叶>叶枝混合>枝,其中叶的平均最大吸水速率2.14 g·g-1·h-1,分别为枝叶混合的1.27倍、枝的1.95倍。同一组分不同处理的最大吸水速率,表现出明显差异,其中混合组为:中度修剪(1.78 g·g-1·h-1)>重度修剪(1.70 g·g-1·h-1)>轻度修剪(1.59 g·g-1·h-1); 叶组分: 轻度修剪(2.18 g·g-1·h-1)>中度修剪(2.13 g·g-1·h-1)>轻度修剪(2.12 g·g-1·h-1);枝条组分:中度修剪(1.28 g·g-1·h-1)>重度修剪(1.05 g·g-1·h-1)>轻度修剪(0.97 g·g-1·h-1)。
2.3 不同修剪深度下茶树修剪凋落物及其组分的拦蓄能力
2.3.1 修剪凋落物的拦蓄能力
研究结果(表 2)表明,3处理下的茶树修剪凋落物对降雨的拦蓄能力不同,其中混合组分的最大拦蓄率(量)及有效拦蓄率(量)均表现为:中度修剪>重度修剪>轻度修剪,而枝或叶组分不同处理间的变化不明朗。不同修剪处理下凋落物及其组分的最大持水量(率)>最大拦蓄量(率)>有效拦蓄量(率),其中中度修剪处理的单次修剪凋落物的有效拦蓄量为2.19 t·hm-2,分别比最大持水量、最大拦蓄量下降了24.22%和16.41%;同样,重度修剪的有效拦蓄量分别下降了24.03% 和9.19%,轻度修剪的有效拦蓄量分别下降了25.27%和10.75%。
表 2 不同深度下茶树修剪凋落物及其组分对降雨拦蓄能力的比较Table 2. Flood-intercepting capacity of litter from various pruning practices浸水时间 轻度修剪 中度修剪 重度修剪 叶 枝 混合 叶 枝 混合 叶 枝 混合 最大持水率R/% 141.98 83.97 106.16 138.12 99.29 121.33 132.32 92.64 113.69 最大持水量Q/(t·hm-2) 1.76 0.43 1.86 2.11 0.84 2.89 2.05 0.87 2.83 最大拦蓄率Lr/%t 133.71 77.60 95.12 130.83 92.58 110.12 124.22 84.67 103.41 最大拦蓄量L/(t·hm-2) 1.66 0.40 1.66 2.00 0.79 2.62 1.93 0.8 2.57 有效拦蓄率W/% 112.41 65.01 79.19 110.11 77.68 91.92 104.37 70.77 86.35 有效拦蓄量L2/(t·hm-2) 1.39 0.33 1.39 1.68 0.66 2.19 1.62 0.67 2.15 2.3.2 修剪凋落物各组分的蓄水能力
由表 2看出,不同修剪处理下凋落物枝、叶组分对降雨的拦蓄能力不同。3种修剪处理下叶组分凋落物最大持水量、最大拦蓄量、有效拦蓄量表现为:中度修剪>重度修剪>轻度修剪;而最大持水率、最大拦蓄率、有效拦蓄率均表现为:轻度修剪>中度修剪>重度修剪。枝条组分则与之不同,其最大持水率、最大拦蓄率、有效拦蓄率表现为:中度修剪>重度修剪>轻度修剪,最大持水量、最大拦蓄量、有效拦蓄量为:重度修剪>中度修剪>轻度修剪。不同处理下凋落物及其组分的最大持水率、最大拦蓄率及有效拦蓄率均表现为:叶>混合>枝,其凋落物组分的最大持水量、最大拦蓄量及有效拦蓄量均呈现叶占比最大,枝次之。由此可说明凋落物中以叶组分对降雨的拦蓄能力最强。
3. 讨论与结论
陆地植被生态系统中凋落物对截持降水、防止土壤溅蚀、阻延地表径流、抑制土壤水分蒸发、增强土壤抗冲效能等方面都具有非常重要的意义[14-15]。另有研究表明,修剪不仅是茶树培育树冠的一项重要农艺措施,还可使昆虫失去部分栖息地,对采食嫩芽叶的病虫害有一定的抑制作用[16]。但作为修剪凋落物本身其所具有的生态水文功能则一直被忽略。
本研究表明,3种修剪处理下凋落物生物量(DW)为1.75~2.49 t·hm-2,仅为鲜重的33.62%~39.09%。若以轻度修剪每年2次计算,则由修剪产生的凋落物的生物量约为3.5 t·hm-2,加上茶树生长过程中自然形成的凋落物,而其实际生物量应略大。然而,由于茶园生态系统人为干扰强烈其现存量应低于两者之和,因此仍远小于森林生态系统凋落物的产生量。如远低于15年生马占相思林和湿地松林的年凋落量(11.14、7.30 t·hm-2)[17];低于同气候带处于顶级群落演替阶段的木荷、细柄阿丁枫、浙江桂、观光木林等(5.96~7.22 t·hm-2),接近于杉木人工林(3.47、4.82 t·hm-2)[12, 18];与苦竹林、慈竹林、撑绿杂交竹林、苦竹+光皮桦混交林等人工林的凋落物蓄积量(0.95~2.21 t·hm-2)大致相当[19],其差异主要与植被类型及树种组分、植被密度、树龄、水热条件不同有关。
当前研究表明凋落物的现存量、分解状态及持水性能对生态系统含蓄水源的功能具有重要影响。本研究发现,3个不同深度修剪的凋落物混合样的最大持水率表现为:中度修剪(121.33%)>重度修剪(113.69%)>轻度修剪(106.16%),且均以叶组分的持水率最大,其平均最大持水率为137.47%,是混合枝叶组分平均最大持水率的1.2倍,枝的1.49倍。该结果与前人研究规律一致[12, 20]。但其混合枝叶组分持水率小于同气候带的6种天然林枯落物最大持水率(159.34%~196.02%),接近浙江桂(159.34%)[18];亦小于亚热带阔叶林(158%~309%)[20]和温带森林(265.19%~525.36%)[11];与6年生桉树人工林叶、枝最大持水率(139.99%、66.21%)[21]相当。
本研究表明,凋落物持水作用主要表现在降雨前期的2 h内,特别是前30 min,这一结果与前人研究一致[12, 19, 22]。3种修剪深度的凋落物及其组分的最大吸水速率均表现为:叶>混合>枝,这一结果与其持水率较为一致。各组分的最大持水量均表现为:混合>叶>枝,混合组分最大持水量以中度修剪为大、其次为重度修剪与轻度修剪(1.86~2.89 t·hm-2)。该结果小于杉木人工林(4.24~11.60 t·hm-2)[12],远小于亚热带阔叶林(13.37~17.71 t·hm-2)[23],接近同属亚热带的3种人工林(3.3~6.8 t·hm-2)[24],差异原因主要与植被类型、生物量、凋落物组分持水特性有关。
不同修剪程度的茶树修剪物对降雨的拦蓄能力不同。本研究表明,3种处理下混合组分的最大拦蓄率(95.12%~110.12%),有效拦蓄率(79.19%~91.91%)。与彭玉华等[13]报道的5种植被类型凋落物的最大拦蓄率(95.13%~147.49%),有效拦蓄率(75.41%~122.77%)相当。混合组分的最大持水量、最大拦蓄量及有效拦蓄量均表现为:中度修剪>重度修剪>轻度修剪。中度修剪下的单次修剪凋落物的有效拦蓄量(2.19 t·hm-2),比最大持水量、最大拦蓄量分别下降24.22%和16.41%,小于同气候带杉木林的最大拦蓄量(3.44~9.92 t·hm-2),介于有效拦蓄量(1.88~5.93 t·hm-2)[12],远小于彭华等[13]报道的植被类型最大拦蓄量(377.55~520.62 t·hm-2)和有效拦蓄量(313.54~430.74 t·hm-2)。本研究表明茶园生态系统凋落物的拦蓄降水能力明显小于森林生态系统,两者相差悬殊主要为各自生态系统内的凋落物现存量及及持水率差别巨大所致。
生产茶园内的茶树每年都要进行1~3次修剪,考虑茶树枝叶自然凋落的存在茶园实际凋落物及其蓄水能力要大于单纯修剪凋落物的统计量,加之凋落物存在自然分解过程其持水特性非恒定,故有关人为管理导致的茶树凋落物分解与养分循环、生态水文功能的动态变化还有待进一步深入研究。在茶树修剪凋落物组分中,叶组分由于其生物学特性及生物量占比较大等原因,成为茶园生态系统凋落物中涵养水源功能的主要承担者。本研究仅从单一凋落物的生态水文功能角度分析,表明茶园生态系统凋落物所具备的生态水文功能弱于森林生态系统,这与茶园人工生态系统存在较强的水土流失现象相一致。尤其对于新建茶园,在合理选择栽植方式外(如:等高条栽),应加强水土保持的生态(如生草覆盖)和工程技术措施(设置缓路横沟、等高梯层、外埂内沟,保持梯面适度内倾等)。
此外,从土地利用类型对生态服务功能影响角度出发,植被类型由林/灌丛地转变为茶园降低了地表覆盖度、凋落物现存量及持水量,其必然对生态系统的水土保持、水源涵养的功能产生显著及长期影响。因此,在规划茶叶种植时不应盲目增加种植面积,而应进行经济和生态效益的均衡考虑。
-
表 1 17份南安石亭群体种茶树种质资源
Table 1 Germplasm resources of 17 C.sinensis plants planted in Shiting population, Nan'an
编号
Code茶树种质
Germplasm resour测s长宽比
Aspect ratio叶面积
Leaf area/cm2叶形
Blade shape叶色
Leaf color1 ST1 2.87 10.63 长椭圆形 黄绿色 2 ST2 2.83 10.47 长椭圆形 黄绿色 3 ST3 2.54 10.25 长椭圆形 黄绿色 4 ST4 2.32 10.15 椭圆形 黄绿色 5 ST5 2.61 14.31 长椭圆形 黄绿色 6 ST6 3.10 9.56 披针形 黄绿色 7 ST7 2.82 9.55 长椭圆形 深绿色 8 ST8 2.20 6.16 椭圆形 黄绿色 9 ST9 2.25 16.13 椭圆形 深绿色 10 ST10 2.37 5.99 椭圆形 深绿色 11 ST11 2.35 6.58 椭圆形 黄绿色 12 ST12 2.18 17.61 椭圆形 黄绿色 13 ST13 2.44 10.68 椭圆形 深绿色 14 ST14 2.52 9.34 长椭圆形 黄绿色 15 ST15 2.26 8.37 椭圆形 深绿色 16 ST16 2.17 13.65 椭圆形 黄绿色 17 ST17 2.50 11.83 椭圆形 黄绿色 表 2 南安石亭群体种茶树种质资源儿茶素组分含量
Table 2 Catechins of Shiting plantation tea germplasms
(单位:mg·g−1) 儿茶素类
CatechinsST2 ST3 ST5 ST6 ST8 ST10 ST11 ST12 ST14 ST17 非酯
型儿
茶素
Non-ester
catechinsGC 0.35±0.02f 0.96±0.05a 0.42±0.01ef 0.48±0.02def 0.85±0.02ab 0.49±0.06def 0.76±0.03bc 0.61±0.12cde 0.88±0.02ab 0.65±0.30cd EGC 23.68±1.41f 28.91±2.25e 38.57±2.38c 24.79±2.07ef 56.41±3.73a 29.40±3.30d 38.44±3.66c 45.12±3.11b 44.39±1.16b 31.80±0.40d C 1.72±0.06 2.15±0.18a 1.93±0.09ab 1.98±0.25ab 1.95±0.30ab 1.36±0.31 c 1.78±0.27ab 0.83±0.09de 0.91±0.08d 0.51±0.01e EC 13.83±1.40cd 11.89±0.79e 15.06±0.36c 7.06±0.49f 18.72±0.55a 8.13±0.34f 13.29±0.88d 17.44±1.07b 10.96±0.47e 7.82±0.13f 总量 39.58±2.06de 43.91±3.34d 55.98±2.77c 34.31±2.88e 77.93±4.35a 39.38±3.83de 54.27±4.77c 64.00±4.44b 57.14±1.74c 40.78±0.38d 酯型儿
茶素
Ester
catechinsEGCG 92.51±6.53a 52.21±3.22d 57.99±1.27cd 98.30±6.29a 61.37±2.20c 76.02±4.76b 40.30±3.97e 57.12±5.35cd 63.94±2.28c 39.60±0.91e EGCG3" Me 12.97±0.88b 13.27±0.66b 1.66±0.11e — 7.11±0.18c — 6.02±0.52d 6.55±0.48cd 6.36±0.25cd 18.18±0.14a ECG 31.75±2.02a 14.82±0.58e 17.63±0.43c 19.92±0.96b 17.16±0.47cd 14.93±0.70e 11.18±0.85f 15.77±1.11de 11.64±0.38f 7.58±0.12g CG 0.66±0.03c 0.94±0.05b 0.65±0.03c 0.62±0.02c — 0.65±0.02c — — — 1.41±0.08a 总量 137.89±9.45a 81.24±4.49d 77.93±1.79d 118.84±7.25b 85.64±2.86cd 91.6±5.44c 57.50±5.35f 79.44±6.88d 81.94±2.89d 66.77±0.88e 总儿茶素
Total
catechins177.47±11.15a 125.15±7.81ef 133.91±4.28de 153.15±9.93bc 163.57±6.84ab 130.98±7.64de 111.77±10.00fg 143.44±11.29cd 139.08±4.56cde 107.55±1.02g 儿茶素
苦涩味指数
Catechins
bitterness and
astringency index9.54±1.07c 6.90±0.13d 6.74±0.07de 15.87±0.07a 6.57±0.16de 12.73±0.30b 6.02±0.16e 6.49±0.15de 10.18±0.15c 9.56±0.18c 儿茶素
品质指数
Catechin
quality index524.60±7.00a 232.12±5.47d 196.46±10.04e 477.71±17.2b 139.46±6.84gh 311.54±33.00c 133.99±3.89h 161.41±3.74fg 170.25±2.58f 148.39±4.63fgh 数值表示3个样品均值±标准差;同行不同小写字母表示差异显著(P < 0.05);“—”表示未检测出。表3 同。
Data are standard deviation ± mean of triplicated samples; those with different lowercase letters on same row indicate significant differences at P<0.05; "—" indicates not detected. Same for Table 3.表 3 南安石亭群体种茶树种质资源氨基酸的组分含量
Table 3 Amino acids of Shiting plantation tea germplasms
(单位:mg·g−1) 氨基酸组分
Amino acid
componentsST2 ST3 ST5 ST6 ST8 ST10 ST11 ST12 ST14 ST17 鲜味类
FlavorThea 3.27±0.14e 9.98±0.13a 5.54±0.17d 2.07±0.12g 1.61±0.28h 7.17±0.38b 6.50±0.36c 2.62±0.19f 2.37±0.06fg 2.10±0.00g Pro 0.29±0.01e 0.69±0.02a 0.31±0.01e 0.52±0.04bc 0.37±0.18de 0.36±0.02de 0.47±0.04cd 0.60±0.02ab 0.40±0.04de 0.38±0.03de Glu 2.27±0.15bc 2.53±0.29b 0.61±0.05f 1.13±0.04e 0.97±0.14ef 1.93±0.00cd 1.76±0.23d 3.90±0.65a 4.09±0.13a 0.14±0.02g GABA 0.06±0.00a 0.06±0.00a 0.06±0.00a 0.06±0.00a 0.06±0.00a 0.06±0.00a 0.07±0.00a 0.07±0.00a 0.07±0.00a 0.07±0.00a Asp 0.30±0.14cd 0.59±0.01b 0.24±0.03de 0.88±0.04a 0.15±0.02ef 0.31±0.08cd 0.17±0.04ef 0.34±0.05cd 0.39±0.07c 0.12±0.01f 总量 6.20±0.26f 13.85±0.24a 6.76±0.19e 4.66±0.13g 3.16±0.35g 9.83±0.29b 8.96±0.2c 7.54±0.49d 7.31±0.09d 0.81±0.01h 甜味类
SweetnessAla 0.13±0.04f 0.28±0.01de 0.14±0.03f 0.18±0.04ef 0.46±0.1c 0.47±0.06c 0.93±0.09b 0.39±0.02cd 0.16±0.04ef 2.00±0.17a Thr 0.22±0.03e 0.53±0.03a 0.27±0.02d 0.41±0.03b 0.17±0.04e 0.35±0.02c 0.36±0.03c 0.36±0.02c 0.35±0.04c 0.21±0.02e Asn 0.28±0.03cd 0.57±0.2a 0.24±0.07cd 0.6±0.01a 0.19±0.04d 0.37±0.12bc 0.29±0.04cd 0.35±0.02bcd 0.48±0.06ab 0.24±0.02cd Ser 0.37±0.01f 1.24±0.06a 0.47±0.05ef 0.8±0.08c 0.55±0.03def 1.00±0.08b 0.66±0.31cde 0.8±0.02c 0.75±0.05cd 0.43±0.07f Gly 0.04±0.01d 0.06±0.02cd 0.25±0.03a 0.09±0.02cd 0.12±0.07c 0.06±0.04cd 0.19±0.01b 0.05±0.03d 0.06±0.05cd 0.1±0.04cd Gln 3.15±0.27b 3.10±0.02b 0.47±0.10f 1.59±0.08e 1.00±0.17e 3.76±0.18a 2.58±0.34c 2.99±0.27b 3.69±0.13a 0.18±0.03f 总量 4.22±0.13d 5.80±0.05ab 1.85±0.03g 3.96±0.22d 2.45±0.28f 5.94±0.37a 4.88±0.17c 4.93±0.3c 5.40±0.35b 3.03±0.19e 芳香类
AromaticLys 0.21±0.04cd 0.62±0.03a 0.15±0.02de 0.42±0.03b 0.19±0.08cd 0.24±0.02c 0.25±0.01c 0.38±0.02b 0.23±0.03c 0.11±0.04e Tyr 0.53±0.05cd 0.61±0.03c 0.49±0.04de 0.81±0.07b 0.54±0.1cd 0.41±0.04ef 0.85±0.07b 2.24±0.03a 0.55±0.01cd 0.36±0.08g Trp 0.47±0.04a 0.27±0.02c 0.16±0.04e 0.33±0.03b 0.17±0.04e 0.16±0.00e 0.17±0.01e 0.28±0.02c 0.22±0.01d 0.08±0.02f 总量 1.21±0.13c 1.5±0.02b 0.79±0.03e 1.56±0.04b 0.90±0.16de 0.81±0.06e 1.27±0.08c 2.9±0.05a 1.00±0.02d 0.55±0.11f 苦味类
BittersArg 2.81±0.15d 8.25±0.46a 4.93±0.13c 1.86±0.12e 0.98±0.36f 5.91±0.27b 6.30±0.31b 2.18±0.3e 2.11±0.25e 0.14±0.01g Leu 0.28±0.01ef 1.07±0.02a 0.45±0.06bc 0.5±0.04b 0.33±0.04de 0.27±0.02ef 0.24±0.03fg 0.39±0.06cd 0.34±0.02de 0.2±0.04g Ile 0.31±0.02cd 0.91±0.21a 0.45±0.09bc 0.48±0.03b 0.06±0.03f 0.22±0.00def 0.22±0.05def 0.29±0.11cde 0.38±0.09bcd 0.14±0.03ef His 0.11±0.02cd 0.15±0.02b 0.09±0.01d 0.19±0.00a 0.11±0.04cd 0.11±0.02cd 0.12±0.02bcd 0.14±0.01bc 0.11±0.02bcd 0.09±0.02d Val 0.18±0.03e 0.49±0.02a 0.12±0.01f 0.40±0.01b 0.06±0.03g 0.22±0.03d 0.21±0.02de 0.33±0.02c 0.23±0.01d 0.06±0.02g 总量 3.68±0.18d 10.86±0.36a 6.04±0.29c 3.43±0.15de 1.54±0.38f 6.73±0.22b 7.09±0.29b 3.33±0.27de 3.17±0.31e 0.62±0.08g 其他
Otherβ-ABA 0.09±0.01e 0.11±0.01e 2.42±0.27b 0.08±0.01e 0.85±0.26d 0.16±0.04e 2.67±0.22a 1.24±0.13c 0.07±0.01e 0.90±0.04d sar 0.17±0.01c 0.22±0.04bc 0.23±0.00bc 0.31±0.13abc 0.19±0.03bc 0.34±0.14ab 0.33±0.09abc 0.28±0.06abc 0.41±0.06a 0.32±0.10abc 总氨基酸 15.55±0.39f 32.32±0.44a 18.09±0.7e 13.70±0.08g 9.15±0.68h 24.87±0.57c 25.32±0.19b 20.21±0.52d 17.47±0.8e 8.35±0.27i -
[1] 阚能才. 茶树起源与川渝野生茶树分布研究 [J]. 西南农业学报, 2013, 26(1):382−385. DOI: 10.3969/j.issn.1001-4829.2013.01.080 KAN N C. Study on geographical distribution of wild tea trees in Sichuan and Chongqing, and origin of tea tree [J]. Southwest China Journal of Agricultural Sciences, 2013, 26(1): 382−385. (in Chinese) DOI: 10.3969/j.issn.1001-4829.2013.01.080
[2] 黄天柱, 廖渊泉. 石亭茶香飘海宇 [J]. 农业考古, 1991(4):227. HUANG T Z, LIAO Y Q. Shi Ting Cha Xiang Piao Hai Yu [J]. Agricultural Archaeology, 1991(4): 227. (in Chinese)
[3] 林金良, 陈育才. 九日山和石亭绿茶文化资源探讨[J]. 福建茶叶, 2020, 42(11): 307-309. LIN J L, CHEN Y C. Discussion on jiuri mountain heshiting green tea cultural resources[J]. Tea in Fujian, 2020, 42(11): 307-309. (in Chinese)
[4] WANG B Y, TAN H W, FANG W P, et al. Developing single nucleotide polymorphism (SNP) markers from transcriptome sequences for identification of Longan (Dimocarpus longan) germplasm [J]. Horticulture Research, 2015, 2: 14065. DOI: 10.1038/hortres.2014.65
[5] XU C, REN Y H, JIAN Y Q, et al. Development of a maize 55 K SNP array with improved genome coverage for molecular breeding [J]. Molecular Breeding, 2017, 37(3): 20. DOI: 10.1007/s11032-017-0622-z
[6] 郭灿, 皮发娟, 吴昌敏, 等. 基于GBS测序的全基因组SNP揭示贵州地方茶组植物资源的亲缘关系 [J]. 南方农业学报, 2021, 52(3):660−670. DOI: 10.3969/j.issn.2095-1191.2021.03.014 GUO C, PI F J, WU C M, et al. Genome-wide SNP developed by genotyping-by-sequencing revealed the phylogenetic relationship of Sect. Thea(L. ) Dyer resources in Guizhou [J]. Journal of Southern Agriculture, 2021, 52(3): 660−670. (in Chinese) DOI: 10.3969/j.issn.2095-1191.2021.03.014
[7] LIN Y, YU W T, CAI C P, et al. Rapid varietal authentication of oolong tea products by microfluidic-based SNP genotyping [J]. Food Research International, 2022, 162: 111970. DOI: 10.1016/j.foodres.2022.111970
[8] LIU C G, YU W T, CAI C P, et al. Genetic diversity of tea plant (Camellia sinensis (L.) kuntze) germplasm resources in Wuyi mountain of China based on single nucleotide polymorphism (SNP) markers [J]. Horticulturae, 2022, 8(10): 932. DOI: 10.3390/horticulturae8100932
[9] CHEN Y J, NIU S Z, DENG X Y, et al. Genome-wide association study of leaf-related traits in tea plant in Guizhou based on genotyping-by-sequencing [J]. BMC Plant Biology, 2023, 23(1): 196. DOI: 10.1186/s12870-023-04192-0
[10] LIAO Y Y, ZHOU X C, ZENG L T. How does tea (Camellia sinensis) produce specialized metabolites which determine its unique quality and function: A review [J]. Critical Reviews in Food Science and Nutrition, 2022, 62(14): 3751−3767. DOI: 10.1080/10408398.2020.1868970
[11] WILLIAMS J L, EVERETT J M, D’CUNHA N M, et al. The effects of green tea amino acid L-theanine consumption on the ability to manage stress and anxiety levels: A systematic review [J]. Plant Foods for Human Nutrition, 2020, 75(1): 12−23. DOI: 10.1007/s11130-019-00771-5
[12] 江新凤, 李琛, 石旭平, 等. 高效液相色谱法对“黄金菊” 茶中儿茶素和氨基酸组分含量的测定 [J]. 食品研究与开发, 2021, 42(5):172−176. DOI: 10.12161/j.issn.1005-6521.2021.05.029 JIANG X F, LI C, SHI X P, et al. HPLC determination of catechin and amino acid components in Camellia sinensis ‘huangjinju’ [J]. Food Research and Development, 2021, 42(5): 172−176. (in Chinese) DOI: 10.12161/j.issn.1005-6521.2021.05.029
[13] UNNO K, NAKAMURA Y. Green tea suppresses brain aging [J]. Molecules, 2021, 26(16): 4897. DOI: 10.3390/molecules26164897
[14] JIN J Q, JIANG C K, YAO M Z, et al. Baiyacha, a wild tea plant naturally occurring high contents of theacrine and 3″-methyl-epigallocatechin gallate from Fujian, China [J]. Scientific Reports, 2020, 10(1): 9715. DOI: 10.1038/s41598-020-66808-x
[15] 金基强, 张晨禹, 马建强, 等. 茶树种质资源研究“十三五” 进展及“十四五” 发展方向 [J]. 中国茶叶, 2021, 43(9):42−49,76. DOI: 10.3969/j.issn.1000-3150.2021.09.006 JIN J Q, ZHANG C Y, MA J Q, et al. Research progress on tea germplasms during the 13th Five-Year Plan period and development direction in the 14th Five-Year Plan period [J]. China Tea, 2021, 43(9): 42−49,76. (in Chinese) DOI: 10.3969/j.issn.1000-3150.2021.09.006
[16] WANG P J, GU M Y, SHAO S X, et al. Changes in non-volatile and volatile metabolites associated with heterosis in tea plants (Camellia sinensis) [J]. Journal of Agricultural and Food Chemistry, 2022, 70(9): 3067−3078. DOI: 10.1021/acs.jafc.1c08248
[17] 江昌俊. 茶树育种学[M]. 北京: 中国农业出版社: 2005. [18] FANG W P, MEINHARDT L W, TAN H W, et al. Varietal identification of tea (Camellia sinensis) using nanofluidic array of single nucleotide polymorphism (SNP) markers [J]. Horticulture Research, 2014, 1: 14035. DOI: 10.1038/hortres.2014.35
[19] 樊晓静, 于文涛, 蔡春平, 等. 利用SNP标记构建茶树品种资源分子身份证 [J]. 中国农业科学, 2021, 54(8):1751−1772. DOI: 10.3864/j.issn.0578-1752.2021.08.014 FAN X J, YU W T, CAI C P, et al. Construction of molecular ID for tea cultivars by using of single-nucleotide polymorphism(SNP) markers [J]. Scientia Agricultura Sinica, 2021, 54(8): 1751−1772. (in Chinese) DOI: 10.3864/j.issn.0578-1752.2021.08.014
[20] 徐梦婷, 魏明秀, 陈潇敏, 等. 寿宁长叶1号等茶树新品系儿茶素和氨基酸组分分析 [J]. 茶叶学报, 2022, 63(1):20−26. DOI: 10.3969/j.issn.1007-4872.2022.01.004 XU M T, WEI M X, CHEN X M, et al. Catechins and amino acids in shouningchangye No. 1 and other new tea varieties [J]. Acta Tea Sinica, 2022, 63(1): 20−26. (in Chinese) DOI: 10.3969/j.issn.1007-4872.2022.01.004
[21] ZHANG Y N, YIN J F, CHEN J X, et al. Improving the sweet aftertaste of green tea infusion with tannase [J]. Food Chemistry, 2016, 192: 470−476. DOI: 10.1016/j.foodchem.2015.07.046
[22] 李芬, 陈春林, 田玉萍, 等. 云南不同品种大叶种茶树生化成分季节变化特征分析 [J]. 食品与生物技术学报, 2022, 41(3):88−95. DOI: 10.3969/j.issn.1673-1689.2022.03.012 LI F, CHEN C L, TIAN Y P, et al. Seasonal Variation of Biochemical Components of Different Cultivars of Camellia sinensis var. assamica in Yunnan [J]. Journal of Food Science and Biotechnology, 2022, 41(3): 88−95. (in Chinese) DOI: 10.3969/j.issn.1673-1689.2022.03.012
[23] YU P H, HUANG H, ZHAO X, et al. Dynamic variation of amino acid content during black tea processing: A review [J]. Food Reviews International, 2023, 39(7): 3970−3983. DOI: 10.1080/87559129.2021.2015374
[24] HUANG X J, CAO H L, GUO Y L, et al. The dynamic change of oolong tea constitutes during enzymatic-catalysed process of manufacturing [J]. International Journal of Food Science & Technology, 2020, 55(12): 3604−3612.
[25] LIU Z Y, RAN Q S, LI Q, et al. Interaction between major catechins and umami amino acids in green tea based on electronic tongue technology [J]. Journal of Food Science, 2023, 88(6): 2339−2352. DOI: 10.1111/1750-3841.16543
[26] JIN J Q, MA J Q, MA C L, et al. Determination of catechin content in representative Chinese tea germplasms [J]. Journal of Agricultural and Food Chemistry, 2014, 62(39): 9436−9441. DOI: 10.1021/jf5024559
[27] 杨春, 吴昌敏, 石伟昌, 等. 黎平地方茶树资源生化成分多样性分析及优异单株鉴选 [J]. 种子, 2020, 39(10):63−66,72. YANG C, WU C M, SHI W C, et al. Diversity analysis of biochemical components of local tea tree resources in Liping Region and excellent individual plant selection [J]. Seed, 2020, 39(10): 63−66,72. (in Chinese)
[28] ZHANG M, ZHANG X, HO C T, et al. Chemistry and health effect of tea polyphenol (–)-epigallocatechin 3-O-(3-O-methyl)gallate [J]. Journal of Agricultural and Food Chemistry, 2019, 67(19): 5374−5378. DOI: 10.1021/acs.jafc.8b04837
[29] LI J H, CHEN S X, ZHU M Z, et al. Cluster analysis of the biochemical composition in 53 Sichuan EGCG3"Me tea resources [J]. IOP Conference Series: Materials Science and Engineering, 2017, 231: 012125. DOI: 10.1088/1757-899X/231/1/012125
[30] XU C H, LIANG L, LI Y H, et al. Studies of quality development and major chemical composition of green tea processed from tea with different shoot maturity [J]. LWT, 2021, 142: 111055. DOI: 10.1016/j.lwt.2021.111055
[31] JIANG H, YU F, QIN L, et al. Dynamic change in amino acids, catechins, alkaloids, and Gallic acid in six types of tea processed from the same batch of fresh tea (Camellia sinensis L. ) leaves [J]. Journal of Food Composition and Analysis, 2019, 77: 28−38. DOI: 10.1016/j.jfca.2019.01.005
[32] ZHANG L, CAO Q Q, GRANATO D, et al. Association between chemistry and taste of tea: A review [J]. Trends in Food Science & Technology, 2020, 101: 139−149.
[33] LI Y C, RAN W, HE C, et al. Effects of different tea tree varieties on the color, aroma, and taste of Chinese Enshi green tea [J]. Food Chemistry: X, 2022, 14: 100289. DOI: 10.1016/j.fochx.2022.100289
[34] HU S, HE C, LI Y C, et al. Changes of fungal community and non-volatile metabolites during pile-fermentation of dark green tea [J]. Food Research International, 2021, 147: 110472. DOI: 10.1016/j.foodres.2021.110472
-
期刊类型引用(1)
1. 董照锋. 茶树修剪技术对北方茶园病虫控制的效应. 茶叶. 2017(04): 207-209 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载: