Resistance to Early Senescence and Rice Blast/Blight: A Mutant Variety and Expressions of Responsible Genes
-
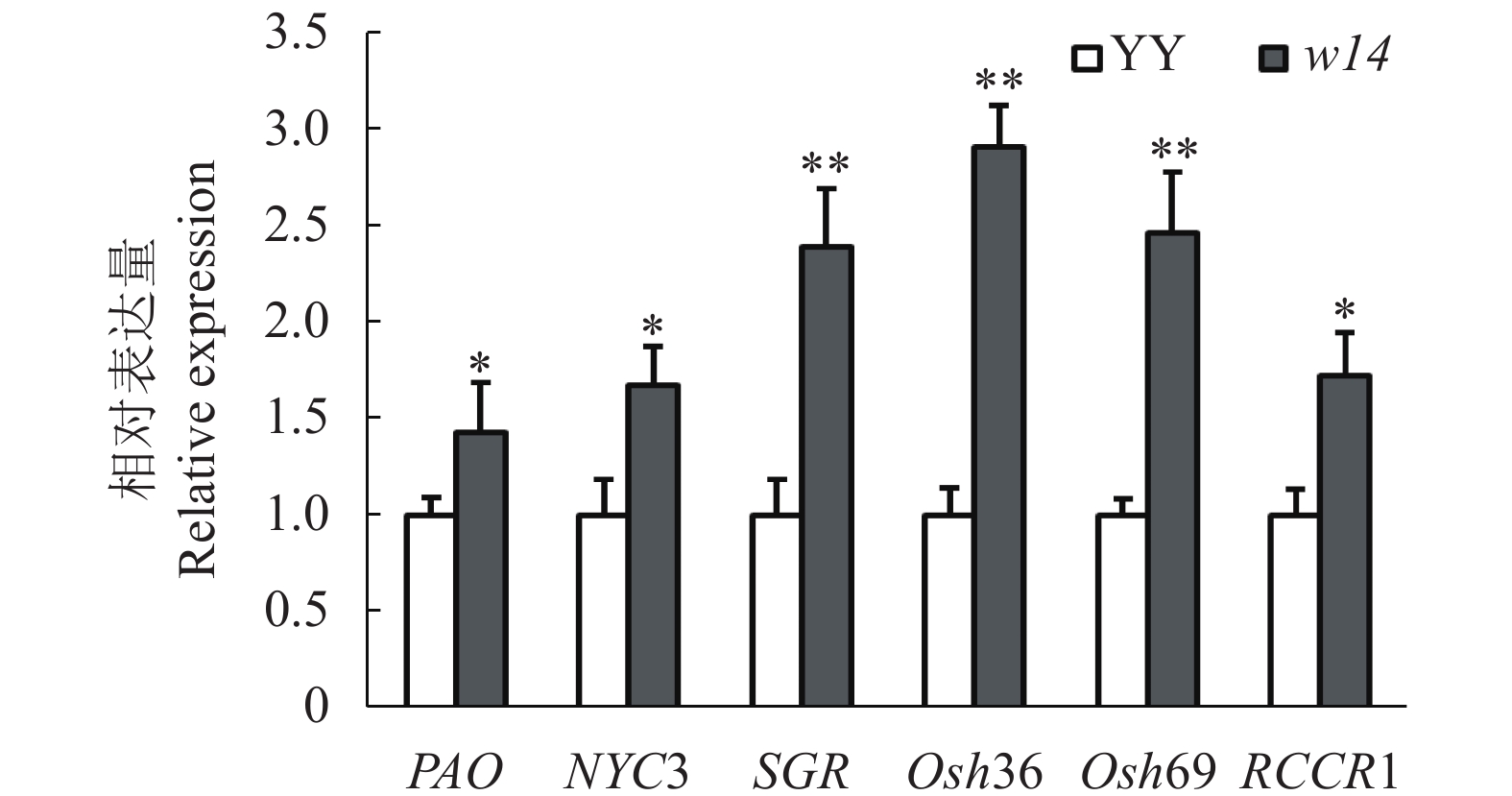
摘要:目的 叶片早衰影响水稻的产量和品质,早衰突变体是研究水稻衰老机制的良好载体,鉴定、分析早衰突变体的表型特征,有助于了解突变体的遗传规律,为相关基因的克隆和功能研究奠定基础。方法 人工接种鉴定了早衰突变体w14的稻瘟病和水稻白叶枯病抗性,同时通过对离体叶片的黑暗诱导和叶绿素含量测定,鉴定了突变体w14的早衰表型;再分别对早衰突变体w14和野生型粳稻品种云引(简称‘YY’)中水稻早衰相关基因和病程相关基因的表达进行分析,研究早衰突变体w14的早衰类型及与野生型在防御系统上的差异。结果 黑暗诱导处理24 h后,突变体w14的叶绿素含量显著低于野生型YY(P<0.05)。黑暗诱导处理48 h以上,突变体w14的叶绿素含量极显著低于野生型YY(P<0.01)。突变体w14中衰老相关基因SGR、Osh36、Osh69、PAO、NYC3和RCCR1的表达均显著高于野生型YY。分别接种水稻白叶枯和稻瘟病后,突变体w14均表现为比野生型YY更感病,且病程相关基因PR1a、PR4、Cth1、PR1b、PBZ1、PR3等的表达在突变体中显著上调。结论 突变体w14具有典型的衰老和感稻瘟病、水稻白叶枯病的表型,与野生型相比,在突变体中与病程相关基因的表达发生了显著改变,即突变体防御系统的改变导致其出现感病的表型。Abstract:Objective A mutant rice showing signs of early senescence on leaves and susceptibility to rice blast and blight was used for phenotypic and genetic analyses to study the genes associated with the aging mechanism and vulnerability to the diseases of rice plants.Method Resistance to blast and bacterial blight of the mutant rice w14 with symptoms of early senescence was tested by artificial inoculation. Phenotype classification of the mutant was determined by chlorophyll content measured in vitro under induced darkness. Expressions of the genes related to senescence and pathogenesis in the mutant and wild-type japonica rice variety, Yunyin (YY), were compared.Result After inducing darkness for 24h, the chlorophyll content in w14 was 5% lower than that in YY, and the difference reached a 1% statistical significance level in 48 h. The expressions of senescence-related genes SGR, Osh36, Osh69, PAO, NYC3, and RCCR1 in w14 were significantly higher than those in the wild-type counterpart. The mutant rice was more susceptible to the artificial inoculations of rice blast and bacterial blight, and the pathogenesis-related genes PR1a, PR4, Cth1, PR1b, PBZ1, and PR3 significantly up-regulated in w14 than in YY.Conclusion The mutant rice w14 showed the typical senescence phenotypes with a higher susceptibility to rice blast and bacterial blight than the wild-type YY. The expressions of pathogenesis-related genes in the mutants were significantly altered that substantially affected its defense system leading to the early senescence and disease susceptibility as observed in the study.
-
Keywords:
- Rice /
- mutant /
- early senescence /
- chlorophyll /
- resistance /
- gene expression
-
0. 引言
【研究意义】百香果(Passiflora edulis Sims)属西番莲科(Passifloraceae)西番莲属(Passiflora)植物,是广西的特色水果之一。茎基腐病是百香果主要真菌病害之一,其病原为Fusarium solani,该病发生在植株茎基部,与地面有20~30 cm的距离,幼苗、成株均会被病菌侵染,造成植株褪绿萎蔫或枯萎死亡[1],严重影响百香果的产量和品质。目前百香果茎基病的生产防治技术还是以化学防治为主[2]。化学防治虽简便快速,但化学药剂长期使用易造成环境污染、生态失衡等问题,甚至威胁人类生命安全,因此,植物病害生物防治被认为是一种更安全和可持续发展的战略[3]。生物防治是推动农业可持续发展的重要组成,其借助自然界中不影响植物生长的微生物发挥其重寄生、竞争等多种生防作用,以直接或间接作用的方式影响病原物的生存或活动;同时可诱导植物的抗病性或促进植株生长,从而达到保护植株的目的[4]。与化学防治药剂相比,拮抗菌产生的抑菌物质具有毒性低、对环境友好,降低病原微生物耐药性的优点,可安全地应用于植物病害防治[5]。但菌株在实际应用过程中,其在土壤中的稳定性和在植物中的定植能力问题有待进一步研究和解决[6],才能提高菌株的存活和增殖能力,确保菌株在可持续农业中的商业化应用推广。【前人研究进展】Wang等[7]从土壤中分离得到贝莱斯芽胞杆菌(Bacillus velezensis)HNAH
17806 ,并从其发酵液中纯化出一种分子量约为 1.5 kDa 的抗真菌肽(BVAP),对菌丝抑制的 IC50 为 5.58 μg·mL−1,其作用机制为增加菌丝的通透性、导致菌丝尖端肿胀。Chen 等对分别从香蕉和茶树根际土壤中分离得到的枯草芽胞杆菌 YBC 和 151B1 进行研究,结果表明菌株在 SYB 培养基的无菌发酵液影响了 F. solani 细胞膜的完整性、抑制分生孢子的萌发和菌丝生长[8]。这些研究表明,拮抗菌在防治百香果茎基腐病中展现了广泛的应用前景及为研究拮抗菌与病原菌互作机制提供了理论参考。拮抗菌通过产生胞外酶水解病原菌细胞壁以破坏菌丝,抑制菌丝生长,常见的细胞壁降解酶类主要有纤维素酶、蛋白酶、几丁质酶,β-1,3-葡聚糖酶等[9]。除了直接抑制病原菌,拮抗菌还表现出显著的植物促生作用。例如,贝莱斯芽胞杆菌W-1对花椒根腐病的抑菌率高达89%,其通过生物固氮、磷酸盐溶解以及分泌植物激素如吲哚-3-乙酸(IAA)、细胞分裂素(CTK)和赤霉素(GA),有效促进植物生长[10,11],为芽胞杆菌在多种作物病害防治中的应用提供了理论支持。此外,杨东亚等[12]发现菌株XY-1、XY-13、XY-53不仅对腐皮镰刀菌抑制效果显著,还能通过产蛋白酶、固氮等途径,显著提高黄瓜幼苗的生物量,进一步证实了拮抗菌在病害防治和植物促生中的双重作用。油茶根部内生的芽胞杆菌AF9和AH6则被发现具有诱导植物产生系统抗性(ISR)的能力[13]。李丽丽等[13]研究表明,这些菌株不仅能有效降低油茶根腐病的发生,还能通过增强植物的抗病性和促进生长,展现出广泛的生防潜力。【本文切入点】尽管前人研究已经表明芽胞杆菌在植物病害生物防治中具有显著的潜力,但关于百香果茎基腐病的生物防治研究较少,特别是在高效生防菌株的筛选和其作用机制方面的研究还不够深入。【拟解决的关键问题】从健康的百香果根际土壤中筛选鉴定拮抗细菌,并进行初步的生防、促生作用研究,进一步明确拮抗菌与病原菌的作用机制,以期为百香果茎基腐病生物防治提供新的菌种资源和理论依据,最终推动生防制剂的开发和应用。1. 材料与方法
1.1 试验材料
1.1.1 培养基
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)[14]:葡萄糖20 g、琼脂20 g 、土豆粉6 g,去离子水定容至1 000 mL。
LB培养基(luria-bertani medium)[15]:胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g。(LB固体培养基在LB培养基的基础上加入18 g琼脂)。
1.1.2 根际土壤样品采集
广西南宁市上林县白圩镇(108°48′ 28.54″E, 23°26′ 17.25″N)健康黄金、维蜜、钦蜜百香果根际土各2份,广西南宁市良庆区那马镇(108°26′ 43.13″E, 22°38′ 40.82″N)健康台农一号百香果根系土1份。
1.2 试验方法
1.2.1 根际土壤细菌分离
采用稀释涂布法[16]分离土壤中的细菌,称取1 g根际土壤样品,加入9 mL无菌水,并稀释至10−5倍液,分别吸取10−3、10−4、10−5倍液各100 µL涂板,每个浓度重复3次,置于28 ℃培养箱中培养。根据菌落大小、颜色、质地、光泽及表面形态等特征挑选形态差异显著的单菌落用平板划线法纯化,转接至新的LB固体培养基平板上培养,4 ℃保存备用。
1.2.2 拮抗细菌的筛选
采用平板对峙法对分离纯化的菌株进行初筛和复筛,以F. solani为靶标菌,当菌落直径培养至6~7 cm后,从菌丝边缘打取菌饼接种至PDA培养基中央,并在距病原菌2.2 cm的四周接种4种不同的待测菌株,对照为只接种病原菌,设3次重复,置于28 ℃培养箱中培养,待对照菌丝长满平板,测量各处理的菌落直径大小,计算抑制率 [17]。抑制率/%=[(对照菌落直径−菌饼直径)−(处理菌落直径−菌饼直径)]/(对照菌落直径−菌饼直径)×100。将初筛具有明显抑制作用的菌株进行复筛,在距病原菌2.2 cm的两侧接种同种菌株,其余步骤参照初筛。
1.2.3 拮抗菌鉴定
将菌株划线培养于LB固体培养基后置于28 ℃培养箱中培养5 d 后观察不同菌株单菌落的形态特征。采用菌落PCR的方法,以通用引物27F/1492R[18]进行PCR扩增,PCR反应体系(50.0 μL):2×Taq MasterMix 25.0 μL,上、下游引物各2.0 μL,DNA模板为少量菌体,ddH2O 19.0 μL;反应程序:预变性95 ℃、5 min;变性95 ℃、30 s,退火56 ℃、30 s,延伸72 ℃、1 min,33个循环;终延伸72 ℃、10 min。扩增产物纯化回收,并克隆至载体pUC-19T上(具体步骤参照Takara TA克隆试剂盒说明书),送至上海生工生物有限公司进行测序,并将测序结果在National Center for Biotechnology Information(https://www.ncbi.nlm.nih.gov/BLAST/)数据库中进行比对,利用 MAGA11.0软件中的邻接法构建菌株与其相关近缘属种的系统发育树。
1.2.4 拮抗菌抗生素相关基因检测
参照宋文欣[19]的引物进行抗生素基因引物合成。以拮抗菌株的总DNA为模板,以表1所示引物进行PCR扩增,对mycB(抗霉枯草菌素)、ifuA(伊枯草菌素)、yndj、fenB(丰原素)和bacA(溶杆菌素)5种抗生素产生相关基因进行检测,扩增产物经1.0%琼脂糖凝胶电泳检测。
表 1 检测抗生素产生相关基因的引物序列Table 1. Primers for detecting genes related to antibiotic production基因名称
Genes引物名称
Primer引物序列(5′→3′)
Primer sequences退火温度
Annealing temperature/ ℃mycB MycB-F ATGTCGGTGTTTAAAAATCAAGTAACG 55 MycB-R TTAGGACGCCAGCAGTTCTTCTATTGA fenB FenB-F CTATAGTTTGTTGACGGCTC 55 FenB-R CAGCACTGGTTCTTGTCGCA ifuA IfuA-F ATGTATACCAGTCAATTCC 55 IfuA-R GATCCGAAGCTGACAATAG bacA BacA-F CAGCTCATGGGAATGCTTTT 58 BacA-R CTCGGTCCTGAAGGGACAAG yndj 147-F CAGAGCGACAGCAATCACAT 55 147-R TGAATTTCGGTCCGCTTATC 1.2.5 拮抗菌胞外酶检测
参考宋文欣[19]的方法,将拮抗菌株点接至10 mL LB培养基置于28 ℃、200 r·min−1的摇床培养12 h后吸取500 μL至新的20 mL LB培养基中扩大培养至OD600=0.6,吸取菌液1 μL均匀的点接在距蛋白酶、纤维素酶、几丁质酶、β,1-3-葡聚糖酶、木聚糖酶检测平板中心2.2 cm处,CK为点接等量的LB培养基,重复3次,置于28 ℃培养箱中培养3 d,观察菌落周围是否产生透明圈,若产生透明圈,测量菌株直径和透明圈直径的大小。而纤维素酶活性检测在培养相同时间后加入10 mL的1 mg·mL−1刚果红静置30 min后,倒掉该溶液,加入等量的1 mol·L−1 NaCl静置30 min后倒掉,观察菌落周围是否产生透明圈,若产生透明圈,测量菌株及透明圈直径的大小。
1.2.6 拮抗细菌菌株对番茄种子的促生作用研究
参考杨晓云[20]的方法并稍改动,先用无菌水浸泡番茄的种子(品种为抗枯番茄)12 h,接着用1%次氯酸钠溶液浸泡消毒10 min,再用无菌水清洗3次后置于无菌培养皿中待用;将拮抗菌培养至OD600=0.8,吸取5 mL菌液浸泡12 h,对照为等量的LB培养基,经菌液浸泡过的种子用无菌水清洗表面菌体,吸干表面水分,将种子置于有湿润滤纸的瓶子中,每处理20颗,设3次重复。48 h记录种子的发芽率,7 d后测量种子的胚根长、胚芽长等生物量,计算种子的平均发芽率,胚根和胚芽的均值和标准差。
1.2.7 拮抗菌相容性研究
于同一LB固体培养基平板上接种不同菌株研究其相容性,将拮抗细菌划线接种至LB固体培养基上并两两相交,置于28 ℃培养箱中培养5 d,试验重复3次,观察菌株间是否存在抑菌带或抑菌圈,上述两种现象均无表示菌株相容,反之则不相容[21]。
1.3 数据统计与分析
使用软件IBM SPSS Statistics 25进行统计学分析,采用Duncan新复极差法进行多重比较。
2. 结果与分析
2.1 拮抗菌分离与筛选
采用平板对峙法对分离纯化菌株进行筛选,共分离得到52株菌株,其中8株具有拮抗作用,对病原菌的抑制率介于42.18%~57.81%(图1),其中NN-Q01-10、SL-Q02-05、SL-Q02-06对病原菌抑制效果最好,抑制率分别为57.81%、57.34%、57.34%。
2.2 拮抗菌鉴定
2.2.1 形态学观察
拮抗细菌形态学观察结果(图2)显示SL-Q02-04、SL-Q02-06、SL-Q03-01、NN-Q04-01菌落近圆形,表面干燥,易挑起,不凸起,表面有少量杆状褶皱,菌落米白色,边缘不光滑,不透明。SL-Q02-05、NN-Q03-01菌落圆形,表面干燥,易挑起,不凸起,表面有杆状褶皱,质地较粗糙,菌落米白色,边缘不光滑,不透明。NN-Q03-09菌落圆形,表面干燥,凸起,易挑起,有褶皱,菌落白色,边缘不光滑,不透明。NN-Q03-10菌落圆形,表面干燥,凸起,不易挑起,有褶皱,菌落白色,边缘不光滑,不透明。
2.2.2 分子鉴定
分别以8个拮抗菌株的DNA为模板扩增16S rDNA,得到
1514 bp大小的片段,测序结果提交至NCBI获得登录号(PP917510~PP917517)。在NCBI中进行Blast比对,并基于16S rDNA基因构建进化树,以蜡样芽胞杆菌(B. cereus)为外群(图3)。其中,SL-Q02-04与Bacillus subtilis subsp. subtilis str. 168聚为一支,SL-Q02-06、SL-Q03-01与Bacillus subtilis strain QB61聚为一支,NN-Q04-01与Bacillus inaquosorum strain BIM B-2002聚为一支,SL-Q02-05、NN-Q03-01、NN-Q03-09、NN-Q03-10与Bacillus velezensis strain XHA16聚为一支,表明分离菌株主要属枯草芽胞杆菌(B. subtilis)、贝莱斯芽胞杆菌(B. velezensi)、枯草芽胞杆菌沙漠亚种(B. subtilis subsp. inaquosorum)。2.3 拮抗菌抗生素相关基因检测
由抗生素合成相关基因PCR产物电泳结果(图4)可以看出8个菌株均具有bacA、FenB、yanJ抗生素基因,推测其基因组具有可产生相应的抗生素类物质的基因,此外,SL-Q02-05、NN-Q03-01、NN-Q03-09、NN-Q03-10扩增得到MycB(抗霉枯草菌素)、ifuA(伊枯草菌素)相应的单一条带。根据抗生素相关基因检测结果推测拮抗菌株可能在发酵培养条件下产生相关抗生素,可进一步进行抗生素合成基因簇预测,及抗生素提取、纯化、鉴定等试验验证。
2.4 拮抗细菌胞外酶活性
通过蛋白酶、纤维素酶、β-1,3-葡聚糖酶及木聚糖酶的检测平板测定8个拮抗菌株的胞外酶活性。结果显示,所有菌株均可分泌这四种胞外酶,NN-Q03-09产蛋白酶能力最强,同时拮抗菌株在β-1,3-葡聚糖酶检测平板上产生的透明圈边界不清晰,证明产生β-1,3-葡聚糖酶的能力较弱,而在木聚糖平板上可产生相对明显的透明圈(图5)。
2.5 拮抗细菌菌株对番茄种子促生作用研究
番茄种子在不同拮抗菌液处理后,结果显示番茄种子的长势较好,有6个菌株(SL-Q02-04、SL-Q02-05、SL-Q02-06、SL-Q03-01、NN-Q03-01、NN-Q03-10)对胚根生长具有明显的促进作用,其中SL-Q02-04最为明显,该菌株菌液处理后番茄幼苗的胚根最长为7.32 cm;所有菌株对番茄发芽率和胚芽生长均没有促进作用(图6、表2)。
表 2 不同拮抗菌处理下番茄种子的生物量统计Table 2. Statistics on tomato seed biomass under antagonistic treatments处理
Treatment发芽率
Germination percentage/%胚根长
Embryo root
length/cm胚芽长
Embryo length/cmCK 0.87±0.03 a 4.76±0.24 d 5.31±0.11 a SL-Q02-04 0.75±0.00 abc 7.32±0.06 a 5.39±0.61 a SL-Q02-05 0.83±0.07 ab 6.03±0.04 bc 5.77±0.17 a SL-Q02-06 0.72±0.02 bc 6.65±0.12 ab 5.16±0.33 a SL-Q03-01 0.87±0.08 abc 6.17±0.24 b 5.83±0.10 a NN-Q03-01 0.77±0.07 c 6.67±0.14 ab 4.50±0.13 a NN-Q03-09 0.85±0.03 ab 5.07±0.51 d 4.70±1.02 a NN-Q03-10 0.87±0.05 a 6.63±0.16 ab 5.83±0.25 a NN-Q04-01 0.77±0.02 abc 5.29±0.21 cd 5.33±0.11 a 表中数据为平均数±标准误。同列不同小写字母表示经Duncan氏新复极差法检验差异显著(P<0.05)。
Data are average ± standard error; those with different lowercase letters on same column indicate significant difference by Duncan's new complex range test (P<0.05).2.6 拮抗菌相容性
对8个拮抗菌株进行相容性测定,结果显示菌株接种培养5 d后(图7),NN-Q04-01与剩余菌株均不相容,SL-Q02-05、SL-Q02-06、SL-Q03-01、NN-Q03-09间不相容,SL-Q02-06与NN-Q03-01不相容,SL-Q03-01与NN-Q03-01不相容,部分相容性较好的拮抗菌株可用于后续的复合使用。
3. 讨论与结论
生物防治是农业生产上安全、有效的防控方法,近年来研究应用较为广泛。然而,关于百香果茎基腐病的生物防治研究相对较少,主要以化学防治为主,尽管已有部分拮抗真菌和细菌被筛选出来,但其应用范围仍然有限。菌株筛选和鉴定是拮抗菌开发和应用的基础[22],本研究从健康的百香果根际土壤分离筛选出8株具有抑制作用的拮抗菌株,主要包括枯草芽胞杆菌、贝莱斯芽胞杆菌、枯草芽胞杆菌沙漠亚种。这表明健康植株根际土壤是有效生防材料的来源之一。
Wang等[7]从贝莱斯芽胞杆菌B. velezensis HNAH
17806 发酵液中分离得到抗真菌肽BVAP,并鉴定为丰原素,其通过增加真菌膜通透性,诱导菌丝膨胀,导致核酸和几丁质在膨胀部位异常积累。本研究中贝莱斯芽胞杆菌B. velezensis菌株NN-Q03-01、NN-Q03-09、NN-Q03-10可检测到FenB抗生素基因,这与Wang等[7]的研究结果一致,为后续进一步验证该抗生素基因的功能提供了基础。Chen等[8]研究发现枯草芽胞杆菌菌株151B1和YBC的发酵菌液可影响腐皮镰刀菌F. solani的膜完整性并诱导其凋亡。同时151B1菌株还能产生iturin A化合物,推测该脂肽可诱导病原菌的凋亡。此外,Ntushelo等[23]指出,iturins与真菌细胞膜接触后可形成离子传导孔,破坏质膜,导致细胞内含物渗漏。本研究发现,枯草芽胞杆菌SL-Q02-05能够扩增出ifuA抗生素基因,与前人研究结果一致,后续研究将进一步验证该菌株的抗菌活性。植物病原菌细胞壁主要由纤维素、葡聚糖、蛋白质组成,胞外酶的产生有利于破坏病原菌细胞壁结构,从而发挥抑菌作用[24]。本研究通过胞外酶检测证实, 8个菌株均具有产生蛋白酶、纤维素酶、β-1,3-葡聚糖酶、木聚糖酶的能力,尤其是产蛋白酶与纤维素酶的能力较强,因而表现较好的抑制效果,推测为拮抗菌与病原菌的作用机制之一,后续可进行病原菌与拮抗菌作用机制相关研究。前人研究表明枯草芽胞杆菌YB-04、LY-1,能分泌胞外蛋白酶、淀粉酶、纤维素和β-1,3-葡聚糖酶等胞外酶,分解植物病原菌细胞壁抑制其生长[25,26],与本研究结果相符。上述研究结果证实拮抗菌通过分泌胞外酶抑制病原菌生长,为进一步明确拮抗菌与病原菌的作用机制奠定了理论基础。此外,研究发现可通过相容性试验筛选复配菌株,实现菌株之间的优势互补,增强生防效果和稳定性[27]。枯草芽胞杆菌菌株EPCO16、 EPC5与荧光假单胞菌菌株Pf1联合使用可有效抑制F. solani的生长,并提高β-1,3-葡聚糖酶、几丁质酶、酚类酶的活性,表明复配菌株间具有协同作用,增强了防治效果[28]。这一结果为探究不同菌株的协同防治效应及其在开发混合菌剂的应用研究提供理论参考。
-
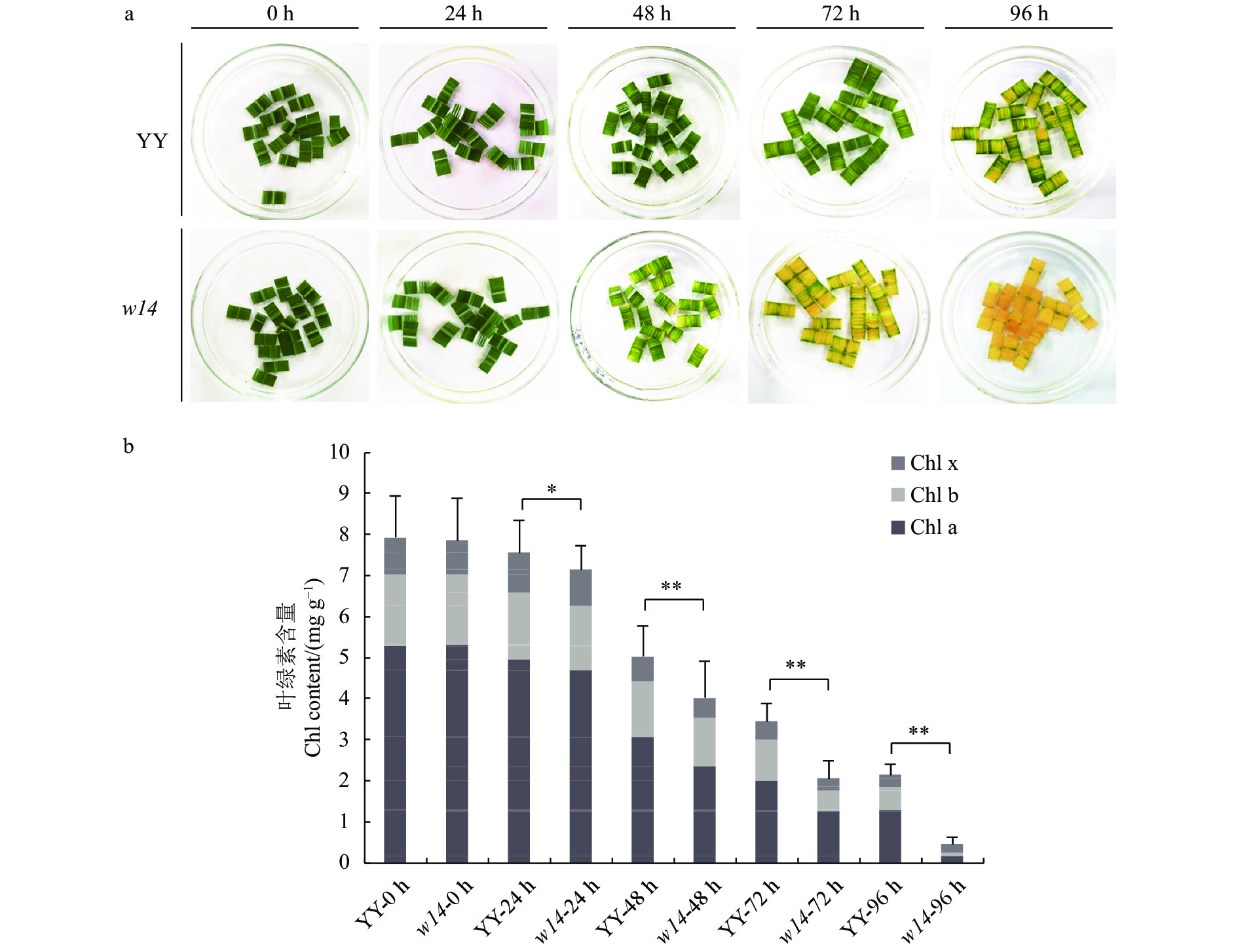
图 1 突变体w14和野生型的离体叶片黑暗诱导处理鉴定结果
注:a:处理0~96 h离体叶片的衰老表型;b:处理0~96 h离体叶片的叶绿素含量测定;Chla、Chlb和Chlx分别代表叶绿素a、叶绿素b和类胡萝卜素;*和**分别表示在0.05和0.01水平差异显著。
Figure 1. Early senescence on mutant w14 and wild-type YY rice plants after in vitro darkness-induction
Note:a: Senescence phenotype of leaves treated for 0-96 h. b: Chlorophyll content of leaves treated for 0-96 h; *and** show significant difference at 0.05 and 0.01 levels, respectively.
图 2 突变体w14与野生型YY接种水稻白叶枯病发病后的症状
注:a:成株期田间接种水稻白叶枯病后的发病症状;b:室内苗期接种和大田成株期接种后发病结果;**表示在0.01水平显著差异。
Figure 2. Symptoms on diseased mutant w14 and wild-type YY after inoculation of rice bacterial blight
Note:a: Symptoms of rice bacterial blight after field inoculation on rice plants at adult stage. b: Statistics on occurrence of bacterial blight on rice plants after indoor inoculation at seedling stage and field inoculation at adult stage; ** shows significant difference at 0.01 level.
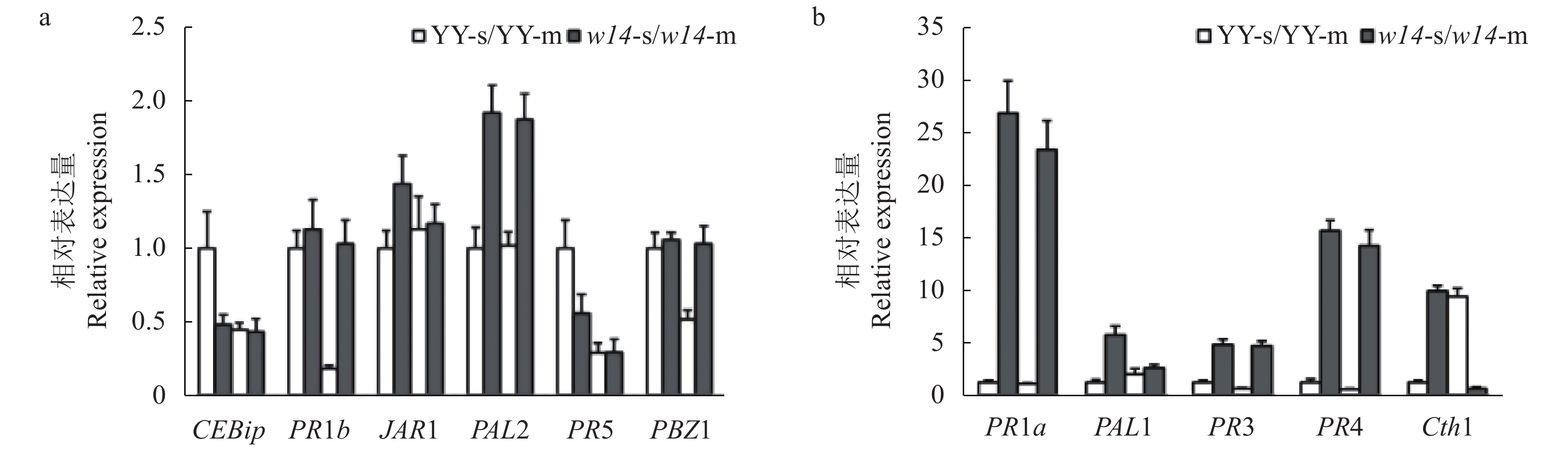
图 4 突变体w14与野生型YY水稻病程相关基因的表达分析
注:a:CEBip、PR1b、JAR1、PAL2、PR5和PBZ1的表达;b:PR1a、PAL1、PR3、PR4和Cth1的表达;YY-s、YY-m、w14-s、w14-m中的s和m分别表示苗期和成熟期。
Figure 4. Expressions of rice pathogenesis-related genes of mutant w14 and wild-type YY
Note:a: Expression levels of CEBip, PR1b, JAR1, PAL2, PR5, and PBZ1. b: Expression levels of PR1a, PAL1, PR3, PR4, and Cth1; s and m in YY-s, YY-m, w14-s and w14-m represent seedling stage and maturity stage, respectively.
表 1 突变体w14和野生型的稻瘟病抗性鉴定结果
Table 1 Resistance to blast disease of mutant w14 and wild-type YY
菌株 Strain 表型 Phenotype(w14/YY/LTH) 菌株 Strain 表型 Phenotype(w14/YY/LTH) SM17021-2 S/S/S NH15092 S/S/S NH15039 S/S/S NH15040 S/R/S JY14027 S/S/S NH17025 R/R/S SM17019-2 S/R/S JY15013 S/S/S NH17026-8 S/S/S SM17019-1 R/R/S NH13093 S/R/S JY15027 R/R/S JL15140 R/R/S SM17020-7 R/R/S JL15131 R/R/S NJ08022 S/R/S SH17004 S/R/S NH17029 R/R/S SM17021 S/S/S SM17020-3 S/S/S NH17028 S/R/S NH17026-4 S/R/S JY15015 S/R/S NH17026-7 R/R/S -
[1] LIM P O, KIM H J, GIL NAM H. Leaf senescence [J]. <italic><italic> Annual Review of Plant Biology</italic></italic>, 2007, 58(1): 115−136. DOI: 10.1146/annurev.arplant.57.032905.105316
[2] 杨波, 夏敏, 张孝波, 等. 水稻早衰突变体<italic>esl6</italic>的鉴定与基因定位 [J]. 作物学报, 2016, 42(7):976−983. DOI: 10.3724/SP.J.1006.2016.00976 YANG B, XIA M, ZHANG X B, et al. Identification and gene mapping of an early senescent leaf Mutantesl6 in <italic>Oryza sativa</italic> L. [J]. <italic><italic> Acta Agronomica Sinica</italic></italic>, 2016, 42(7): 976−983.(in Chinese) DOI: 10.3724/SP.J.1006.2016.00976
[3] YOSHIDA S. Molecular regulation of leaf senescence [J]. <italic><italic> Current Opinion in Plant Biology</italic></italic>, 2003, 6(1): 79−84. DOI: 10.1016/S1369526602000092
[4] 赵春德, 张迎信, 刘群恩, 等. 一个水稻早衰突变体基因的精细定位 [J]. 中国农业科学, 2014, 47(11):2069−2077. DOI: 10.3864/j.issn.0578-1752.2014.11.001 ZHAO C D, ZHANG Y X, LIU Q N, et al. Fine mapping of an early senescence gene in rice [J]. <italic><italic> Scientia Agricultura Sinica</italic></italic>, 2014, 47(11): 2069−2077.(in Chinese) DOI: 10.3864/j.issn.0578-1752.2014.11.001
[5] SCHIPPERS J H M, SCHMIDT R, WAGSTAFF C, et al. Living to die and dying to live: The survival strategy behind leaf senescence [J]. <italic><italic> Plant Physiology</italic></italic>, 2015, 169: 914−930. DOI: 10.1104/pp.15.00498
[6] 王备芳, 陈玉宇, 张迎信, 等. 水稻早衰突变体<italic>es5</italic>的鉴定及其突变基因的精细定位 [J]. 中国农业科学, 2018, 51(4):613−625. DOI: 10.3864/j.issn.0578-1752.2018.04.002 WANG B F, CHEN Y Y, ZHANG Y X, et al. Identification and Fine Mapping of an Early Senescent Leaf Mutant <italic>es5</italic> in <italic>Oryza sativa</italic> L. [J]. <italic><italic> Scientia Agricultura Sinica</italic></italic>, 2018, 51(4): 613−625.(in Chinese) DOI: 10.3864/j.issn.0578-1752.2018.04.002
[7] LIANG C Z, WANG Y Q, ZHU Y N, et al. OsNAP connects abscisic acid and leaf senescence by fine-tuning abscisic acid biosynthesis and directly targeting senescence-associated genes in rice [J]. <italic><italic> Proceedings of the National Academy of Sciences of the United States of America</italic></italic>, 2014, 111(27): 10013−10018. DOI: 10.1073/pnas.1321568111
[8] SAKURABA Y, RAHMAN M L, CHO S H, et al. The rice faded green leaf locus encodes protochlorophyllide oxidoreductase B and is essential for chlorophyll synthesis under high light conditions [J]. <italic><italic> The Plant Journal</italic></italic>, 2013, 74(1): 122−133. DOI: 10.1111/tpj.12110
[9] LIN A H, WANG Y Q, TANG J Y, et al. Nitric oxide and protein S-nitrosylation are integral to hydrogen peroxide-induced leaf cell death in rice [J]. <italic><italic> Plant Physiology</italic></italic>, 2012, 158(1): 451−464. DOI: 10.1104/pp.111.184531
[10] KONG Z S, LI M N, YANG W Q, et al. A novel nuclear-localized CCCH-type zinc finger protein, OsDOS, is involved in delaying leaf senescence in rice [J]. <italic><italic> Plant Physiology</italic></italic>, 2006, 141(4): 1376−1388. DOI: 10.1104/pp.106.082941
[11] CHA K W, LEE Y J, KOH H J, et al. Isolation, characterization, and mapping of the stay green mutant in rice [J]. <italic><italic> Theoretical and Applied Genetics</italic></italic>, 2002, 104(4): 526−532. DOI: 10.1007/s001220100750
[12] YOSHIDA S, ITO M, NISHIDA I, et al. Identification of a novel gene HYS1/CPR5 that has a repressive role in the induction of leaf senescence and pathogen-defence responses in <italic>Arabidopsis thaliana</italic> [J]. <italic><italic> The Plant Journal</italic></italic>, 2002, 29(4): 427−437. DOI: 10.1046/j.0960-7412.2001.01228.x
[13] AKI T, KONISHI M, KIKUCHI T, et al. Distinct modulations of the hexokinase1-mediated glucose response and hexokinase1-independent processes by HYS1/CPR5 in <italic>Arabidopsis</italic> [J]. <italic><italic> Journal of Experimental Botany</italic></italic>, 2007, 58(12): 3239−3248. DOI: 10.1093/jxb/erm169
[14] GU K, TIAN D, YANG F, et al. High-resolution genetic mapping of Xa27(t), a new bacterial blight resistance gene in rice, <italic>Oryza sativa</italic> L. [J]. <italic><italic> Theoretical and Applied Genetics</italic></italic>, 2004, 108(5): 800−807. DOI: 10.1007/s00122-003-1491-x
[15] YOU Q Y, ZHAI K R, YANG D L, et al. An E3 ubiquitin ligase-BAG protein module controls plant innate immunity and broad-spectrum disease resistance [J]. <italic><italic>Cell Host & Microbe</italic></italic>, 2016, 20(6): 758−769.
[16] LENG Y J, YANG Y L, REN D Y, et al. A rice PECTATE LYASE-LIKE gene is required for plant growth and leaf senescence [J]. <italic><italic> Plant Physiology</italic></italic>, 2017, 174(2): 1151−1166. DOI: 10.1104/pp.16.01625
[17] 张涛, 孙玉莹, 郑建敏, 等. 水稻早衰叶突变体PLS2的遗传分析与基因定位 [J]. 作物学报, 2014, 40(12):2070−2080. DOI: 10.3724/SP.J.1006.2014.02070 ZHANG T, SUN Y Y, ZHENG J M, et al. Genetic analysis and fine mapping of a premature leaf senescence mutant in rice (<italic>Orzya sativa</italic> L.) [J]. <italic><italic> Acta Agronomica Sinica</italic></italic>, 2014, 40(12): 2070−2080.(in Chinese) DOI: 10.3724/SP.J.1006.2014.02070
[18] BUCHANAN-WOLLASTON V, PAGE T, HARRISON E, et al. Comparative transcriptome analysis reveals significant differences in gene expression and signalling pathways between developmental and dark/starvation-induced senescence in <italic>Arabidopsis</italic> [J]. <italic><italic> The Plant Journal</italic></italic>, 2005, 42(4): 567−585. DOI: 10.1111/j.1365-313X.2005.02399.x
[19] 左海龙, 肖珂, 张永娟, 等. 控制水稻叶片叶绿素含量及其离体叶片叶绿素降解速度相关的QTL定位(简报) [J]. 分子细胞生物学报, 2007, 40(5):346−350. ZUO H L, XIAO K, ZHANG Y J, et al. Mapping of QTLs controlling leaf chlorphyll content and chlorphyll degradation speed of detached leaves in rice [J]. <italic><italic>Journal of Molecular Cell Biology</italic></italic>, 2007, 40(5): 346−350.(in Chinese)
[20] 郑建敏, 张涛, 郑家奎. 水稻叶片衰老相关基因的研究进展 [J]. 基因组学与应用生物学, 2009, 28(5):1010−1019. DOI: 10.3969/gab.028.001010 ZHENG J M, ZHANG T, ZHENG J K. Research advances on the genes related to rice leaf senescence [J]. <italic><italic> Genomics and Applied Biology</italic></italic>, 2009, 28(5): 1010−1019.(in Chinese) DOI: 10.3969/gab.028.001010




 下载:
下载: