High-throughput Sequencing Analysis on Diversity of Bacterial and Fungal Endophytes on Huanglongbing-infected Citrus Plants
-
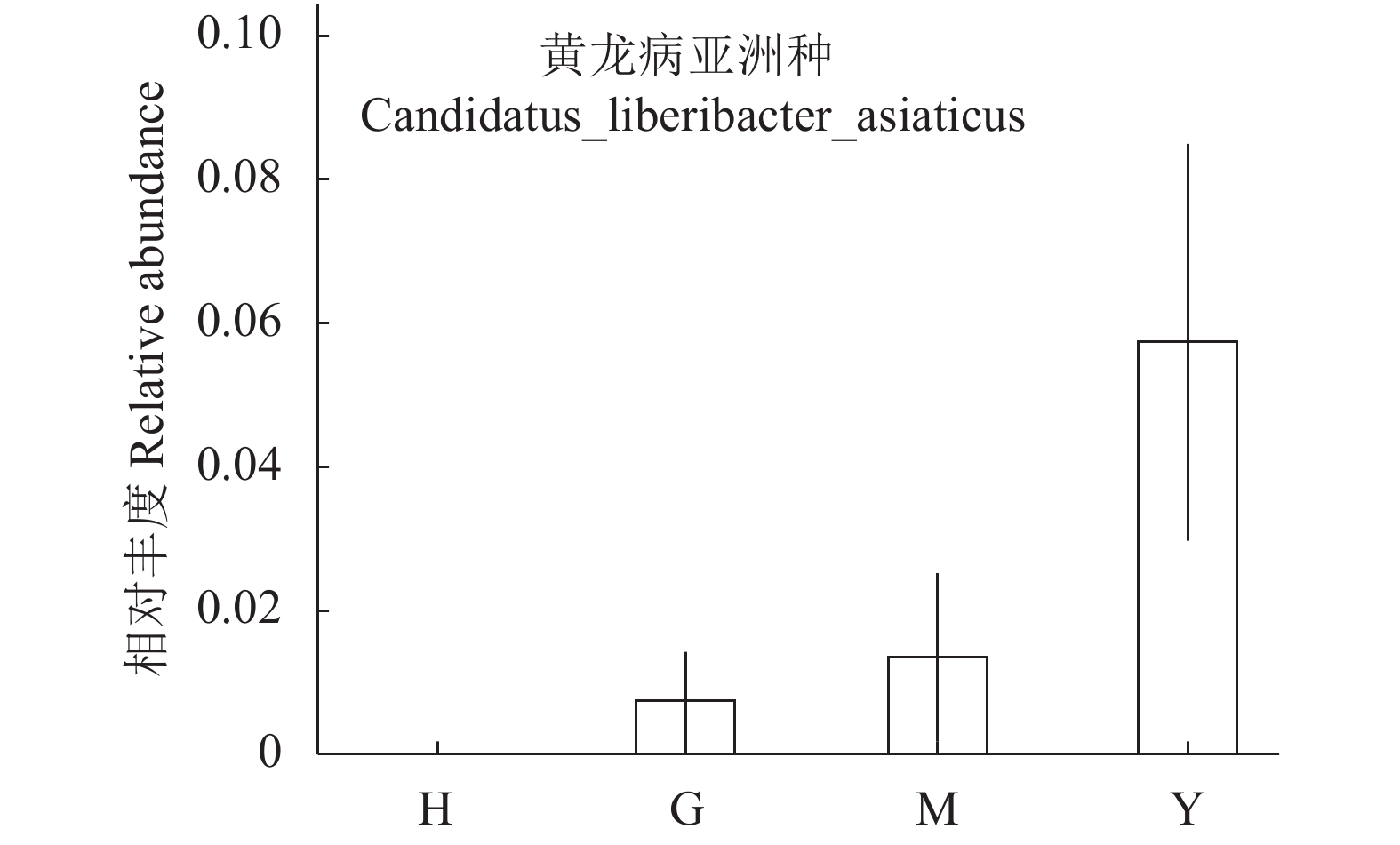
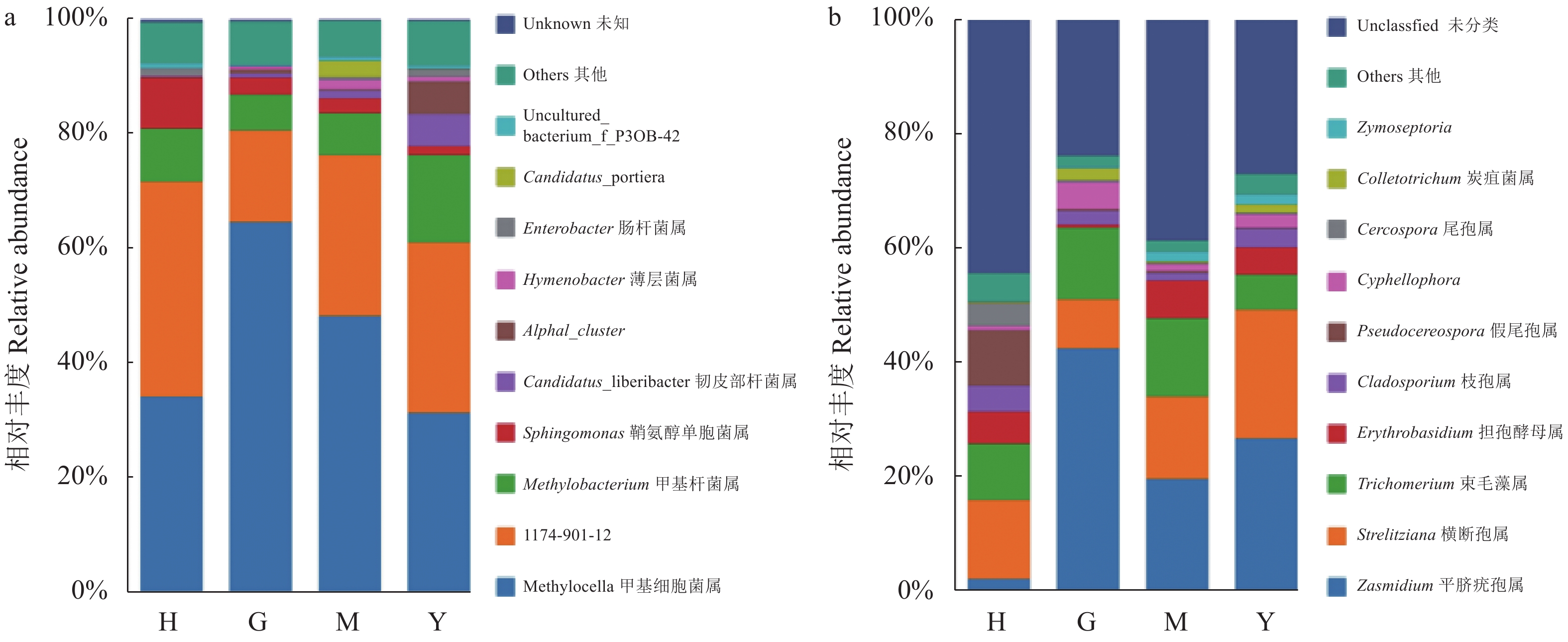
摘要:目的 比较健康、罹病柑橘叶片在温室条件下内生菌群落结构差异,以及同一植株不同罹病程度叶片的内生菌群落结构差异,分析黄龙病侵染相关的内生细菌和内生真菌种群动态变化,为柑橘黄龙病菌的共培养和病原学研究提供依据。方法 通过引物对OI1/OI2c对植株染黄龙病的状态进行检验,以健康和不同罹病程度(无症绿色、斑驳黄化、均匀黄化)的柑橘叶片为样本,通过对细菌16S rRNA和真菌rDNA-ITS序列的高通量测序,将得到的内生细菌和内生真菌的数据进行聚类和多样性分析。结果 4组样品分别通过聚类获得13个门类、22个纲、57个目、101个科、208个属的细菌,以及2个门类、12个纲、24个目、43个科、43个属的真菌。黄龙病菌的相对丰度随着叶片罹病程度的加深而增加。健康组和罹病组共有的细菌优势菌属为甲基细胞菌属、1174-901-12属。Sphingomonas属为健康组的优势菌属。AlphaI cluster属和Hymenobacter属的相对丰度随黄龙病的入侵增加。健康组和罹病组共有的真菌优势菌属为横断孢属,Zasmidium属和Trichomerium属只为罹病组的次优势菌属。Zymoseptoria属的相对丰度与黄龙病菌呈正相关。结论 黄龙病菌的侵入改变了植株内生细菌和内生真菌的群落结构和多样性,健康组和罹病组的内生细菌、内生真菌群落结构多样性存在明显差异,其优势及次优势菌属及其相对丰度也有存在差异。高通量测序对植物样本的直接检测能有效避开前人使用传统检测的短板,获得包括难培养、低丰度菌群在内更完整的内生菌群落结构,为更系统分析与黄龙病菌入侵生长相关内生菌和寻找其潜在伴生菌的研究提供依据。Abstract:Objective Diversity of bacterial and fungal endophytes on citrus plants infected with Huanglongbing (HLB) (citrus greening disease by Candidatus Liberibacter) was determined for further study on the pathology.Method The diversities of bacterial and fungal endophytes on healthy and HLB-diseased leaves of citrus plants grown in a greenhouse were compared. In addition, the diversities on the diseased leaves of different severity from a same plant were also compared. The HLB pathogen was confirmed using primer pair of OI1/OI2c. High-throughput sequencing were used to detect the 16S rRNA of bacteria and rDNA-ITS of fungi. Then the abundance and diversity analysis on the endophytes were conducted.Result For the bacterial endophytes, there were 13 phyla, 22 classes, 57 orders, 101 families, and 208 genera found, while for the fungal endophytes, 2 phyla, 12 classes, 24 orders, 43 families, and 43 genera. The relative abundance of Candidatus Liberibacter increased with severity of the disease. Methylocella and 1174-901-12 were the dominant bacteria endophytes on both healthy and diseased plants; whereas, Sphingomonas only on healthy plants. The relative abundances of Alpha cluster and Hymenobacter increased with the disease infection. Strelitziana was the dominant fungal endophyte on both healthy and diseased plants; whereas, Zasmidium and Trichomerium on diseased plants only. The relative abundance of Zymoseptoria increased with the disease infection.Conclusion The infection of HLB by Candidatus Liberibacter bacteria changed the abundance and diversity of bacterial and fungal endophytes on a citrus plant. There were also significant differences on the diversity of bacterial and fungal endophytes between the healthy and the diseased plants. Successful detection of the endophytes using high-throughput sequencing overcame the obstacles on the disease identification due to the unculturable pathogen and endophytes as well as the endophytes with low abundance. It also allowed a systematic study on the microbiology associated with HLB and the cure and prevention of the disease.
-
0. 引言
【研究意义】七叶一枝花(Paris polyphylla var.chinensis)为百合科(Liliaceae)重楼属(Paris)的多年生草本药用植物,已被2020年版《中国药典》收录[1]。由于市场需求量大幅增长,民间过度挖掘,野生七叶一枝花资源日益减少,人工栽培生长缓慢,导致七叶一枝花资源紧缺[2−3]。发展人工种植已成为实现七叶一枝花保护和可持续利用的有效途径。近年来,随着七叶一枝花种植面积增大和种植年限延长,种植技术、种植模式和病虫害等问题,严重影响七叶一枝花的产量和品质,威胁种植区的可持续发展[4]。其中,土壤微生物的多样性及丰富度对药用植物的产量和品质具有重要影响[5]。因此,研究不同栽培模式下土壤微生物的组成和多样性差异对七叶一枝花的栽培管理和维护具有指导意义。【前人研究进展】已有研究报道,不同的栽培模式影响人参根际土壤微生物的组成、多样性及菌群功能特征[6−8];人参根际土壤中的微生物群落组成影响产量和品质[9]。众多研究者对七叶一枝花野生转人工栽培技术进行研究[10−11],结果表明影响七叶一枝花生长发育的主要因素是栽培环境、根际土壤微生物群落数量及合适的引种[12−14],因其与根际土壤中的微生物相互作用[15],所以,土壤微生态环境是七叶一枝花适宜栽培环境的必要条件。【本研究切入点】但是,目前关于七叶一枝花土壤细菌群落的多样性研究不足,栽培和野生七叶一枝花的土壤细菌群落的组成及多样性的差异有待进一步阐明。【拟解决的关键问题】本研究利用宏基因组高通量测序探究栽培和野生七叶一枝花土壤细菌群落组成及多样性的差异,以期探明栽培和野生七叶一枝花与土壤微生物的关系,为优质七叶一枝花栽培生产的科学选址提供理论依据。
1. 材料与方法
1.1 采样点设置
2016年9月,在福建省南平市的七叶一枝花野生环境(群体分布,密度为15~20 株·m−2)和人工栽培环境(常规管理,林下种植,透光率0.5~0.6,整地做畦,排水防涝,栽培密度为25 cm×30 cm,人工拔草。)。各选取2个样地,采样信息详见表1。采用“梅花5点”方法随机选取5株长势均匀的植株。
表 1 栽培和野生七叶一枝花土壤样本信息Table 1. Information on cultivated and wild P. polyphylla soils编号
Code采集地
Locality栽培模式
Transplanting modes栽培年限
Transplanting period/aYR1 福建省南平市建瓯吉阳镇郭岩山双龙庙 野生 — YNR1 福建省南平市建瓯吉阳镇郭岩山双龙庙 野生 — YR2 福建省南平市建瓯吉阳镇郭岩山双龙庙 野生 — YNR2 福建省南平市建瓯吉阳镇郭岩山双龙庙 野生 — ZR1 福建省南平市建瓯吉阳镇郭岩山双龙庙 栽培 5 ZNR1 福建省南平市建瓯吉阳镇郭岩山双龙庙 栽培 5 ZR2 福建省南平市政和县官湖村王坑陇 栽培 2 ZNR2 福建省南平市政和县官湖村王坑陇 栽培 2 YR和ZR分别代表野生和栽培的根际土壤,YNR和ZNR分别代表野生和栽培的非根际土壤。
YR and ZR represent wild and cultivated rhizosphere soils, respectively; YNR and ZNR represent wild and cultivated non-rhizosphere soils, respectively.1.2 样品采集
参照王子夜等[16]、牛世全等[17]的方法进行样品采集。具体如下:取样前先除去七叶一枝花植株地表1~2 cm的土壤,挖取带有完整根系的0~20 cm深度的土体,将所取得的土样分为根际土和非根际土。根际土样为黏附在根上0~0.5 cm土壤,而不含根系的土壤为非根际土,分别将其混匀装入无菌自封袋中,编号,保存于4 ℃冰箱。
1.3 试验方法
1.3.1 土壤理化性质测定
土壤pH采用pH计测定;土壤有机质采用重铬酸钾容量-外加热法测定,全氮含量采用半微量凯氏定氮法测定,全磷采用NaOH熔融-钼锑抗比色法测定,全钾采用NaOH熔融-火焰光度法测定。以上测定方法参见《土壤农化分析》[18]。
1.3.2 土壤微生物的分离
采用梯度稀释平板涂布法对土壤中的细菌进行分离。称取10 g新鲜土壤,加入装有90 mL无菌水的三角瓶中,剧烈振荡摇匀。在以10−3和10−5分别为土壤原液的稀释浓度,然后取100 µL涂布于LB平板上,每个浓度重复3次。30 ℃恒温培养48 h后,计算细菌的数量。
1.3.3 土壤总DNA的提取
称取250 mg土壤提取土壤DNA,采用Mobio Powersoil DNA Isolation Kit试剂盒的提取方法。采用1.2%琼脂糖凝胶电泳检测提取的DNA质量,后续试验质量浓度为30 ng·μL−1。
1.3.4 土壤16S rRNA基因文库的构建
参考牛世全等[17]的文库构建方法稍作调整,采用两步PCR扩增的方法,首先使用特定的引物(F内侧引物:5′-TTCCCTACACGACGCTCTTCCGATCT-特异引物-3′;R内侧引物:5′-GAGTTCCTTGGCACCCGAGAATTCCA-特异引物-3′)扩增目的片段,利用AxyPrepDNA凝胶回收试剂盒回收目的片段,而后将回收产物作为模板,再次进行PCR扩增(F外侧引物:5′-AATGATACGGCGACCACCGAGATCTACAC-barcode-TCTTTCCCTACACGACGCTC-3′;R外侧引物:5′-CAAGCAGAAGACGGCATACGAGAT-barcode-GTGACTGGAGTTCCTTGGCACCCGAGA-3′)。第一次PCR扩增总体系为50 μL,包括10 μL 5×Buffer,1 μL dNTP(10 mmol·L−1),1 U Phusion 超保真DNA聚合酶,各1 μL F/R内侧引物(10 μmol·L−1),10 ng模板,ddH2O补足体积;PCR扩增反应条件:94 ℃ 2 min;94 ℃ 30 s, 56 ℃ 30 s,72 ℃ 30 s,循环25次;72 ℃ 5 min。第二次PCR扩增总体系为40 μL,包括8 μL 5×Buffer,1 μL dNTP(10 mmol·L−1),0.8 U Phusion 超保真DNA聚合酶,各1 μL F/R内侧引物(10 μmol·L−1),5 μL模板,ddH2O补足体积;PCR扩增反应条件:94 ℃ 2 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,循环8次;72 ℃ 5 min。所获得的PCR产物使用AxyPrepDNA凝胶回收试剂盒进行切胶回收,FTC-3000TM real-time PCR仪进行定量检测。上述样本进行miseq文库制备后,由微基生物科技(上海)有限公司进行illumina miseq 2×300 bp高通量测序。
1.3.5 数据统计和分析
参考牛世全等[17]的方法对测序后的原始数据进行相对应处理获得有效序列数据。采用Mothur(V1.33.3)软件进行OTU(Operational Taxonomic Units)物种分类注释及聚类。由于土壤中物种的丰富度和土壤的测序数据量具有一定差异,所以进一步对所测土壤的测序数据量和丰富度进行合理性检验,使用微基生物科技(上海)有限公司自编程序分析、mothur和R(3.5.1)语言软件进行分析绘制稀释曲线图和韦恩(Venn)图,反映每个样本之间的共有和独有的OTU数目。用mothur软件对土壤细菌群落的进行Alpha多样性指数分析,包括丰富度(Ace指数和Chao指数)及多样性(Simpson指数和Shannon指数)等指数分析。运用R语言软件根据物种分类信息的数据表绘制样本在不同分类水平上的群落结构图,并对不同栽培模式七叶一枝花样本在不同分类学水平的群落丰富度数据进行matastats显著性差异分析(Differentially Abundant Features)。随后采用LDA Effect Size(LEfSE)软件进行线型判别分析(LDA)并作图。利用mothur和R语言软件绘制Principal co-ordinates analysis(PCoA)图和unweighted.unifrac差异性矩阵热图,采用SPSS17数据分析软件进行相关性分析(Pearson)。
2. 结果与分析
2.1 栽培和野生七叶一枝花土壤理化性质
栽培和野生七叶一枝花各样品土壤的pH值在5.10~6.30(表2),均呈酸性。pH值ZR1=ZNR1>YR2>YNR2>YNR1=ZNR2>YR1>ZR2。有机质含量39.70~118.00 g·kg−1,野生有机质含量与栽培有机质含量之间呈显著差异,有机质含量YR1>YR2>YNR2>YNR1>ZR2>ZR1>ZNR1>ZNR2。全氮含量1.40~2.70 g·kg−1,栽培全氮含量与野生全氮含量之间呈显著差异,全氮含量ZNR1>YR1>ZR1>ZR2>YNR1>ZNR2>YR2=YNR2。全磷含量0.30~0.80 g·kg−1,野生全磷含量与栽培全磷含量之间呈显著差异,全磷含量YR2>YR1=YNR2>YNR1=ZR2>ZNR1=ZNR2>ZR1。全钾含量1.00~3.30 g·kg−1,野生全钾含量与栽培全钾含量之间呈显著差异,全钾含量YNR1>YR1>YNR2>ZNR1>YR2=ZR1>ZNR2>ZR2。综上所述,野生的七叶一枝花土壤中的有机质、全氮、全磷和全钾含量均高于栽培土壤。
表 2 栽培和野生七叶一枝花土壤养分含量Table 2. Nutrient contents of cultivated and wild P. polyphylla soils编号
CodepH 有机质
Organic matter/(g·kg−1)全氮
Total nitrogen/(g·kg−1)全磷
Total phosphorus/(g·kg−1)全钾
Total potassium/(g·kg−1)YR1 5.20±0.30ab 118.00±6.81a 2.60±0.15ab 0.70±0.04a 3.20±0.18a YNR1 5.30±0.31ab 105.30±6.08a 1.90±0.11de 0.50±0.03b 3.30±0.19a YR2 5.90±0.34ab 110.10±6.36a 1.40±0.08f 0.80±0.05a 1.50±0.09c YNR2 5.70±0.33ab 107.10±6.18a 1.40±0.08f 0.70±0.04a 1.90±0.11b ZR1 6.30±0.36a 60.70±3.50b 2.30±0.13bc 0.30±0.02c 1.50±0.09c ZNR1 6.30±0.36a 56.80±3.28b 2.70±0.16a 0.40±0.02bc 1.70±0.10bc ZR2 5.10±0.29b 70.30±4.06b 2.20±0.13cd 0.50±0.03b 1.00±0.06d ZNR2 5.30±0.31ab 39.70±2.29c 1.80±0.10e 0.40±0.02bc 1.10±0.06d 同列数据后不同小写字母代表处理间差异显著(P<0.05)。
Data with different lowercase letters on same column indicate significant differences ( P<0.05).2.2 栽培和野生七叶一枝花土壤细菌数量分析
栽培和野生七叶一枝花各样品土壤细菌含量均在106 cfu·g−1以上(表3),说明其中微生物含量丰富。总的来看,南平地区野生七叶一枝花的土壤细菌数量普遍大于栽培七叶一枝花的土壤细菌数量。
表 3 栽培和野生七叶一枝花土壤的细菌分离数量Table 3. Plate counts of cultivated and wild P. polyphylla soils样品名称
Sample name细菌含量
Bacterial content /
(×106 cfu·g−1)样品名称
Sample name细菌含量
Bacterial content /
(×106 cfu·g−1)YR1 5.05 ZR1 3.50 YNR1 4.70 ZNR1 6.85 YR2 8.10 ZR2 5.50 YNR2 8.55 ZNR2 1.75 2.3 栽培和野生七叶一枝花土壤细菌群落OTU组成分析
通过质控筛选,南平地区8份栽培和野生七叶一枝花的土壤,获得360 596个序列,经优化后获得270 081个序列(表4)。从图1可以看出,根据稀释曲线,随着序列数量的增加OTU的数量逐渐趋于平缓,显示了测序样本中所有的物种种类随序列数量增加的变化,即测序所得到的数据合理。之后随着测序数量的增加OTU数量基本趋于稳定,仅有小部分新的OTU产生。表明本试验表取样数据基本合理,可以较真实地反映栽培和野生七叶一枝花土壤细菌群落的变化特征。
表 4 栽培和野生七叶一枝花土壤样本不同分类阶元细菌物种(OTU)数量Table 4. Number of microbes (OTU) at different taxonomical levels of cultivated and wild P. polyphylla soils样本
SampleOTU 门水平
Phylum level纲水平
Class level目水平
Order level科水平
Family level属水平
Genus level种水平
Species levelYR1 1173 19 31 44 73 114 125 YNR1 1049 21 30 46 77 123 131 YR2 1122 20 28 42 73 114 130 YNR2 1173 19 29 40 70 117 128 ZR1 1198 21 31 47 78 142 140 ZNR1 1417 21 31 48 81 138 149 ZR2 630 20 27 34 62 88 85 ZNR2 904 20 27 36 64 108 104 对8份栽培和野生七叶一枝花土壤样品统计发现,共有和特有的细菌OTU数量有8 666种(表4),各土壤OTU个数为904~1 417,其中栽培5年的七叶一枝花的非根际土壤OTU数量最多。如图2韦恩图分析显示,栽培和野生土壤中共有1 827种OTU。其中,野生土壤中特有147种细菌OTU,占野生土壤总OTU的10%,栽培土壤特有356种OTU,占栽培土壤总OTU的21%。如表4所示,不同栽培模式的七叶一枝花OTU数量存在差异。栽培2年七叶一枝花的土壤在门和纲水平上与野生的土壤相当,但是在目、科、属和种水平上低于野生土壤;栽培5年七叶一枝花土壤在门、纲、目、科、属和种水平上均稍大于野生。结果表明,野生七叶一枝花的土壤中微生物种类优于栽培七叶一枝花土壤。
2.4 栽培和野生七叶一枝花土壤细菌物种的丰富度分析
从门和属水平对栽培和野生七叶一枝花土壤中细菌物种多样性和丰富度进行分析,在门水平共检测到21个细菌门(图3A),主要为酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、硝化螺旋菌门(Nitrospirae)和拟杆菌门(Bacteroidetes)等。野生七叶一枝花的土壤中,丰富度大于2%的细菌有9个门,分别为变形菌门(Proteobacteria,42.40%)、放线菌门(Actinobacteria,16.57%)、厚壁菌门(Firmicutes,7.24%)、酸杆菌门(Acidobacteria,33.78%)、绿弯菌门(Chloroflexi,6.00%)、硝化螺旋菌门(Nitrospirae,3.26%)、拟杆菌门(Bacteroidetes,6.62%)、芽单胞菌门(Gemmatimonadetes,2.95%)和浮霉菌门(Planctomycetes,2.53%);栽培七叶一枝花的土壤中,丰富度大于2%的细菌有7个门,分别为变形菌门(Proteobacteria,33.74%)、酸杆菌门(Acidobacteria,33.36%)、放线菌门(Actinobacteria,9.74%)、拟杆菌门(Bacteroidetes,6.72%)、绿弯菌门(Chloroflexi,6.17%)、芽单胞菌门(Gemmatimonadetes,3.56%)和浮霉菌门(Planctomycetes,2.11%)。试验结果表明野生七叶一枝花土壤中细菌的物种更丰富。
在属水平(图3B),共检测到160个细菌属,主要为Unclassfiled、马赛菌属(Massilia)、北里孢菌属(Kitasatospora)、洋葱假单胞菌(Burkholderia)、芽孢杆菌(Bacillus)、类芽孢杆菌(Paenibacillus)。野生七叶一枝花土壤样本中,丰富度大于>1%的细菌有10个属,分别为Unclassfiled(56.85%)、马赛菌属(Massilia,6.83%)、北里孢菌属(Kitasatospora,6.32%)、芽孢杆菌(Bacillus,3.37%)、类芽孢杆菌(Paenibacillus,2.45%)、伯克氏菌属(Burkholderia,2.38%)、Candidatus_Solibacter(1.63%)、Dyella(1.06%)、Tumebacillus(1.01%)和嗜酸栖热菌属(Acidothermus,1.02%);栽培七叶一枝花土壤中,丰富度大于>1%的细菌有10个属,分别为Unclassfiled(63.04%)、北里孢菌属(Kitasatospora,3.53%)、伯克氏菌属(Burkholderia,2.93%)、Bryobacter(1.96%)、溶杆菌属(Lysobacter,1.92%)、黄杆菌属(Flavobacterium,1.90%)、芽单胞菌属(Gemmatimonas,1.87%)、Candidatus_Solibacter(1.63%)、嗜酸栖热菌属(Acidothermus,1.31%)和慢生根瘤菌(Bradyrhizobium,1.29%)。
2.5 栽培和野生七叶一枝花土壤细菌物种多样性的分析
Alpha多样性分析可以反映土壤细菌群落物种的丰富度和多样性。Ace指数和Chao指数越大,群落微生物物种的丰富度高;Shannon指数越大,Simpson指数越小,群落物种的多样性则越高。由表5和图4可知,栽培和野生七叶一枝花土壤中细菌群落Ace和Chao指数表现为:ZNR1 > YR1 > YNR2 > ZR1 > YR2 > YNR1 > ZNR2 > ZR2,七叶一枝花根际土壤中,除移栽5年外(ZR1)土壤,野生七叶一枝花(YR1和YR2)土壤细菌丰富度均大于移栽2年(ZR2)土壤;在非根际土壤中,除移栽5年外(ZNR1)土壤,野生七叶一枝花(YNR1和YNR2)土壤细菌丰富度均大于移栽2年(ZNR2)土壤,说明除移栽5年土壤外,野生七叶一枝花土壤细菌物种的丰富度大于移栽2年的七叶一枝花土壤细菌物种的丰富度。而栽培和野生七叶一枝花的土壤中细菌群落Shannon指数表现为:ZNR1 > ZR1 > YR2 > YR1 > YNR1 > YNR2 > ZNR2 > ZR2,Simpson指数表现为:ZNR1 < ZR1 < YR2 < YNR1 < YR1 < ZNR2 < YNR2 < ZR2,七叶一枝花根际土壤中,野生七叶一枝花(YR1和YR2)土壤细菌多样性均大于移栽2年(ZR2)土壤,在非根际土壤中,除移栽5年外(ZNR1)土壤,野生七叶一枝花(YNR1和YNR2)土壤细菌多样性均大于移栽2年(ZNR2)土壤,说明除移栽5年土壤外,野生七叶一枝花土壤细菌物种的多样性大于移栽2年的土壤。
表 5 栽培和野生七叶一枝花土壤细菌物种的Alpha多样性指数Table 5. Alpha diversity of microbes in cultivated and wild P. polyphylla soils样本 Sample Chao指数
Chao indexAce指数
Ace indexShannon指数
Shannon indexSimpson 指数
Simpson index覆盖率
CoverageYR1 1383.4930 1353.6621 5.2116 0.0200 0.9929 YNR1 1252.7638 1229.8781 5.1894 0.0166 0.9933 YR2 1266.0820 1239.7667 5.4007 0.0143 0.9943 YNR2 1347.2803 1314.3759 5.1740 0.0303 0.9937 ZR1 1318.3147 1313.4214 5.5856 0.0112 0.9944 ZNR1 1544.8750 1515.2990 5.9857 0.0070 0.9944 ZR2 758.2692 708.8108 4.1124 0.0588 0.9967 ZNR2 1013.1720 995.5008 5.0457 0.0211 0.9956 2.6 栽培和野生七叶一枝花土壤细菌群落结构分析
在门和属水平,由于七叶一枝花土壤中的细菌群落结构不同,根据现有的OTU和群落丰度数据,运用统计学方法中的多重假设检验及假发现率分析来评估七叶一枝花2类(栽培和野生)土壤中微生物群落的丰富度差异(表6)。
表 6 门和属水平的微生物组间群落显著性的差异分析Table 6. Differential abundant microbes at phylum and genus levels分类水平
Classification level细菌名称
Bacterial name丰富度 Abundance P值
P value栽培 Transplanting 野生 Wild 门
Phylum厚壁菌门 Firmicutes 0.0047 ±0.0009b 0.0713 ±0.0066a 0.0001 硝化螺旋菌门 Nitrospirae 0.0071 ±0.0039a 0.0309 ±0.0052a 0.0107 绿弯菌门 Chloroflexi 0.0617 ±0.0045a 0.0446 ±0.0062a 0.0659 螺旋菌门 Spirochaetae 0.0002 ±0.0002b 0.0009 ±0.0001a 0.0133 属
Genus芽孢杆菌属 Bacillus 0.0015 ±0.0004b 0.0337 ±0.0022a 0.0000 Dyella 0.0022 ±0.0013a 0.0106 ±0.0038a 0.0797 类芽孢杆菌属 Paenibacillus 0.0015 ±0.0005b 0.0245 ±0.0049a 0.0033 Tumebacillus 0.0017 ±0.001b0.0101 ±0.0024a 0.0186 Shimazuella 0.0000 ±0.0000b 0.0028 ±0.0007a 0.0052 Mucilaginibacter 0.0016 ±0.0008a 0.0069 ±0.0023a 0.0689 Bryobacter 0.0195 ±0.0026a 0.0082 ±0.0008b 0.0064 硝化螺旋菌属 Nitrospira 0.0022 ±0.0013b 0.0068 ±0.001a0.0322 分枝杆菌属 Mycobacterium 0.0007 ±0.0001b 0.0013 ±0.0001a 0.0115 丰佑菌属 Opitutus 0.0030 ±0.0007a 0.0009 ±0.0002b 0.0315 中华单胞菌属 Sinomonas 0.0003 ±0.0002a 0.0000 ±0.0000a 0.0826 Dokdonella 0.0001 ±0.0001a 0.0004 ±0.0001a 0.0692 Candidatus_Entotheonella 0.0001 ±0.0001a 0.0005 ±0.0001a 0.0615 Bryocella 0.0006 ±0.0002a 0.0000 ±0.0000b 0.0400 Singulisphaera 0.0001 ±0.0000b 0.0002 ±0.0000a 0.0148 纤线杆菌属 Ktedonobacter 0.0003 ±0.0000a 0.0000 ±0.0000b 0.0015 在门水平,选取栽培和野生七叶一枝花2组土壤,比较两种栽培模式土壤细菌群落结构的差异(表6),具有显著差异(P<0.05)的是厚壁菌门(Firmicutes)、硝化螺旋菌门(Nitrospirae)和螺旋菌门(Spirochaetae),其中厚壁菌门(Firmicutes)具有极显著差异(P<0.001)。野生七叶一枝花土壤中厚壁菌门(Firmicutes)、硝化螺旋菌门(Nitrospirae)和螺旋菌门(Spirochaetae)高于栽培七叶一枝花土壤(P<0.05)。
在属水平,选取栽培和野生七叶一枝花2组土壤中含量top50的属,比较两种栽培方式土壤细菌群落结构的差异(表6),其中差异极其显著(P<0.001)是芽孢杆菌(Bacillus);差异极显著(P<0.01)是纤线杆菌属(Ktedonobacter)、类芽孢杆菌(Paenibacillus)、Shimazuella和Bryobacter;差异显著(P<0.05)是Tumebacillus、硝化螺菌属(Nitrospira)、分枝杆菌属(Mycobacterium)、丰佑菌属(Opitutus)、Bryocella和Singulisphaera;差异不显著(P>0.05)是Dyella、Mucilaginibacter、中华单胞菌属Sinomonas、Dokdonella和Candidatus_Entotheonella。
不同栽培模式的七叶一枝花土壤细菌中在不同水平均存在显著性差异,栽培模式中起重要作用的细菌依据LDA Effect Size(LEfSE)组间群落差异(图5)分析可得,野生七叶一枝花土壤中起到重要作用的门水平细菌类群是厚壁菌门(Firmicutes)和硝化螺旋菌门(Nitrospirae),属水平细菌类群是芽孢杆菌(Bacillus)、类芽孢杆菌(Paenibacillus)、Tumebacillus、Mucilaginibacter、硝化螺菌属(Nitrospira)、Shimazuella和Singulisphaera;栽培七叶一枝花土壤中起到重要作用的门水平细菌类群是装甲菌门(Armatimonadetes),属水平细菌类群是Bryobacter、致病特有菌属Aquicella[19]和纤线杆菌属(Ktedonobacter)。
2.7 栽培和野生七叶一枝花土壤细菌群落物种的Beta多样性分析
如图6所示,样本的Principal co-ordinates analysis(PCoA),基于栽培和野生七叶一枝花土壤OTU水平的PCoA结果显示,4份野生七叶一枝花的土壤(YR1、YNR1、YR2和YNR2)距离较近,物种群落组成相似,栽培5年七叶一枝花土壤(ZR1和ZNR1)与栽培2年七叶一枝花土壤(ZR2和ZNR2)的距离较为分散,物种群落组成差异相对较大。上述结果表明,野生群落与栽培5年和栽培2年七叶一枝花土壤微生物群落组成有较大的差异。
2.8 七叶一枝花不同栽培模式的热图分析
根据对不同分类水平的微生物多样性的分析,选取含量前50的细菌属,按照其在不同栽培模式样本中丰度比例结构建立热图,如图7所示。按照不同的栽培模式,七叶一枝花土壤样本可聚成3类:野生(YR1、YNR1、YR2和YNR2)、栽培5年(ZR1和ZNR1)和栽培2年(ZR2和ZNR2),说明野生七叶一枝花的根际和非根际土壤具有相似的微生物组成,不同栽培年限的七叶一枝花的土壤的微生物组成还有一定差别,各聚为1类。
2.9 七叶一枝花土壤微生物多样性与土壤理化性质的相关性
从表7可知,七叶一枝花土壤pH与土壤微生物coverage指数呈显著负相关(P<0.05),土壤pH与土壤全钾与Chao指数、Ace指数和Shannon指数呈正相关,而土壤全钾与Chao指数和Ace指数呈显著正相关(P<0.05)。说明土壤pH值和全钾含量影响七叶一枝花土壤细菌群落物种的丰富度。
表 7 七叶一枝花土壤微生物多样性与土壤理化性质的Pearson相关性分析Table 7. Pearson correlation between microbial diversity and physicochemical properties of P. polyphylla soil项目
ItemspH 有机质
Organic
matte全氮
Total
nitrogen全磷
Total
phosphorus全钾
Total
potassium细菌含量
Bacterial
contentChao指数
Chao
indexAce指数
Ace
indexShannon指数
Shannon
indexSimpson 指数
Simpson
index覆盖度
coveragepH 1 有机质 Organic matter 0.043 1 全氮 Total nitrogen 0.718 0.509 1 全磷 Total phosphorus −0.765 0.307 −0.110 1 全钾 Total potassium 0.969* 0.011 0.805 −0.618 1 细菌含量 Bacterial content 0.309 0.660 0.884 0.365 0.451 1 Chao指数 Chao index 0.946 −0.174 0.699 −0.664 0.983* 0.323 1 Ace指数 Ace index 0.950 −0.196 0.671 −0.696 0.978* 0.282 0.999** 1 Shannon 指数 Shannon index 0.912 −0.339 0.552 −0.742 0.934 0.145 0.982* 0.988* 1 Simpson 指数 Simpson index −0.832 0.519 −0.333 0.823 −0.824 0.100 −0.907 −0.923 −0.970* 1 覆盖度 Coverage −0.958* 0.242 −0.534 0.849 −0.928 −0.088 −0.959* −0.970* −0.976* 0.954* 1 *和**分别表示在0.05和0.01水平上相关性显著。
* and * * indicate significant correlation at 0.05 and 0.01 levels, respectively.3. 讨论
3.1 七叶一枝花不同栽培模式的土壤微生物群落组成
七叶一枝花最适宜生长的生态位参数是年温差小、降雨量少的平原或山区,最适生长温度20 ℃左右[20]。福建南平地属亚热带海洋性季风气候,一般气温在10~22 ℃,适宜七叶一枝花的生长。
土壤微生物的多样性通常是指土壤生态系统当中微生物的种类、基因及其与生态环境互作的微生态的变化[21]。其功能包括有机质的分解、物质的循环以及对生态安全的调控等3个方面[21]。土壤微生物与植物根系之间的相互作用和影响形成一个稳定的动态系统[22]。土壤微生物群落多样性与土壤上的植物群落生产力和多样性及其存在年限呈正相关关系[23−24],随着植物群落生产力和多样性的增加及其存在年限的延长,土壤的微生物群落多样性也相应提高[24]。曹小青等[23]研究发现,毛竹-白及复合林分的土壤微生物功能多样性随着套种年限的增加逐渐提高。徐筋燕等[25]对不同连作年限栝楼根际土壤微生物群落多样性研究中发现,随着连作时间的增加,栝楼连作土壤样本中的真菌丰度和多样性也有所提高。周浓等[26]对栽培滇重楼的根际土壤微生物分布研究发现,随着滇重楼种植年限的增加,真菌与解钾细菌数量呈逐年增加。本研究中,在七叶一枝花土壤中发现了21个细菌门,包括变形菌门、酸杆菌门、放线菌门、拟杆菌门和绿弯菌门等,其中野生七叶一枝花土壤中细菌的多样性高于移栽栽培七叶一枝花土壤,且栽培5年的七叶一枝花土壤中细菌的多样性高于栽培2年的七叶一枝花土壤,进而证明土壤微生物群落组成受到植物类型及群落存在年限的影响。张英英等[27]研究也发现枸杞根系微生物群落组成受种植年限的影响,与本试验研究结果一致。
土壤样本中细菌含量比较丰富的是变形菌门、酸杆菌门和绿弯菌门等。徐雷等[28]在茯苓不同种植模式下的栽培土壤中发现,其优势细菌类群是变形菌门和酸杆菌门;黎巷汝等[29]在对不同茶树品种的土壤细菌群落结构和多样性研究中发现,其细菌类群是变形菌门、酸杆菌门、绿弯菌门和放线菌门;甘国渝等[30]在对不同养分缺乏对冬油菜根际与非根际土壤细菌和真菌群落结构和多样性研究中发现的优势细菌菌群是变形菌门、酸杆菌门和绿弯菌门。冼康华等[14]研究发现,不同生长年限华重楼根际土壤中的优势细菌门为变形菌门、酸杆菌门、放线菌门和绿弯菌门。本研究中七叶一枝花土壤样本中含量最为丰富的是变形菌门,其次是放线菌门、酸杆菌门和拟杆菌门,结果表明,七叶一枝花土壤样本与一般土壤微生物群落结构基本一致。
3.2 栽培与野生七叶一枝花土壤微生物群落的组成
野生七叶一枝花与栽培七叶一枝花的土壤样本细菌门中具有显著性差异的是厚壁菌门(Firmicutes)、硝化螺旋菌门(Nitrospirae)和螺旋菌门(Spirochaetae)。野生七叶一枝花土壤样本中起到重要作用的门水平细菌类群是硝化螺旋菌门(Nitrospirae)和厚壁菌门(Firmicutes)。厚壁菌门(Firmicutes)是优良土壤的优势菌群[31];硝化螺旋菌门(Nitrospirae)对土壤中生物化学过程的硝化作用具有重要作用[32],其具有固氮作用[33],在抵御病害方面也起着重要作用[34]。
野生七叶一枝花与栽培七叶一枝花的土壤样本中细菌属具有显著性差异的是Bacillus、纤线杆菌属(Ktedonobacter)、类芽孢杆菌属(Paenibacillus)、Tumebacillus、Shimazuella、Bryobacter、分枝杆菌属(Mycobacterium)、Singulisphaera、硝化螺菌属(Nitrospira)、丰佑菌属(Opitutus)、Dokdonella和Bryocella。野生七叶一枝花土壤样本中起到重要作用的属水平细菌类群是芽孢杆菌(Bacillus)、类芽孢杆菌(Paenibacillus)、Tumebacillus、Mucilaginibacter、硝化螺菌属(Nitrospira)、Shimazuella和Singulisphaera。Bacillus是抗逆型生防菌[35];类芽孢杆菌(Paenibacillus)是根系促生微生物[36];Candidatus_Solibacter、Tumebacillus、Acidothermus是分解有机质、利用碳源的细菌属,与土壤有机质含量呈正相关关系[37];Mucilaginibacter是固氮菌[38];硝化螺菌属(Nitrospira)具有硝化作用;Dyella为自毒物质降解菌[39];Mycobacterium对不同浓度镉污染具有较强的适应能力[40];Dokdonella为自养反硝化菌属[41]。土壤中的氨氧化细菌和硝化菌数量的增多,可以加速有机氮的分解、铵态氮的硝化作用,从而将土壤中的有机氮转变成可被植物吸收的形态[42]。野生七叶一枝花比栽培七叶一枝花土壤样本中有益菌属种类多且含量较高。栽培七叶一枝花土壤中磷代谢相关的Gemmatimonas[43]、能降解纤维素的Ktedonobacter和促进土壤循环的Bryobacter[37]等有益菌属含量比野生七叶一枝花土壤高,但是,栽培七叶一枝花土壤中含有致病特有菌属Aquicella[19]等不利菌属。所以,野生七叶一枝花土壤具有更优的微生物组群落多样性。
3.3 栽培与野生七叶一枝花土壤微生物群落多样性与土壤理化性质的关系
土壤微生物群落与土壤养分之间密切相关。徐筋燕等[25]细菌群落组成和结构与pH值、氮含量和磷含量紧密相关。通过相关性分析,七叶一枝花土壤全钾含量与Chao指数和Ace指数呈显著正相关,土壤pH值与土壤微生物coverage指数呈显著负相关,土壤pH和土壤全钾两个指标与Chao指数、Ace指数和Shannon呈正相关,说明增加土壤中钾的含量会增加土壤微生物群落的丰富度。其中,野生七叶一枝花土壤有机质含量、全磷含量和全钾含量高于栽培土壤。因此,野生七叶一枝花的土壤微生物群落丰富度高。
4. 结论
通过对栽培和野生七叶一枝花土壤微生物群落组成及物种多样性和丰富度的对比分析发现,不同栽培模式生七叶一枝花土壤微生物群落组成及物种多样性和丰富度较丰富,共有21个细菌门和160多个细菌属,不同栽培模式土壤微生物群落组成及物种多样性和丰富度存在显著差异。其中,野生七叶一枝花比栽培七叶一枝花土壤中有益菌属种类多且含量较高,而栽培七叶一枝花土壤中还含有致病菌属Aquicella等不利菌属。土壤微生物群落与土壤养分有着密切相关性,土壤pH与土壤全钾是影响七叶一枝花土壤微生物群落多样性的重要因子。说明野生七叶一枝花的土壤更具有利且丰富的微生物群落。
-
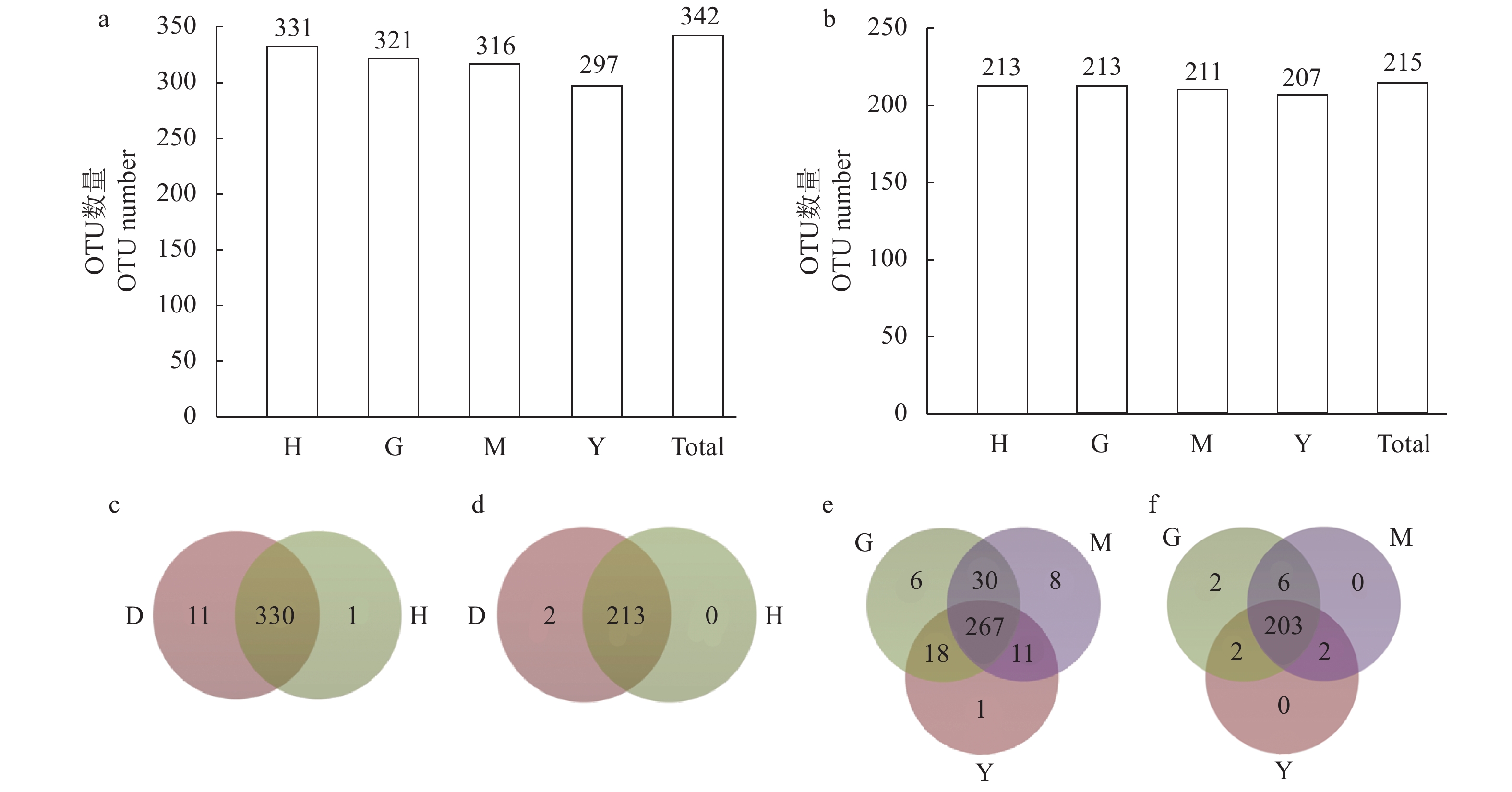
图 4 OTU数量与分类分布
注:①a: 内生细菌OTU个数分布图,b: 内生真菌OTU个数分布图,c: 健康组H与罹病组D的内生细菌OTU 韦恩图,d :健康组H与罹病组D的内生真菌OTU 韦恩图,e: 罹病组的细菌OTU韦恩图,f:罹病组的真菌OTU韦恩图。②D:罹病组叶片,包括G、M和Y。
Figure 4. OTU Distribution and Venn graphs
Note: ① a: OTU distribution of bacterial endophytes; b: OTU distribution of fungal endophytes; c: Venn graphs of bacterial endophytes between healthy (H) and diseased (D) plants; d: Venn graphs of fungal endophytes between H and D; e: Venn graphs of bacterium among D; f: Venn graphs of fungi among D. ②D: leaves on diseased plant including G, M and Y.
表 1 内生菌alpha多样性指数
Table 1 Alpha diversity index of endophytes
组别 Group 细菌 Bacterium 真菌 Fungi Shannon Simpson Shannon Simpson H 2.057 0.253 8 3.222 0.073 6 G 1.733 9 0.447 6 2.649 1 0.182 5 M 2.063 8 0.285 2 2.802 7 0.134 5 Y 2.345 8 0.212 4 2.818 6 0.124 8 注:H:健康组叶片,G:罹病组无症绿色叶片,M:罹病组斑驳黄化叶片,Y:罹病组均匀黄化叶片。
Note: H: healthy leaves; G: green leaves on diseased plant; M: yellow-mottled leaves on diseased plant; Y: yellow leaves on diseased plant.表 2 门水平下物种相对丰度大于0.1%门类
Table 2 Abundance of endophytes in samples at phylum level (abundance>0.1%)
门 Phylum H G M Y 细菌 Bacterium 变形菌门 Proteobacteria 94.48% 94.41% 93.97% 93.62% 放线菌门 Actinobacteria 2.79% 2.50% 1.69% 1.53% 厚壁菌门 Firmicutes 1.63% 1.58% 2.06% 3.18% 拟杆菌门 Bacteroidetes 0.55% 0.79% 2.01% 1.31% 真菌 Fungi 子囊菌门 Ascomycota 80.07% 96.34% 83.27% 91.34% 担子菌门 Basidiomycota 7.23% 2.00% 7.08% 5.66% -
[1] 刘利华, 姚锦爱, 种藏文, 等. 柑桔黄龙病亚洲种病原的PCR-SSCP分析 [J]. 福建农业学报, 2005, 20(2):77−79. DOI: 10.3969/j.issn.1008-0384.2005.02.004 LIU L H, YAO J A, CHONG Z W, et al. Analysis of Citrus Huanglongbing pathogens from different places by PCR-SSCP assay [J]. Fujian Journal of Agricultural Sciences, 2005, 20(2): 77−79.(in Chinese) DOI: 10.3969/j.issn.1008-0384.2005.02.004
[2] 范国成, 刘波, 吴如健, 等. 中国柑橘黄龙病研究30年 [J]. 福建农业学报, 2009, 24(2):183−190. DOI: 10.3969/j.issn.1008-0384.2009.02.019 FAN G C, LIU B, WU R J, et al. Thirty years of research on citrus Huanglongbing in China [J]. Fujian Journal of Agricultural Sciences, 2009, 24(2): 183−190.(in Chinese) DOI: 10.3969/j.issn.1008-0384.2009.02.019
[3] 宋晓兵, 彭埃天, 陈霞, 等. 柑橘黄龙病病原培养及分子检测技术研究进展 [J]. 广东农业科学, 2013, 40(23):65−69. DOI: 10.3969/j.issn.1004-874X.2013.23.017 SONG X B, PENG A T, CHEN X, et al. Research advances of Citrus Huanglongbing pathogen culture and detection technology [J]. Guangdong Agricultural Sciences, 2013, 40(23): 65−69.(in Chinese) DOI: 10.3969/j.issn.1004-874X.2013.23.017
[4] GARCIA-RUIZ F, SANKARAN S, MAJA J M, et al. Comparison of two aerial imaging platforms for identification of Huanglongbing-infected Citrus trees [J]. Computers and Electronics in Agriculture, 2013, 91: 106−115. DOI: 10.1016/j.compag.2012.12.002
[5] 郑雪芳, 刘波, 孙大光, 等. 柑橘黄龙病植株内生菌PLFAs多态性研究 [J]. 中国生态农业学报, 2012, 20(7):932−944. DOI: 10.3724/SP.J.1011.2012.00932 ZHENG X F, LIU B, SUN D G, et al. Plant endophyte PLFAs polymorphism in Huanglongbing-affected red pomelo plant [J]. Chinese Journal of Eco-Agriculture, 2012, 20(7): 932−944.(in Chinese) DOI: 10.3724/SP.J.1011.2012.00932
[6] BOVÉ J. Huanglongbing: A destructive, newly-emerging, century-old disease of citrus [J]. Journal of Plant Pathology, 2006, 88: 7−37.
[7] DUAN Y P, ZHOU L J, HALL D G, et al. Complete genome sequence of Citrus huanglongbing bacterium, ‘Candidatus Liberibacter asiaticus’ obtained through metagenomics [J]. Molecular Plant-Microbe Interactions, 2009, 22(8): 1011−1020. DOI: 10.1094/MPMI-22-8-1011
[8] LIN H, COLETTA-FILHO H D, HAN C S, et al. Draft genome sequence of “Candidatus Liberibacter americanus” bacterium associated with Citrus huanglongbing in Brazil [J]. Genome Announcements, 2013, 1(3): e00275.
[9] WULFF N A, EVEILLARD S, FOISSAC X, et al. rRNA operons and genome size of 'Candidatus Liberibacter americanus', a bacterium associated with Citrus huanglongbing in Brazil [J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(8): 1984−1991. DOI: 10.1099/ijs.0.008508-0
[10] ZHANG S J, FLORES-CRUZ Z, ZHOU L J, et al. 'Candidatus Liberibacter asiaticus' carries an excision plasmid prophage and a chromosomally integrated prophage that becomes lytic in plant infections [J]. Molecular Plant-Microbe Interactions, 2011, 24(4): 458−468. DOI: 10.1094/MPMI-11-10-0256
[11] ZHENG Z, DENG X, CHEN J. Draft genome sequence of “Candidatus Liberibacter asiaticus”from California [J]. Genome Announcements, 2014, 2(5): e00999−14.
[12] ZHENG Z, DENG X, CHEN J. A whole genome sequence of 'Candidatus Liberibacter asiaticus' from Guangdong, China, where HLB was first described [J]. American Phytopathological Society Abstracts, 2014, 104(S3): 137.
[13] KATOH H, MIYATA S I, INOUE H, et al. Unique features of a Japanese ‘Candidatus Liberibacter asiaticus’ strain revealed by whole genome sequencing [J]. PLoS One, 2014, 9(9): e106109. DOI: 10.1371/journal.pone.0106109
[14] DAVIS M J, MONDAL S N, CHEN H Q, et al. Co-cultivation of ‘Candidatus Liberibacter asiaticus’ with actinobacteria from Citrus with huanglongbing [J]. Plant Disease, 2008, 92(11): 1547−1550. DOI: 10.1094/PDIS-92-11-1547
[15] SECHLER A, SCHUENZEL E L, COOKE P, et al. Cultivation of ‘Candidatus Liberibacter asiaticus’, ‘Ca.L. Africanus’, and ‘Ca.L. Americanus’ associated with huanglongbing [J]. Phytopathology, 2009, 99(5): 480−486. DOI: 10.1094/PHYTO-99-5-0480
[16] 赵园园, 明佳佳, 胡承孝, 等. 柑橘黄龙病与树体养分关系的研究进展 [J]. 湖北农业科学, 2015, 54(9):2049−2053. ZHAO Y Y, MING J J, HU C X, et al. Research progress on the relationship between Citrus huanglongbing disease and plant nutrition [J]. Hubei Agricultural Sciences, 2015, 54(9): 2049−2053.(in Chinese)
[17] TRIVEDI P, HE Z L, VAN NOSTRAND J D, et al. Huanglongbing alters the structure and functional diversity of microbial communities associated with Citrus rhizosphere [J]. The ISME Journal, 2012, 6(2): 363−383. DOI: 10.1038/ismej.2011.100
[18] SAGARAM U S, DEANGELIS K M, TRIVEDI P, et al. Bacterial diversity analysis of huanglongbing pathogen-infected Citrus, using PhyloChip arrays and 16S rRNA gene clone library sequencing [J]. Applied and Environmental Microbiology, 2009, 75(6): 1566−1574. DOI: 10.1128/AEM.02404-08
[19] 车玉伶, 王慧, 胡洪营, 等. 微生物群落结构和多样性解析技术研究进展 [J]. 生态环境, 2005, 14(1):127−133. CHE Y L, WANG H, HU H Y, et al. Research progresses on analytical technologies used in microbial community structure and diversity [J]. Ecology and Environment, 2005, 14(1): 127−133.(in Chinese)
[20] 王爱华, 殷幼平, 熊红利, 等. 广西柑橘黄龙病植株韧皮部内生细菌多样性分析 [J]. 中国农业科学, 2010, 43(23):4823−4833. DOI: 10.3864/j.issn.0578-1752.2010.23.007 WANG A H, YIN Y P, XIONG H L, et al. Endophytic bacterial diversity analysis of huanglongbing pathogen-infected Citrus phloem tissue in Guangxi [J]. Scientia Agricultura Sinica, 2010, 43(23): 4823−4833.(in Chinese) DOI: 10.3864/j.issn.0578-1752.2010.23.007
[21] 李颜方, 殷幼平, 王玉玺, 等. 亚洲韧皮杆菌兼性厌氧型伴生细菌鉴定及优势菌群分析 [J]. 微生物学通报, 2011, 38(9):1362−1370. LI Y F, YIN Y P, WANG Y X, et al. Isolation of facultative anaerobic entophytic bacterial companioned Ca Las infected citrus tissues and evaluation of dominant bacterial populations [J]. Microbiology, 2011, 38(9): 1362−1370.(in Chinese)
[22] 王芳, 殷幼平, 孙丽琴, 等. 柑橘黄龙病罹病植株显症差异组织内生细菌群落结构分析 [J]. 微生物学报, 2014, 54(8):868−875. WANG F, YIN Y P, SUN L Q, et al. Endophytic bacterial community in the symptoms and symptomless tissues of HLB-affected Citrus plant [J]. Acta Microbiologica Sinica, 2014, 54(8): 868−875.(in Chinese)
[23] 李佳, 王中康, 谢攀, 等. 长春花内生细菌多样性与柑橘黄龙病菌的相关性 [J]. 微生物学报, 2012, 52(4):489−497. LI J, WANG Z K, XIE P, et al. Endophytic bacterial community analysis of Catharanthus roseus and its association with huanglongbing pathogen [J]. Acta Microbiologica Sinica, 2012, 52(4): 489−497.(in Chinese)
[24] 熊大维, 金丹凤, 顾斌涛, 等. 柑橘黄龙病赣南脐橙内生菌种群结构分析 [J]. 微生物学通报, 2017, 44(3):631−638. XIONG D W, JIN D F, GU B T, et al. Endophytic bacterial community in Gannan navel orange affected by huanglongbing [J]. Microbiology, 2017, 44(3): 631−638.(in Chinese)
[25] AMANN R I, LUDWIG W, SCHLEIFER K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation [J]. Microbiological Reviews, 1995, 59(1): 143−169. DOI: 10.1128/MMBR.59.1.143-169.1995
[26] 王绍祥, 杨洲祥, 孙真, 等. 高通量测序技术在水环境微生物群落多样性中的应用 [J]. 化学通报, 2014, 77(3):196−203. WANG S X, YANG Z X, SUN Z, et al. Application of High Throughput Sequencing in the Diversity of Water Microbial Communities [J]. Chemistry, 2014, 77(3): 196−203.(in Chinese)
[27] 马同锁, 田苗珍, 袁红楼, 等. 不同生长环境对2种蔬菜内生菌分布的影响 [J]. 安徽农业科学, 2009, 37(17):7812−7813, 7815. DOI: 10.3969/j.issn.0517-6611.2009.17.002 MA T S, TIAN M Z, YUAN H L, et al. Effect of the different growth environmental conditions on the distribution of endophytes in two species of vegetables [J]. Journal of Anhui Agricultural Sciences, 2009, 37(17): 7812−7813, 7815.(in Chinese) DOI: 10.3969/j.issn.0517-6611.2009.17.002
[28] GAGNÉ S, RICHARD C, ROUSSEAU H, et al. Xylem-residing bacteria in alfalfa roots [J]. Canadian Journal of Microbiology, 1987, 33(11): 996−1000. DOI: 10.1139/m87-175
[29] EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads [J]. Nature Methods, 2013, 10(10): 996−998. DOI: 10.1038/nmeth.2604
[30] SAKAKI T, TAKESHIMA T, TOMINAGA M, et al. Recurrence of ICA-PCoA aneurysms after neck clipping [J]. Journal of Neurosurgery, 1994, 80(1): 58−63. DOI: 10.3171/jns.1994.80.1.0058
[31] 陈燕玲, 唐瑞, 刘洋, 等. 黄龙病菌在柑橘枝条上的分布和多样性分析 [J]. 植物病理学报, 2018, 48(6):728−737. CHEN Y L, TANG R, LIU Y, et al. Distribution and genetic diversity of "Candidatus Liberibacter asiaticus" in citrus canopy shoots [J]. Acta Phytopathologica Sinica, 2018, 48(6): 728−737.(in Chinese)




 下载:
下载: