Conditions for Germination of Mycogone perniciosa Chlamydospores
-
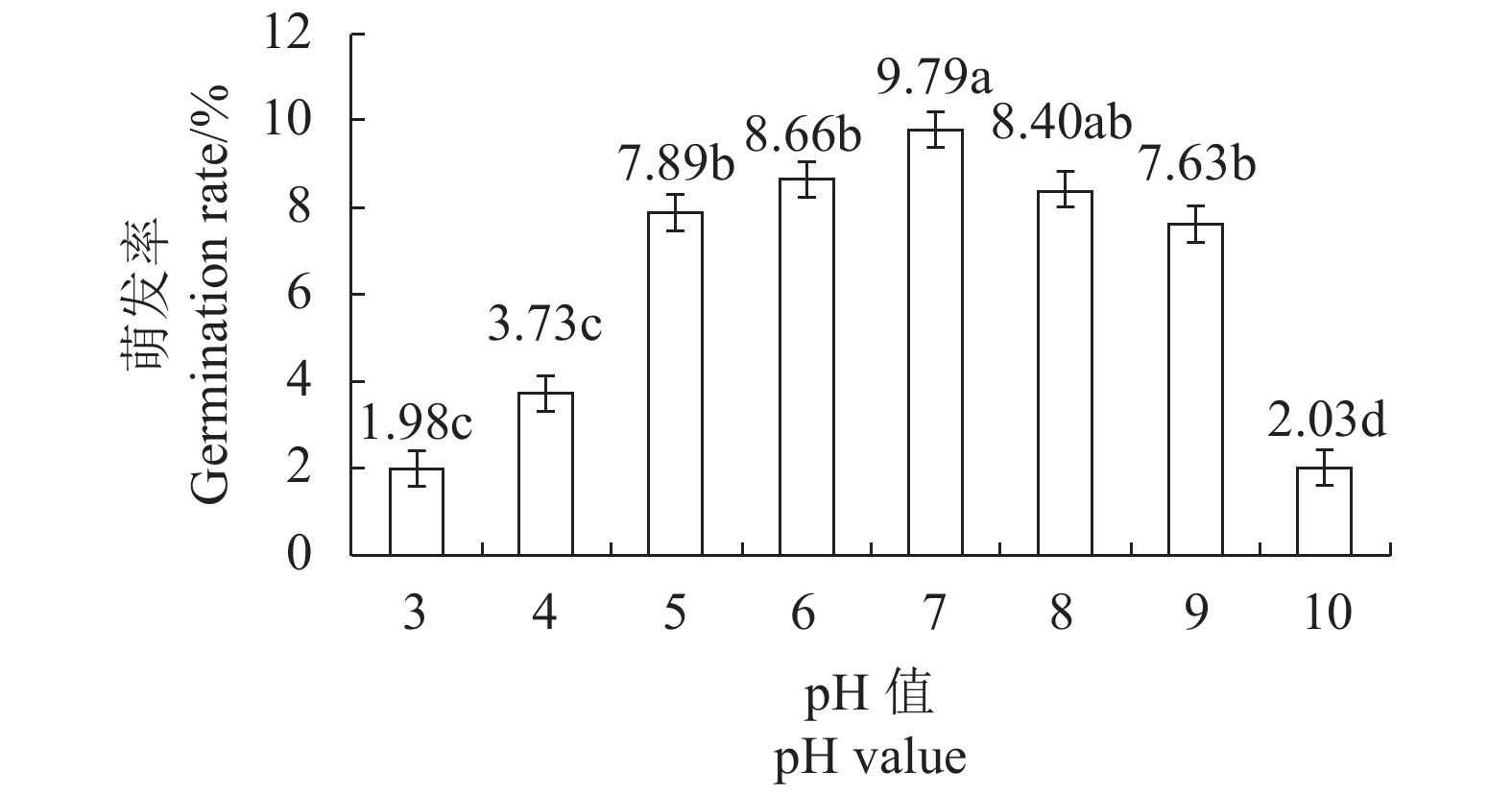
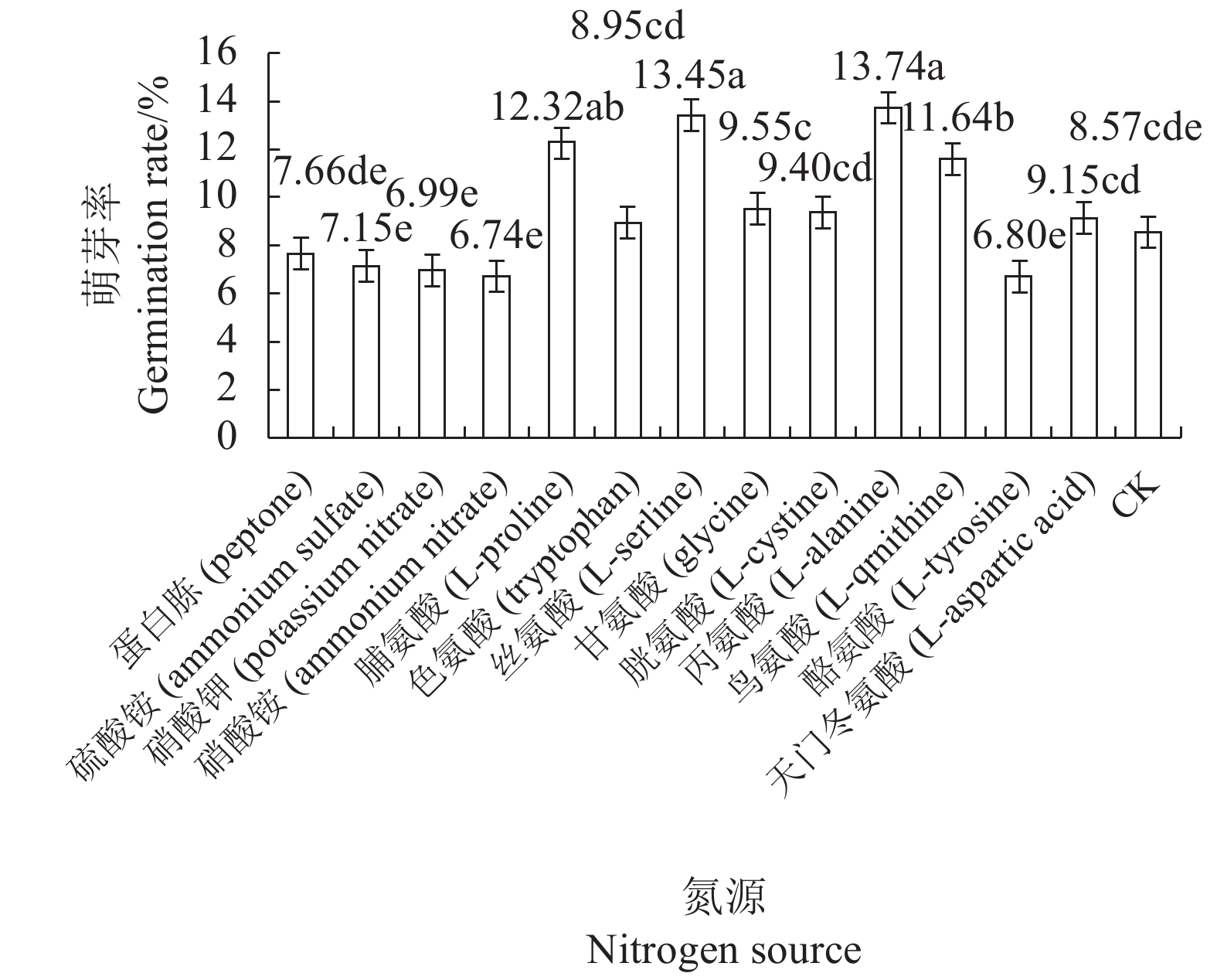
摘要:目的 研究影响有害疣孢霉厚垣孢子萌发的因素,为进一步开展有害疣孢霉生物学特性研究以及筛选可有效抑制其萌发的杀菌剂提供依据。方法 在−80℃、−20℃、0℃、4℃、10℃、15℃、20℃和25℃处理有害疣孢霉厚垣孢子,然后25℃培养,测定温度对破除有害疣孢霉厚垣孢子休眠的影响;测定不同培养基、pH值、碳源和氮源对有害疣孢霉厚垣孢子萌发的影响。结果 0℃、4℃处理12 h、24 h和48 h可破除有害疣孢霉厚垣孢子休眠,促进萌发;适合有害疣孢霉厚垣孢子萌发的pH值为6、7和8,其萌发率分别为8.66%、9.79%和8.40%;有害疣孢霉厚垣孢子在水琼脂培养基(WA)、双孢蘑菇浸出液培养基(MuEA)、双孢蘑菇煎汁培养基(MuDA)、马铃薯葡萄糖培养基(PDA)和V8培养基上的萌发率分别为0.00%、6.38%、8.43%、1.33%和6.23%,在MuDA培养基上萌发率最好,显著优于其他供试培养基;葡萄糖、蔗糖和山梨糖有利于有害疣孢霉厚垣孢子萌发,其萌发率分别为10.77%、9.96%和9.85%;在MuDA培养基中加入脯氨酸、丝氨酸、丙氨酸和鸟氨酸后有害疣孢霉厚垣孢子的萌发率分别为12.32%、13.45%、13.74%和11.64%,显著优于不加氮源的萌发率。结论 0℃、4℃处理12 h以上可破除有害疣孢霉厚垣孢子的休眠;适合有害疣孢霉厚垣孢子萌发的pH值为6、7和8;MuDA培养基是适宜有害疣孢霉厚垣孢子萌发的培养基;葡萄糖、蔗糖、D-乳糖、山梨糖和D-棉子糖是适宜有害疣孢霉厚垣孢子萌发的碳源;脯氨酸、丝氨酸、丙氨酸和鸟氨酸是适宜有害疣孢霉厚垣孢子萌发的氮源。Abstract:Objective To identify conditions that facilitate germination of Mycogone perniciosa chlamydospores for further research on effective control of the fungal disease on edible mushrooms.Method Chlamydospores were kept at −80℃, −20℃, 0℃, 4℃, 10℃, 15℃, 20℃ or 25℃ for various durations prior to culture on media at 25℃ to determine the effects of dormancy-breaking temperatures. And effects of varied pHs, culture conditions, carbon source and nitrogen source on the chlamydospores germination were detected.Result Dormancy of the chlamydospores was broken and germination promoted under 0℃ or 4℃ for 12 h, 24 h or 48 h. pH 6, 7 and 8 were conducive to the spore germination at the rates of 8.66%, 9.79%, and 8.40%, respectively. The germination rate varied according to the medium the spores grew on. It was 0.00% on WA, 6.38% on MuEA, 8.43% on MuDA, 1.33% on PDA, and 6.23% on V8. Thus, MuDA appeared significantly better than other media tested in this study. The chlamydospores showed a germination rate of 10.77% with glucose, 9.96% with sucrose or 9.85% with sorbose in the medium, indicating a significantly advantage of the presence of a carbon source. In so far as nitrogen is concerned, the addition of proline in MuDA delivered a 12.32% germination rate, serine 13.45%, alanine 13.74%, and ornithine 11.64%, which were significantly improved over control without the addition.Conclusion By keeping M. perniciosa chlamydospores at 0℃ or 4℃ for more than 12 h could break the spore dormancy. On MuDA of pH 6, 7 or 8, the chlamydospores germinated well. With the presences of glucose, sucrose, D-lactose, sorbic sugar or D-raffinose as carbon source and L-proline, L-serline, L-alanine or L-qrnithine as nitrogen source, the spore germination was further enhanced.
-
Keywords:
- Mycogone perniciosa /
- chlamydospore /
- germination /
- Agaricus bisporus
-
0. 引言
【研究意义】兔出血症2型(rabbit hemorrhagic disease type 2, RHD-2)是由兔出血症病毒2型(rabbit hemorrhagic disease virus serum type 2, RHdV-2)引起的一种新型高度接触传染性、急性致死性传染病。新型毒株的RHdV-2的感染性更强,感染范围更广,不同日龄和品种的家兔、野兔均可被感染[1−3]。RHD-2具有较高发病率和致死率[4],且国内尚未研制出可靠的商品化疫苗供生产使用,一旦发病将严重影响养兔业的健康发展。当前,我国养兔规模化程度仍然十分低,散养户是养兔业的主力。散养户普遍存在技术力量弱、不会操作检测仪器等问题。RHdV-2感染已对我国养兔业造成了巨大经济损失,如何在养殖场特别是散养户进行快速准确的诊断对于科学防控该病具有十分重要的意义。通过建立快速且准确的检测方法,可以有效识别并控制传染源,从而防止疫情的进一步扩散。【前人研究进展】目前,重组酶介导的核酸等温扩增(recombinase aided amplification, RAA)与CRISPR/Cas13a技术联用在病原检测领域已逐渐展现出其巨大的应用潜力。该方法先对目标序列进行RAA扩增以获得大量的检测模板,再利用CRISPR系统对其进行特异性识别以激活Cas13a蛋白来剪切反应体系中的荧光探针,从而实现对低载量样品的快速准确检测[5]。作为病原检测研究领域的一个热门方向,RAA-CRISPR/Cas13a检测方法通过结合RAA法和CRISPR/Cas13a技术,在灵敏度和特异性方面实现了显著提升。一些学者已经利用这种方法开发出了快速检测动物疫病病原微生物的新方法,如禽腺病毒血清 4 型[6]、猪流行性腹泻冠状病毒[7]和禽流感病毒[8]。虽然国内已经建立多种针对RHdV-2的诊断技术,但是均需要一定的专业知识和仪器设备,难以在养殖场一线应用。有研究根据RHdV-2的保守序列VP60,建立了实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction, qPCR)检测方法[9],酶联免疫吸附技术(enzyme Linked Immunosorbent assay, ELISA)也可用于检测RHdV-2抗原或抗体[10],这些方法虽然灵敏度和特异性较好,但它们均需较为昂贵的配备仪器和过长的反应时间。【本研究切入点】本实验室前期建立了基于RAA的侧流层析试纸(lateral flow device, LFD)方法[11],用于RHdV-2的特异性检测,然而RAA的扩增效率易受引物设计、模板序列及其他因素的影响,限制了其检测灵敏度和稳定性。近年来,CRISPR-Cas核酸酶的精准切割特性为核酸检测提供了新的技术突破。多项研究[12−13]通过联合RAA与CRISPR-Cas系统,显著提升了检测的灵敏度和特异性,并结合LFD实现了检测结果的可视化。基于此,本研究创新性地整合了RAA与CRISPR/Cas13a技术,首次建立了一种RHdV-2可视化诊断方法RAA-CRISPR/Cas13a(cpf1)-LFD。【拟解决的关键问题】本研究在本实验室前期研究的重组酶等温扩增结合侧流层析试纸条方法[11]的基础上,结合CRISPR/Cas13a技术,建立了新的RHdV-2检测方法,这种方法具备高度的灵敏度和特异性,操作简单,可实现在实验室和基层养殖场现场的快速检测,同时利用LFD实现结果可视化,为RHdV-2的诊断提供高效准确的检测方法。
1. 材料与方法
1.1 试验材料
1.1.1 重组质粒与临床样本
RHdV-2(KU991797.1)VP60重组质粒、RHdV-1(DQ205345.1)VP60重组质粒均由擎科股份有限公司进行合成。31份临床样本由本实验室保存,来自闽侯、武平、大田、连江等多个兔场,病兔主要表现急性死亡,实质器官有出血,采集脾脏淋巴结等实质器官备用。
1.1.2 主要试验试剂
总RNA提取试剂盒(ER501-01)(北京全式金生物有限公司);RAA核酸扩增试剂盒(T00R01)(江苏奇天基因生物科技有限公司);一次性核酸检测试纸条(JY0301,北京宝盈同汇生物技术有限公司);磷酸盐缓冲液(兰杰柯科技有限公司);LwaCas13a蛋白(C2C2)(广州美格生物有限公司);HiScribeT7快速高效 RNA 合成试剂盒(New England Biolabs);重组RNase抑制剂(荷瑞生物);RNA纯化试剂盒(DP412,天根生物有限公司);LwaCas13a 10×reaction buffer:200 mmol·L−1 HEPES-NaOH(pH6.8),600 mmol·L−1 NaCl,60 mmol·L−1 MgCl2,10 mmol·L−1 DTT。
1.2 试验方法
1.2.1 RAA引物、crRNA设计与合成
RAA特异性引物和RAA-LFD探针按照文献[11]报道的序列合成。在已扩增的特异且保守序列范围内,首先识别符合条件的PAM序列,继而设计长度为20~23 nt的间隔区序列构成LwaCas13a-crRNA,间隔区序列位于PAM序列之后,同时确保LwaCas13a-crRNA目标序列内3'端的PFS序列由A、C、U组成,且目标序列不与RAA引物重叠,最终,将间隔区序列进行Blast分析比对确定其保守特异性。crRNA的单链DNA(即ssDNA)由擎科股份有限公司进行合成。
Lwacas13a-crRNA合成步骤:将crRNA的单链DNA作为模板与相应引物通过PCR扩增获得大量crRNA的双链DNA(即dsDNA),使用琼脂凝胶回收试剂盒回收目的条带进行纯化,纯化产物通过T7 HiScribe T7高效RNA合成试剂盒37 ℃过夜转录,转录产物使用RNA纯化试剂盒纯化后通过nanodrop 2000测定RNA浓度置于−80 ℃保存。CRISPR-Cas13a相关序列见表1。
表 1 CRISPR-Cas13a crRNA及相关引物Table 1. CRISPR-Cas13a crRNA and related primers基因
Genes序列5′-3′
Sequences (5′-3′)Cas13a crRNA1 TAATACGACTCACTATAGGGGATTTAGACTACCCCAAAAACGAAGGGGACTAAAACACTCATAAGCCTGCATGGTCGTGACGTA Cas13a crRNA2 TAATACGACTCACTATAGGGGATTTAGACTACCCCAAAAACGAAGGGGACTAAAACGGTGGTGGTGGGTTGGGGGTTGCTCGGT 斜体为T7启动子序列,下划线碱基为重复序列区。
Italicized sequence: T7 promoter; underlined bases: repetitive sequence region.PCR 25 μL反应体系:2×San Taq PCR Master Mix (含蓝色染料)12.5 μL,crRNA-dsDNA 1 μL,上下游引物各1 μL(10 μmol·L−1),ddH2O 9.5 μL。PCR反应过程:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸15 s,30个循环;72 ℃延伸10 min。
转录体系:T7 mix 2 μL,NTP mix 10 μL,模板1 μg,ddH2O补齐至20 μL。
1.2.2 RAA-LFD反应体系
根据RAA核酸扩增试剂盒说明书,选择50 μL体系进行扩增。反应体系为:缓冲液25 μL,纯水15.7 μL,正向与反向引物各取2.1 μL,探针取0.6 μL,乙酸镁(280 mmol·L−1)2.5 μL,模板3 μL。
1.2.3 Cas13a试纸条法反应条件的确立
(1) RAA-CRISPR/Cas13a (Cpf1)-LFD体系优化。1.5 μL crRNA(300 ng·μL−1)与50 nmol·L−1 Cas13a蛋白进行反应,选择反应效果最佳体系为CRISPR-Cas13a反应体系。该体系的总体积为50 µL,包括以下成分:10×反应缓冲液5 µL,crRNA(浓度为300 ng·µL−1)1.5 µL,探针(浓度为10 μmol·L−1)2 µL,模板2.5 µL,LwaCAS13a蛋白(浓度为1 μmol·L−1)3.5 µL,NTP混合物2.5 µL,RNA酶(浓度为300 U·µL−1)5 µL,T7混合物0.5 µL,以及双蒸水27.5 µL。
(2)RAA-CRISPR/Cas13a-LFD反应时间优化。基于上述Cas13a体系对RAA-CRISPR/Cas13a-LFD反应时间进行优化,每5 min一个间隔,设置反应时间为10~25 min,Cas13a试纸条法观察结果。
1.2.4 RAA-CRISPR/Cas13a (Cpf1)-LFD试纸条法检测敏感性的评价
RHdV-2 VP60重组质粒经检测其质粒浓度为6.7×103 copies·μL−1,用1×PBS梯度稀释得到6.7×103、6.7×102、6.7×101、6.7×10−1、6.7×10−2 copies·μL−1 5个浓度梯度,以不同浓度的重组质粒为模板进行扩增,扩增产物与Cas13a蛋白以及crRNA等试剂再进行一定时间恒温反应,反应产物经LFD显示,分析敏感性试验结果。
1.2.5 RAA-CRISPR/Cas13a (Cpf1)-LFD检测RHdV-2特异性评价
RHdV-2 VP60重组质粒(6.7×105 ng·μL−1)、RHdV-1 VP60重组质粒(6.7×105 ng·μL−1)为模板进行RAA扩增,产物与Cas13a蛋白以及crRNA再进行一定时间恒温反应,反应产物经LFD显示。
1.2.6 RNA的提取
根据总RNA提取试剂盒说明进行操作提取,具体步骤:将单份临床兔病料75 mg与1 mL Trans Zol混合并研磨裂解样品,后加入200 μL RNA Extraction Agent,振荡混匀5 min后放于4 ℃高速离心机10 000 r·min−1离心15 min;吸取无色水相部分与同体积无水乙醇混合后加入离心柱后离心;重复加入CB9(500 μL)并离心;重复加入WB9(500 μL)并离心;离心去除剩余乙醇,使用75 μL纯水洗脱后,将提取的RNA保存于−80 ℃保存。
1.2.7 临床样品的检测
提取31份临床样本病料的总RNA,应用建立的RAA-CRISPR/Cas13a(Cpf1)-LFD 法分别对31份临床样品进行RAA扩增反应,扩增产物经LFD显示结果。
2. 结果与分析
2.1 Cas13-crRNA筛选结果
分别以crRNA1和crRNA2为探针对同一阳性样本进行检测,结果如图1a和图1b所示,crRNA1显示出更明显的检测线(T线),并且Image J定量分析(图1c)可见crRNA1与crRNA2之间的信号强度差异显著(P<0.05),说明crRNA1具有更高的信号强度。因此后续选择crRNA1进行试验。
![]() 图 1 Cas13a-crRNA筛选结果(a)试纸条;(b)Image J定量图;(c)样品条带定量柱状图。1:crRNA 1;2:crRNA 2;N:阴性对照。C:质控线;T:检测线;* 表示与对照相比差异显著 P<0.05。Figure 1. Cas13-crRNA screening results(a) test strip; (b) J quantification graph; (c) bar chart of quantified sample bands; 1: crRNA1; 2: crRNA2; N: negative control. C: quality control line; T: test line; *: statistically significantly different from control (P<0.05).
图 1 Cas13a-crRNA筛选结果(a)试纸条;(b)Image J定量图;(c)样品条带定量柱状图。1:crRNA 1;2:crRNA 2;N:阴性对照。C:质控线;T:检测线;* 表示与对照相比差异显著 P<0.05。Figure 1. Cas13-crRNA screening results(a) test strip; (b) J quantification graph; (c) bar chart of quantified sample bands; 1: crRNA1; 2: crRNA2; N: negative control. C: quality control line; T: test line; *: statistically significantly different from control (P<0.05).2.2 RAA-CRISPR/Cas13a (Cpf1)-LFD反应时间优化
从图2中可以看出,在RAA基础反应30 min后,仅再需10 min,RAA-CRISPR/Cas13a(Cpf1)-LFD即可检测出RHdV-2,且显色明显。从量化柱状图可知,反应时间为10 min时,数值最高(P<0.05)。综合分析可知10 min时即可达到较佳检测效果,故后续反应时间均釆用10 min。
![]() 图 2 不同反应时间RAA-CRISPR/Cas13a(Cpf1)-LFD扩增产物(a)试纸条图;(b)Image J定量图;(c)样品条带定量柱状图。10、15、20、25分别为 10、15、20、25 min 扩增产物; N阴性对。C:质控线;T:检测线;*表示与对照相比差异显著(P<0.05)。Figure 2. RAA-CRISPR/Cas13a (Cpf1)-LFD amplification products by varied reaction time(a) test strip; (b) J quantification graph; (c) bar chart of quantified sample bands; 10, 15, 20, and 25: amplification products for 10, 15, 20, and 25m with standard plasmid as template; N: negative control. C: quality control line; T: test line; *: significantly different from control (P<0.05).
图 2 不同反应时间RAA-CRISPR/Cas13a(Cpf1)-LFD扩增产物(a)试纸条图;(b)Image J定量图;(c)样品条带定量柱状图。10、15、20、25分别为 10、15、20、25 min 扩增产物; N阴性对。C:质控线;T:检测线;*表示与对照相比差异显著(P<0.05)。Figure 2. RAA-CRISPR/Cas13a (Cpf1)-LFD amplification products by varied reaction time(a) test strip; (b) J quantification graph; (c) bar chart of quantified sample bands; 10, 15, 20, and 25: amplification products for 10, 15, 20, and 25m with standard plasmid as template; N: negative control. C: quality control line; T: test line; *: significantly different from control (P<0.05).2.3 RAA-CRISPR/Cas13a (Cpf1)-LFD敏感性
Cas13a试纸条法对RHdV-2 RNA最低可检值可达6.7×101 copies·μL−1,结合量化结果(图3)综合分析在质粒浓度为6.7×101 ng·μL−1时条带明显且数值最高(P<0.05),阴性对照结果为阴性。
![]() 图 3 Cas13a敏感性试验结果(a)试纸条图;(b)Image J定量图;(c)样品条带定量柱状图。1:6.7×103 copies·μL−1;2:6.7×102 copies·μL−1;3:6.7×101 copies·μL−1;4:6.7×10−1 copies·μL−1;5:6.7×10−2 copies·μL−1;N:阴性;* 表示与对照相比差异显著(P<0.05)。Figure 3. Assay sensitivity of Cas13a(a) test strip; (b) J quantification graph; (c) bar chart of quantified sample bands; 1: 6.7×103 copies·μL−1; 2: 6.7×102 copies·μL−1; 3: 6.7×101 copies·μL−1; 4: 6.7×10−1 copies·μL−1; 5: 6.7×10−2 copies·μL−1; N: negative control; *: significantly different from control (P<0.05).
图 3 Cas13a敏感性试验结果(a)试纸条图;(b)Image J定量图;(c)样品条带定量柱状图。1:6.7×103 copies·μL−1;2:6.7×102 copies·μL−1;3:6.7×101 copies·μL−1;4:6.7×10−1 copies·μL−1;5:6.7×10−2 copies·μL−1;N:阴性;* 表示与对照相比差异显著(P<0.05)。Figure 3. Assay sensitivity of Cas13a(a) test strip; (b) J quantification graph; (c) bar chart of quantified sample bands; 1: 6.7×103 copies·μL−1; 2: 6.7×102 copies·μL−1; 3: 6.7×101 copies·μL−1; 4: 6.7×10−1 copies·μL−1; 5: 6.7×10−2 copies·μL−1; N: negative control; *: significantly different from control (P<0.05).2.4 RAA-CRISPR/Cas13a (Cpf1)-LFD特异性
如图4可知,RHdV-1结果为阴性,RHdV-2在试纸条检测中呈现强阳性,因此所建立的方法特异性优异。
![]() 图 4 Cas13特异性检测结果(a)试纸条图;(b)Image J定量图; (c)样品条带定量柱状图。1:RHdV-2;2:RHdV-1;N:阴性对照;*表示与对照相比差异显著(P<0.05)。Figure 4. Assay specificity of Cas13a(a) test strip; (b) J quantification graph; (c) bar chart of quantified sample bands; 1: RHdV-2; 2: RHdV-1; N: negative control; *: significantly different from control (P<0.05).
图 4 Cas13特异性检测结果(a)试纸条图;(b)Image J定量图; (c)样品条带定量柱状图。1:RHdV-2;2:RHdV-1;N:阴性对照;*表示与对照相比差异显著(P<0.05)。Figure 4. Assay specificity of Cas13a(a) test strip; (b) J quantification graph; (c) bar chart of quantified sample bands; 1: RHdV-2; 2: RHdV-1; N: negative control; *: significantly different from control (P<0.05).2.5 RAA-CRISPR/Cas13a (Cpf1)-LFD法临床样品检测
对31份不同兔场收集的病死兔脾脏组织进行RAA-CRISPR/Cas13a (Cpf1)-LFD试纸条检测。如图5可知,所有样品在C位置均有条带,表明所有样品均合格。其中,样品4、10、13、15、18、19、22、24、27、29在T位置呈现较为明显条带。Image J定量分析(图5C)表明,样品4、10、13、15、18、19、22、24、27、29的条带强度与对照相比差异显著(P<0.05),表明其为阳性样品,RAA-CRISPR/Cas13a (Cpf1)-LFD法的阳性检出率为30.3%。
![]() 图 5 RAA-CRISPR/Cas13a (Cpf1)-LFD临床样品检测结果(a)试纸条图;(b)Image J定量图;(c)样品条带定量柱状图。1~31分别为样品编号; N为阴性对照;*表示与对照相比差异显著(P<0.05)。Figure 5. Detection by RAA-CRISPR/Cas13a (Cpf1)-LFD assay on clinical specimens(a) test strip; (b) J quantification graph; (c) bar chart of quantified sample bands; 1–31: sample numbers; N: negative control; *: significantly different from control (P<0.05).
图 5 RAA-CRISPR/Cas13a (Cpf1)-LFD临床样品检测结果(a)试纸条图;(b)Image J定量图;(c)样品条带定量柱状图。1~31分别为样品编号; N为阴性对照;*表示与对照相比差异显著(P<0.05)。Figure 5. Detection by RAA-CRISPR/Cas13a (Cpf1)-LFD assay on clinical specimens(a) test strip; (b) J quantification graph; (c) bar chart of quantified sample bands; 1–31: sample numbers; N: negative control; *: significantly different from control (P<0.05).3. 讨论与结论
自2010年在法国首次发现RHdV-2以来[4],该病毒已在全球范围内流行。2020年,中国四川省首次报告了RHD2病例[14]。RHdV-2对养兔业构成严重威胁,但目前缺乏有效的商业疫苗。因此,开发可靠的病原学检测技术对于控制RHdV-2传播、减轻其对养兔业和生态系统的影响至关重要。
王波[15]在其研究中建立的检测RHdV-2的SYBR Green Ⅰ实时荧光定量RT-PCR方法检测限度达到68个拷贝数,而本研究构建的RHdV-2核酸试纸条检测方法对兔出血症病毒RNA的最低检测限为6.7×101 copies·μL−1,说明本研究建立的方法灵敏度与实时荧光定量RT-PCR方法相当。同时,应用该方法进行检测,结果显示RHdV-1结果为阴性,RHdV-2则呈现强阳性,说明该方法特异性良好,与RHdV-1血清型核酸无交叉反应。本研究使用新建立的RAA-CRISPR/Cas13a (Cpf1)-LFD方法对本实验室前期研究中保存的31份疑似阳性临床样品进行检测后,阳性率从19.2%[11]提高到了30.3%,说明新方法在检测RHdV-2方面具有更高的有效性和准确性。近年来,关于RHdV-2检测方法的研究主要集中在RT-PCR技术上。尽管部分研究[16−17]开发的检测方法能够达到1×101 copies·μL−1的高灵敏度,但这些方法通常需要较长的反应时间,并且依赖于专业设备进行结果判读,这限制了它们在临床快速检测RHDV-2中的应用。相比之下,本研究建立的检测方法在40 min内即可完成,并且通过试纸条直接显示结果,使得结果判读变得快速且直观。但本研究建立的方法也存在不足之处,反应过程中需要开盖转移RAA反应产物作为体系中的模板,易产生气溶胶污染。目前已有RAA-CAS一管反应法,将RAA反应试剂与Cas相关试剂一次性加入一个管内,反应时间相应缩短,减少气溶胶污染。然而,一管法检测灵敏性较低,这可能是因为RAA中反应蛋白酶接触Cas相关试剂影响了蛋白酶的活性。后期是否可以通过优化体系内试剂浓度进行一管反应还需进一步研究。
本研究前期通过RHdV两种血清型基因组对比,发现RHdV-2的VP60基因最为保守,将其设定为检测靶序列,合成特异性引物,建立了RAA-CRISPR/Cas13a(cpf1)-LFD检测方法。该方法具有敏感性强、特异性高、操作简易等优点,可实现对RHdV-2快速检测,可为RHdV-2的预防与早期诊断、控制提供便捷技术,规避兔养殖业巨大疫病风险,助力养兔业蓬勃发展。
-
表 1 温度对有害疣孢霉厚垣孢子萌发率的影响
Table 1 Effect of temperature on germination rate of M. perniciosa chlamydospores
(单位: %) 温度
Temperature萌发率 Germination rate 萌发率 Germination rate 萌发率 Germination rate 12 h/12 h 12 h/24 h 12 h/48 h 24 h/12 h 24 h/24 h 24 h/48 h 48 h/12 h 48 h/24 h 48 h/48 h −80 ℃/25 ℃ 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k −20 ℃/25 ℃ 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0 ℃/25 ℃ 0.00 k 2.75 gh 6.40 de 0.00 k 4.70 f 7.36 c 0.00 k 5.76 e 7.44 c 4 ℃/25 ℃ 0.71 jk 2.68 gh 6.77 cd 1.45 ij 8.40 b 9.23 a 1.40 ij 9.79 a 9.62 a 10 ℃/25 ℃ 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 15 ℃/25 ℃ 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 0.00 k 20 ℃/25 ℃ 0.00 k 0.00 k 0.72 jk 0.00 k 0.66 jk 0.95 jk 0.96 j 1.24 ij 1.43 ij 25 ℃/25 ℃ 0.00 k 0.00 k 1.38 ij 0.00 k 1.25 ij 2.36 h 1.53 ij 1.98 hi 3.25 g 注:数据后不同小写字母分别表示在5%水平上差异显著。
Note: Data with lowercase letters indicate significant difference at P<0.05. -
[1] TU C C, LIAO Y M. Major diseases of cultivated mushroom and their control in Taiwan [J]. Mushroom Science, 1989, 12: 615−626.
[2] FORER L B, WUEST P J, WAGNER V R. Occurrence and economic impact of fungal diseases of mushrooms in Pennsylvania [J]. The Plant Disease Reporter, 1974, 58: 987−991.
[3] 吴菊芳, 支月娥, 康素珍, 等. 蘑菇褐腐病菌生物学特性和防治 [J]. 植物保护学报, 1996, 23(3):235−240. DOI: 10.3321/j.issn:0577-7518.1996.03.009 WU J F, ZHI Y E, KANG S Z., et al Study on the biological characters and the control of Mycogone perniciosa Magn. [J]. Journal of plant protection, 1996, 23(3): 235−240.(in Chinese) DOI: 10.3321/j.issn:0577-7518.1996.03.009
[4] 周春元. 双孢蘑菇湿泡病病原学及其致病机理研究[D]. 长春: 吉林农业大学, 2014. ZHOU C Y. The Etiology and pathogenic mechanisms of mycogone perniciosa causing wet bubble disease on Agaricus bisporus[D]. Changchun: Jilin agricultural university, 2014.
[5] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979: 521-522. [6] GERRITE J P G. The influence of water in the preparation of mushroom compoat and its control [J]. Mushroom Science, 1972, 8: 43−47.
[7] 黄清铧, 王松, 张扬, 等. 有害疣孢霉菌与双孢蘑菇的互作关系 [J]. 菌物学报, 2014, 33(2):440−448. HUANG Q H, WANG S, ZHANG Y, et al. The interactions between mycogone perniciosa and Agaricus bisporus [J]. Mycosystema, 2014, 33(2): 440−448.(in Chinese)
[8] 周春元, 李玉. 双孢蘑菇不同品种感染有害疣孢霉后防御酶活性变化 [J]. 菌物学报, 2015, 34(3):504−510. ZHOU C Y, LI Y. Changes of defensive enzyme activities in different Agaricus bisporus varieties after inoculation with Mycogone perniciosa [J]. Mycosystema, 2015, 34(3): 504−510.(in Chinese)
[9] 张春兰, 徐济责, 李丹, 等. 有害疣孢霉与不同食用菌的培养关系 [J]. 西北农林科技大学学报, 2017, 45(1):112−118. ZHANG C L, XU J Z, LI D, et al. Cultivating relationship between Mycogone perniciosa and edible mushrooms [J]. Journal of Northwest A&F University(Natural Science Edition), 2017, 45(1): 112−118.(in Chinese)
[10] 张春兰, 徐济责, 柿岛真, 等. 双孢蘑菇疣孢霉病的发病过程及病原菌的核相研究 [J]. 微生物学报, 2017, 57(3):422−433. ZHANG C L, XU J Z, MAKOTO K, et al. The development of Agaricus bisporus wet bubble disease and the nuclear phase of pathogen [J]. Acta Microbiologica sinica, 2017, 57(3): 422−433.(in Chinese)
[11] ZHANG L, JIANG X L, YANG X Y, et al. Inhibition of chlamydospore germination and mycelial growth of Trichoderma spp. by chemical fungicides [J]. Agricultural Science & Technology, 2015, 16(7): 1494−1499.
[12] UMAR M H, GEELS F P, VAN GRIENSVEN L J L D. Pathology and pathogenesis of Mycogone perniciosa infection of Agaricus bisporus [J]. Mushroom Science, 2000, 15: 561−567.
[13] 王玉霞, 温志强, 林秋萍, 等. 福建省主要蘑菇产区疣孢霉菌生物学特性研究 [J]. 菌物学报, 2007, 26(S1):448−454. WANG Y X, WEN Z Q, LIN Q P, et al. Studies on biological characteristices of Mycogone perniciosa from main production areas of mushroom in Fujian [J]. Mycosysterna, 2007, 26(S1): 448−454.(in Chinese)
[14] 曾宪森, 李开本, 林兴生. 蘑菇疣孢霉病发生及综合防治研究 [J]. 福建农业学报, 2001, 16(4):13−17. DOI: 10.3969/j.issn.1008-0384.2001.04.004 ZENG X S, LI K B, LIN X S. Occurrence and integrated control of the Agaricus bisporus wet bull caused by Mycogone perniciosa magn [J]. Fujian Journal of Agricultural Sciences, 2001, 16(4): 13−17.(in Chinese) DOI: 10.3969/j.issn.1008-0384.2001.04.004
[15] FLETCHER J T, JAFFE B, MUTHUMEENASKSHI S, et al. Variations in isolates of Mycogone perniciosa and in disease symptoms in Agaricus bisporus [J]. Plant Pathol, 1995, 44: 130−140. DOI: 10.1111/j.1365-3059.1995.tb02725.x
[16] MANNING K, WOOD D A. Production and regulation of extracellular endocellulase by Agaricus bisporus [J]. Journal of General Microbiology, 1983, 129: 1839−1847.
[17] GEA F J, TELLO J C, NAVARRO M J. Efficacy and effects on yield of different fungicides for control of wet bubble disease of mushroom caused by mycoparasite Mycogone perniciosa [J]. Crop Prot, 2010, 29: 1021−1025. DOI: 10.1016/j.cropro.2010.06.006
[18] DIANA M H, MARY L P, COOKE R C, et al. Germination of bicellular conidia of mycogone perniciosa, the wet bubble pathogen of the cultivated mushroom [J]. Transactions of the british mycological society, 1985, 85(4): 730−735. DOI: 10.1016/S0007-1536(85)80272-2
[19] 侯颖, 徐建强, 宋宇州, 等. 三种杀菌剂对牡丹黑斑病菌菌丝生长及分生孢子萌发的影响 [J]. 植物保护学报, 2014, 41(3):367−371. HOU Y, XU J Q, SONG Y Z, et al. Effects of carbendazim' difenoconazole and azoxystrobin on mycelial growth and conidial germination of Alternaria suffruticosae [J]. Journal of plant protection, 2014, 41(3): 367−371.(in Chinese)
[20] 任海英, 戚行江, 梁森苗, 等. 环境因子对杨梅凋萎病菌分生孢子萌发及侵染的影响 [J]. 果树学报, 2015, 32(3):474−480. REN H Y, QI X J, LIANG S M, et al. Effects of environmental factors on conidial germination and infection of Pestalotiopsis spp. causing twig blight disease of bayberry(Myrica rubra) in China [J]. Journal of Fruit Science, 2015, 32(3): 474−480.(in Chinese)
[21] URBEZ-TORRES J R, BRUEZ E, HURTADO J, et al. Effect of temperature on conidial germination of Botryosphaeriaceae species infecting grapevines [J]. Plant disease, 2010, 94(12): 1476−1484. DOI: 10.1094/PDIS-06-10-0423
[22] 董佩佩, 孙漫红, 李世东, 等. 粉红螺旋聚孢霉67-1厚垣孢子生物学特性的研究 [J]. 菌物学报, 2014, 33(6):1242−1252. DONG P P, SUN M H, LI S D, et al. Biological characteristics of chlamydospores of Clonostachys rosea 67-1 [J]. Mycosystema, 2014, 33(6): 1242−1252.(in Chinese)
[23] BEAGLE-RISTAINO J E, PAPAVIZAS G C. Survival and proliferation of Trichoderma spp. and Gliocladium virens in soil and in plant rhizospheres [J]. Phytopathology, 1985, 75(6): 729−732. DOI: 10.1094/Phyto-75-729
[24] 李卫平, 王洪凯, 林福呈. 稻曲病菌厚垣孢子的萌发特性 [J]. 浙江农业学报, 2008, 20(4):278−281. DOI: 10.3969/j.issn.1004-1524.2008.04.013 LI W P, WANG H K, LIN F C. Germination characteristics of chlamydospore of Usilaginoidea virens [J]. Acta Agriculturae Zhejiangensis, 2008, 20(4): 278−281.(in Chinese) DOI: 10.3969/j.issn.1004-1524.2008.04.013
[25] 王国良. 影响稻曲病菌厚垣孢子萌发因素的研究 [J]. 植物保护学报, 1988, 15(4):241−245. WANG G L. Studies on the factors influencing the germination of the chlamydospores of Ustilaginoides virens [J]. Journal of plant protection, 1988, 15(4): 241−245.(in Chinese)
[26] 樊荣辉, 王永强, 刘兵, 等. 稻绿核菌无性孢子形成过程及厚垣孢子萌发率测定 [J]. 菌物学报, 2010, 29(2):188−192. FAN R H, WANG Y Q, LIU B, et al. The process of asexual spore formation and examination of chlamydospore germination of Ustilaginoidea virens [J]. Mycosystema, 2010, 29(2): 188−192.(in Chinese)
[27] 邹勇. 木霉厚垣孢子的产生、萌发和保存条件研究[D]. 雅安: 四川农业大学, 2006. ZOU Y. Study on the conditions of production germination and storage of chlamydospore of Trichoderma spp.[D]. Ya’an: Sichuan agricultural university, 2006.
[28] 王松. 有害疣孢霉菌(Mycogone perniciosa Magn)对双孢蘑菇致病机制的研究[D]. 福州: 福建农林大学, 2012. WANG S. Preliminary research of the pathogenicity mechanism of Mycogone perniciosa Magn to Agaricus bisporus[D]. Fuzhou: Fujian agriculture and forestry university, 2012.
[29] VINCENT-DAVIES, STEPHEN. Relationships between Mycogone perniciosa (Magnus) and its host Agaricus bisporus (Sing.), the cultivated mushroom[D]. Bath: University of Bath, 1973.
[30] SMITH, F E V, B. SC Three diseases of cultivated mushrooms [J]. Transactions of the british mycological society, 1924(10): 81−97.
-
期刊类型引用(1)
1. 方香玲,许世洋,南志标. 尖孢镰刀菌苜蓿专化型厚垣孢子的诱导形成方法及萌发特性. 草业学报. 2024(07): 130-141 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: