Effect of Spraying Methyl Jasmonate on Oxidase Activity and Interleaf Microbial Diversity of Tobacco Leaves
-
摘要:目的 探索茉莉酸甲酯(MeJA)影响烟草抗氧化酶活性与叶际微生物多样性及其相关性。方法 设喷施0.5 mmol·L-1茉莉酸甲酯(+MeJA)和不喷施(CK)处理,在喷施72 h后分别测定烟草叶片的超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、总酚含量和过氧化氢(H2O2)积累量,烟草叶际细菌、真菌的丰富度和多样性。结果 与−MeJA相比, +MeJA显著提高了烟叶中SOD和POD的活性及H2O2的积累,显著降低叶际细菌和真菌的丰富度,极显著提高叶际真菌的多样性;SOD活性和H2O2积累量与高氏白粉菌属呈显著负相关,POD活性与青枯菌属和伯克霍尔德氏菌-卡巴拉尼亚-帕拉伯克霍尔德氏菌属呈正相关。结论 烟草喷施茉莉酸甲酯不仅能激活叶片中抗氧化酶活性,而且能改变叶际真菌优势菌属占比,烟草叶片中氧化酶活性与真菌菌属占比具有一定的相关关系。Abstract:Objective Effects of spraying methyl jasmonate (MeJA) on the antioxidant enzyme activity and interleaf microbial diversity of tobacco leaves were investigated.Method Superoxide dismutase (SOD) activity, peroxidase (POD) activity, total phenolic content, hydrogen peroxide (H2O2) accumulation as well as abundance and diversity of interleaf bacteria and fungi in tobacco leaves were measured 72 h after spraying the plant growth regulator at 0.5 mmol·L-1 (+MeJA) or without (CK) as control.Result The MeJA spray significantly increased SOD and POD activities and H2O2 accumulation but reduced the microbial abundance and increased the fungal diversity in the tobacco leaves. The SOD activity and H2O2 accumulation significantly inversely correlated with Golovinomyces, whereas POD positively correlated with Ralstonia and Burkholderia-Caballeronia-Paraburkholderia.Conclusion Tobacco leaves sprayed by MeJA not only activated the antioxidant enzyme activity but also altered the dominant fungi distribution in them, resulting in a correlation between oxidase activity and fungal genus share in tobacco leaves.
-
Keywords:
- methyl jasmonate /
- tobacco /
- phyllosphere microorganisms /
- antioxidant enzyme
-
0. 引言
【研究意义】植物与微生物互作具有促进宿主植物健康生长、营养吸收、提高抗逆性及防病原菌侵害等多种有益功能[1]。植物通过微生物解毒酶(如超氧化物歧化酶,过氧化物酶,过氧化氢酶等)抑制体内活性氧,通过促进内生菌落定殖使其选择性地募集有益微生物并帮助植物适应环境,这是植物与微生物互作的关键[1]。【前人研究进展】与植物地下部分的微生物群落相比,植物地上部的叶际由于受光照、湿度、温度、养分利用率以及昼夜温度波动等影响而拥有更具动态性的微生物群落,这些微生物群落因能进一步影响植物的生长性、抗逆性及减轻病原菌的侵害等功能而受到人们关注[2]。这其中,外源喷施茉莉酸甲酯(MeJA)通过提高SOD活性、H2O2积累[3]、POD、TP[4]等含量,抑制真菌性病害,减少农药施用量,而得到人们的青睐。植物喷施MeJA不仅通过诱导植物的抗氧化酶活性提高植株抗逆性,还对植物的病原微生物具有直接的抑制效果[5]。例如,MeJA诱导烟草对烟草炭疽病的抗性是通过提高苯丙氨酸解氨酶(PAL)活性而实现的[6],诱导猕猴桃提高SOD、POD等抗氧化酶活性可以产生软腐病抗性[7],诱导草莓对灰霉病[8]、小麦对根腐病[9]的抗性等,均说明MeJA可以诱导植物进一步提高抗病性。植物叶片中的SOD、POD、H2O2积累和总酚(TP)含量高低,是衡量植物抗病性及抗逆性的重要指标。【本研究切入点】过去的研究大多都是通过叶片喷施MeJA诱导抗性而降低植物病害,但MeJA喷施对植物叶际有害微生物丰度的影响鲜见报道,以及植物喷施MeJA后,叶片抗氧化酶活性的改变对叶际微生物菌群的影响鲜见报道。【拟解决的关键问题】本试验以模式植物烟草为材料,通过外源喷施MeJA,研究其诱导产生的抗氧化酶活性与微生物菌群之间的相关性,为进一步研究植物抗性机理提供依据。
1. 材料与方法
1.1 材料与试验设计
供试烟草为红花大金元;种植土壤购自昆明市斗南花鸟市场,每盆装入腐殖土4 kg;供试茉莉酸甲酯购自美国Sigma公司,纯度为95%,吸取114.6 μL 95%茉莉酸甲酯原液于烧杯中,加入10 mL无水乙醇溶解茉莉酸甲酯原液,待充分溶解后边搅拌边加入蒸馏水,定容至1 L,配制为0.5 mmol·L−1的浓度待用。加入10 mL无水乙醇后加蒸馏水,定容至1 L,配制为对照喷施溶液待用。
采用盆栽试验,试验设2个处理:喷施茉莉酸甲酯(MeJA)和喷施含1%乙醇的蒸馏水(CK),每个处理15个重复,共种植30盆。试验地点位于云南省昆明市盘龙区云南农业大学教学实验大棚中。每周浇灌1次营养液,培养 30 d 后喷施茉莉酸甲酯,连续喷施2 d,喷施的量以叶片不滴水珠为标准,3 d后进行取样和相关指标的测量。
1.2 烟草样品的采集
喷施茉莉酸甲酯3 d后,带无菌手套,采集倒3叶,去除叶脉,装入50 mL离心管放入液氮保存,用于酶活性测定。其余每个处理取3个生物学重复样本,约5~6 g叶片立即放入无菌样品袋中置于冰上,带回实验室, 称重样本,放入无菌管中,每克样本加入10 mL 0.1 mol·L−1磷酸钾缓冲液(pH=8.0),将样本超声洗涤1 min,涡旋10 s,此步骤重复2次,洗涤后的烟草叶片再用70%乙醇洗2次,储存在−80 ℃冰箱用于提取叶际微生物基因组DNA。
1.3 烟草叶片酶活性测定
采用索莱宝试剂盒,采用可见分光光度法测定相关抗氧化酶活性和总酚含量。
1.4 烟草叶际微生物基因组DNA的提取
采用美国MP公司FastDNA® Spin Kit for Soil 试剂盒提取,按试剂盒的试验步骤进行土壤微生物总 DNA的提取,DNA 样品于−20 ℃保存待用。
1.5 PCR扩增及Illumina高通量测序
在提取样本 DNA后,按表1中PCR扩增引物进行PCR扩增。
表 1 PCR扩增引物Table 1. PCR amplification primers微生物
Microbial引物
Primers序列
Sequence细菌
Bacteria (V3+V4)Forward AACMGGATTAGATACCCKG Reverse ACGGGCGGTGTGTRC 真菌
Fungi (ITS1+ITS2)Forward CTTGGTCATTTAGAGGAAGTAA Reverse GCTGCGTTCATCGATGC 按表2 PCR扩增反应体系扩增后,利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司完成)。
表 2 PCR扩增反应体系及条件Table 2. PCR amplification reaction system and conditions反应体系
Reaction system反应条件
Reaction conditions反应成分
Reaction
components添加量
Amount
added缓冲液5×FastPfu
Buffer 5×FastPfu4 mL 95 ℃预变性3 min
Pre-denaturation at 95 ℃
for 3 min
↓
27个循环(95 ℃变性30 s,
55 ℃退火30 s,72 ℃延伸30 s)
27 cycles (denaturation at 95 ℃ for
30 s, annealing at 55 ℃ for
30 s, extension at 72 ℃ for 30 s)
↓
72 ℃稳定延伸10 min
Stable extension at
72 ℃ for 10 min
↓
4 ℃保存
storage at 4 ℃上下游引物
Upstream and
downstream primers0.8 mL 脱氧核糖核苷三磷酸
dNTPs(2.5 mmol·L−1)2 mL 快速-pfu 聚合酶
Fast-Pfu Polymerase0.4 mL DNA模板
DNA template10 ng 双蒸水
ddH2O至20 mL
Up to 20 mL1.6 数据处理与分析
试验结果用平均数±标准误表示,应用SPSS 26.0软件进行方差分析,利用单因素方差(One-way ANOVA)分析法,使用Duncan多重比较法进行差异显著分析,使用Origin作图分析。
通过对原始数据的筛选、质控、去接头拼接,得到最优的序列,并根据相似度97%的 OTU进行聚类,得到 OTU丰度表,供以后的分析使用。根据序列97%的相似度,将序列归并并划分为多个 OUTs。利用 Mothur计算丰富度指数ACE以及多样性指数Shannon,并进行Alpha多样性分析;同时进行细菌群落分布、聚类分析和细菌功能预测分析。
2. 结果与分析
2.1 茉莉酸甲酯对烟草抗氧化酶活性和总酚含量的影响
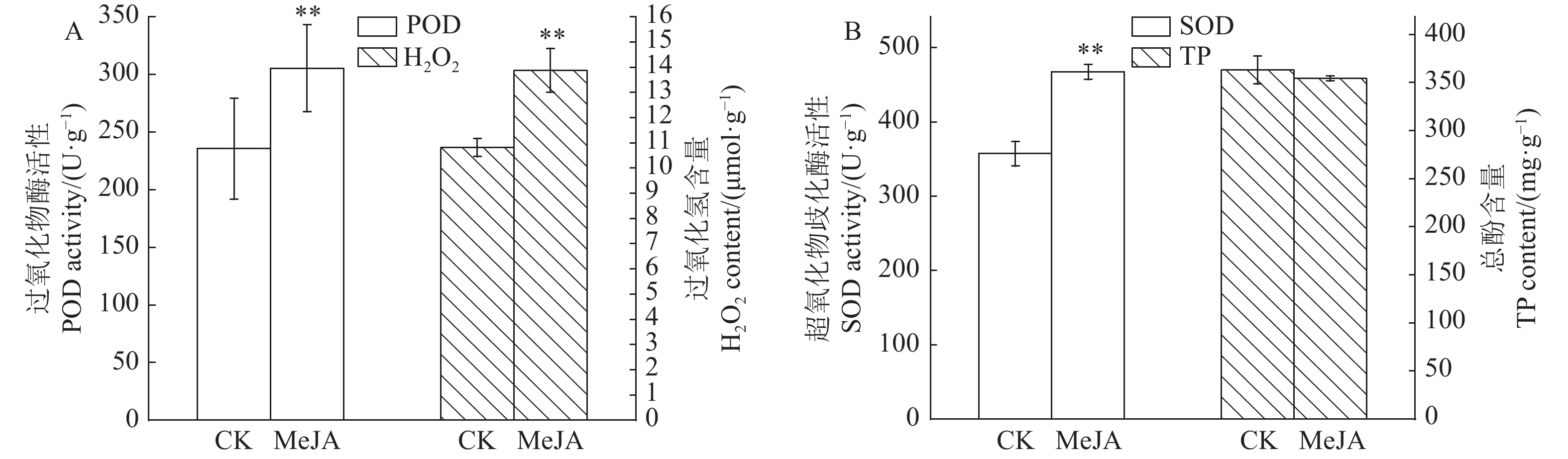
抗氧化酶活性提高和活性氧的产生是植物抗病早期的反应之一。由图1可知,与未喷施茉莉酸甲酯相比,喷施茉莉酸甲酯能极显著增加烟草叶片中的POD、H2O2和SOD活性(P<0.01);TP含量无显著差异(P>0.05)。由此可知,喷施茉莉酸甲酯可以诱导植物产生抗性。
![]() 图 1 茉莉酸甲酯对烟草抗氧化酶活性和总酚含量的影响POD和SOD活性、H2O2含量测定鲜样,TP含量测定干样;图中*表示P<0.05,**表示P<0.01;CK—未喷施茉莉酸甲酯,MeJA—喷施茉莉酸甲酯,图2同;A:茉莉酸甲酯处理后烟草叶片中过氧化物酶活性和过氧化氢含量的变化;B:茉莉酸甲酯处理后烟草叶片中超氧化物歧化酶活性和总酚含量的变化。Figure 1. Effect of methyl jasmonate on antioxidant enzyme activity and total phenol content in tobaccoPOD and SOD activities and H2O2 content were measured in fresh samples, and TP content in dry samples. * indicates P<0.05, ** indicates P<0.01. CK: no spraying, MeJA:spraying with MeJA; Same for Fig.2. Changes in POD activity and H2O2 content in tobacco leaves by spraying (A); changes in SOD activity and TP content in tobacco leaves by spraying (B).
图 1 茉莉酸甲酯对烟草抗氧化酶活性和总酚含量的影响POD和SOD活性、H2O2含量测定鲜样,TP含量测定干样;图中*表示P<0.05,**表示P<0.01;CK—未喷施茉莉酸甲酯,MeJA—喷施茉莉酸甲酯,图2同;A:茉莉酸甲酯处理后烟草叶片中过氧化物酶活性和过氧化氢含量的变化;B:茉莉酸甲酯处理后烟草叶片中超氧化物歧化酶活性和总酚含量的变化。Figure 1. Effect of methyl jasmonate on antioxidant enzyme activity and total phenol content in tobaccoPOD and SOD activities and H2O2 content were measured in fresh samples, and TP content in dry samples. * indicates P<0.05, ** indicates P<0.01. CK: no spraying, MeJA:spraying with MeJA; Same for Fig.2. Changes in POD activity and H2O2 content in tobacco leaves by spraying (A); changes in SOD activity and TP content in tobacco leaves by spraying (B).2.2 茉莉酸甲酯对烟草叶际微生物群落丰富度和多样性变化的影响
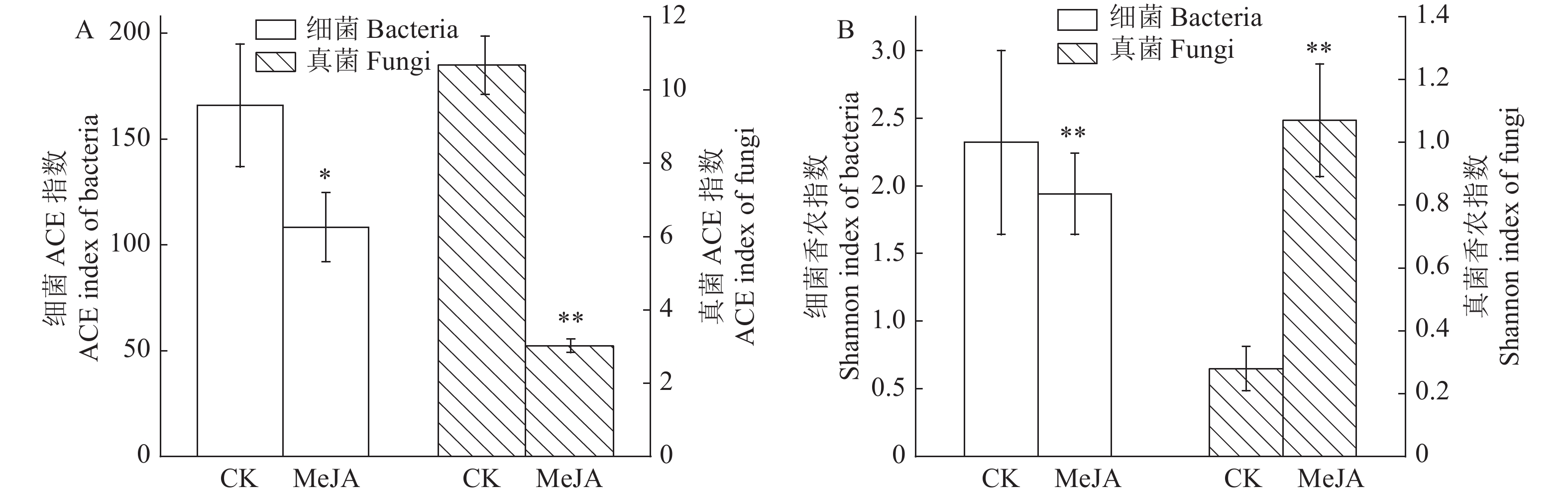
利用Alpha多样性分析微生物群落的丰富度和多样性。ACE指数可反映群落物种丰富度,由图2-A可知,喷施茉莉酸甲酯显著降低烟草叶际微生物细菌的丰富度(P<0.05),极显著降低烟草叶际微生物真菌的丰富度(P<0.01)。Shannon指数可反映群落物种多样性,由图2-B可知,喷施茉莉酸甲酯极显著降低烟草叶际微生物细菌的多样性(P<0.01),极显著提高烟草叶际微生物真菌的多样性(P<0.01)。由此可知,喷施茉莉酸甲酯可降低烟草叶际细菌群落的丰富度和多样性;提高烟草叶际真菌群落的丰富度和多样性。
![]() 图 2 茉莉酸甲酯对烟草叶际微生物群落丰富度和多样性变化的影响A:茉莉酸甲酯处理后烟草叶际微生物ACE指数的变化;B:茉莉酸甲酯处理后烟草叶际微生物Shannon指数的变化。Figure 2. Effects of methyl jasmonate on the richness and diversity of tobacco phyllosphere microbial communityChanges on leaf microbial ACE index of tobacco leaf after spraying (A); changes of microbial Shannon index of tobacco leaf after spraying (B) .
图 2 茉莉酸甲酯对烟草叶际微生物群落丰富度和多样性变化的影响A:茉莉酸甲酯处理后烟草叶际微生物ACE指数的变化;B:茉莉酸甲酯处理后烟草叶际微生物Shannon指数的变化。Figure 2. Effects of methyl jasmonate on the richness and diversity of tobacco phyllosphere microbial communityChanges on leaf microbial ACE index of tobacco leaf after spraying (A); changes of microbial Shannon index of tobacco leaf after spraying (B) .2.3 茉莉酸甲酯对烟草叶际微生物群落分类学组成的影响
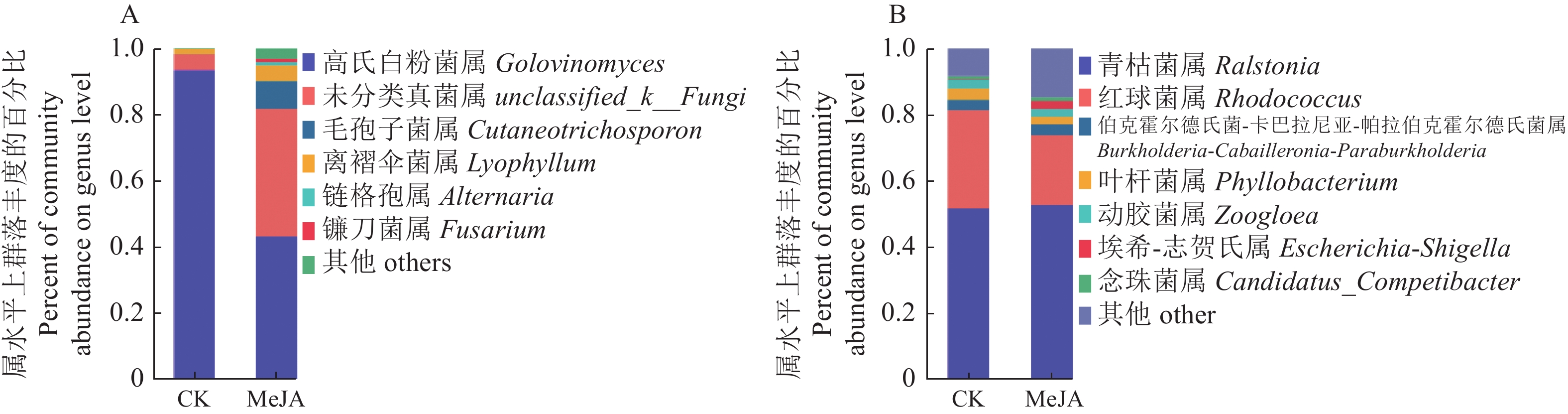
图3展示了烟草叶际细菌、真菌在优势菌属(丰度>1%)分类学水平的物种分布柱状图。如图3-A所示,喷施茉莉酸甲酯烟草叶际优势真菌菌属Golovinomyces(高氏白粉菌属,43.26%)、unclassified_k__Fungi(未分类真菌属,38.38%)、Cutaneotrichosporon(毛孢子菌属,8.38%)、Lyophyllum(离褶伞菌属,4.82%)、Alternaria(链格孢属,1.11%)和Fusarium(镰刀菌属1.03%);未喷施茉莉酸甲酯烟草叶际优势真菌菌属Golovinomyces(高氏白粉菌属,93.40%)、unclassified_k__Fungi(未分类真菌属,4.81%)、Cutaneotrichosporon(毛孢子菌属,0.11%)、Lyophyllum(离褶伞菌属,1.41%)。其中喷施茉莉酸甲酯显著降低烟草叶际上的高氏白粉菌属,而显著增加了烟草叶际上的未分类真菌属,未喷施茉莉酸甲酯的烟草叶际上链格孢属和镰刀菌属的丰度低于0.01未展示出。说明在属水平上叶际真菌群落结构是不稳定的,喷施茉莉酸甲酯会影响烟草叶际真菌群落组成。
如图3B所示,烟草叶际细菌菌属主要集中在Ralstonia(青枯菌属,51.64%~52.84%)、Rhodococcus(红球菌属,20.81%~29.73%)、Burkholderia-Caballeronia-Paraburkholderia(伯克霍尔德氏菌-卡巴拉尼亚-帕拉伯克霍尔德氏菌属,3.08%~3.41%)、Phyllobacterium(叶杆菌属,2.29%~3.61%)、Zoogloea(动胶菌属,2.36%~2.49%)、Escherichia-Shigella(埃希-志贺氏属,0.43%~2.30%)和Candidatus_Competibacter(念珠菌属,0.89%~1.16%);其中,青枯菌属和红球菌属为烟草叶际细菌优势菌种。说明在属水平上叶际细菌群落结构是趋于稳定的,喷施茉莉酸甲酯对烟草叶际细菌群落组成的影响较小。
2.4 样本间主成分分析
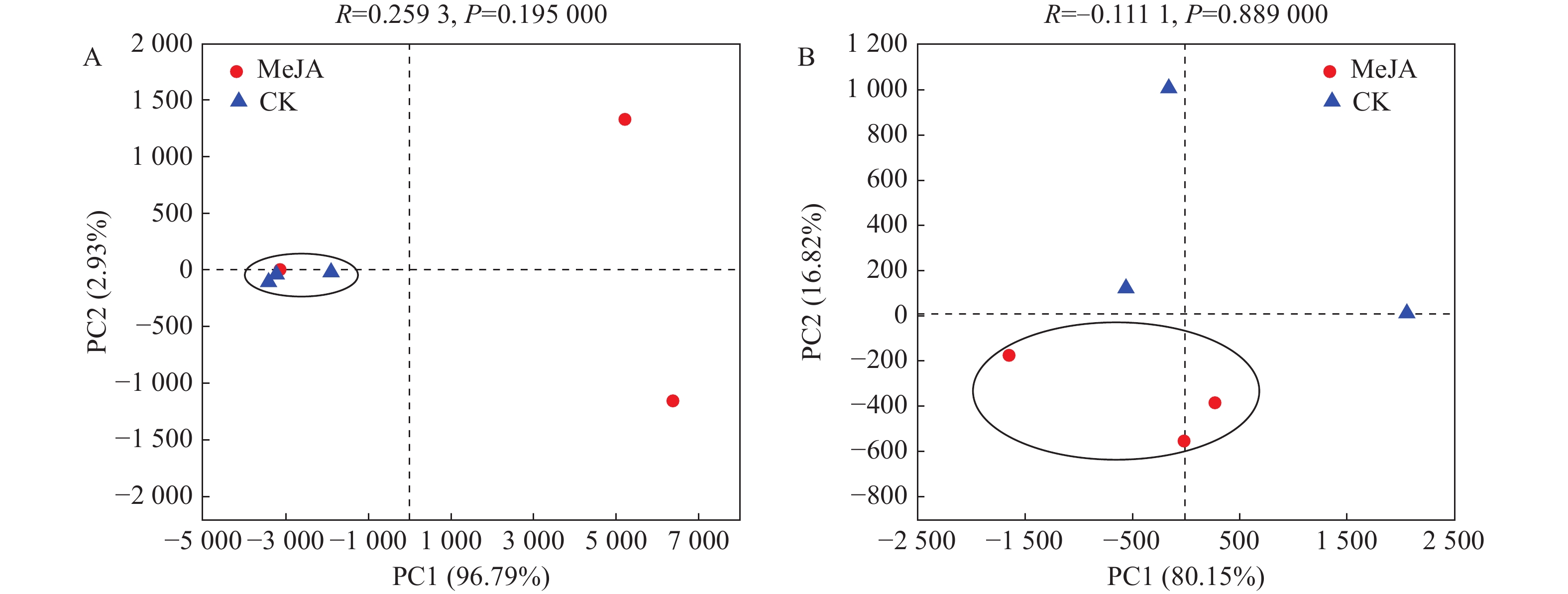
主成分分析(principal component analysis,PCA)可反映样品间的差异和距离,样品组成越相似,则反映在PCA图中的距离越近。由图4可以看出,真菌群落的PC1轴和PC2轴的主要贡献之和为99.72%,细菌群落的PC1轴和PC2轴的主要贡献之和为96.97%;由图可知,喷施茉莉酸甲酯后,样品间真菌群落差异较大;而细菌群落细菌群落结构相似。
2.5 属水平的优势菌群与氧化酶活性相关性分析结果
为了解抗氧化酶活性与叶际微生物群落的关系,对叶际中的优势菌群(属水平)和烟草氧化酶活性进行相关分析(表3)。结果表明,高氏白粉菌属与SOD和H2O2活性显著负相关(P<0.05);青枯菌属与POD活性显著正相关(P<0.05);伯克霍尔德氏菌-卡巴拉尼亚-帕拉伯克霍尔德氏菌属与POD活性极显著正相关(P<0.01)。而其他菌属与氧化酶活性的相关性均不显著(P>0.05)。
表 3 不同处理氧化酶活性与属水平的优势菌群丰度Pearson相关性分析Table 3. Pearson correlation analysis on oxidase activity and abundance of dominant flora at genus level under varied treatments属
Genus超氧化物歧化酶
SOD过氧化物酶
POD过氧化氢
H2O2总酚
TP高氏白粉菌属 Golovinomyces −0.734* 0.037 −0.435* −0.426 未分类真菌属 unclassified_k__Fungi 0.237 −0.702 0.534 0.232 毛孢子菌属 Cutaneotrichosporon −0.601 −0.357 0.979 0.116 青枯菌属 Ralstonia −0.535 0.867* −0.406 0.148 红球菌属 Rhodococcus 0.377 −0.793 0.478 0.472 叶杆菌属 Phyllobacterium 0.557 −0.271 −0.111 0.620 伯克霍尔德氏菌-卡巴拉尼亚-帕拉伯克霍尔德氏菌属
Burkholderia-Caballeronia-Paraburkholderia−0.990 0.963** −0.600 −0.184 *表示在P<0.05水平上显著相关;**表示在P<0.01水平上显著相关。
* Indicates significant correlation at P< 0.05 level; ** indicates significant correlation at P< 0.01 level.3. 讨论与结论
在植物的生长过程中,植物的健康状况和抗病能力与防御酶活性密切相关[10]。茉莉酸甲酯在植物的生长发育和植物应激防御反应中发挥重要作用,外源喷施MeJA可作为重要逆境胁迫信号物质,诱导植物产生一系列免疫响应,如激发植物抗逆蛋白和相关防御基因的表达[11]。以往的研究表明,茉莉酸甲酯可提高植物超氧化物歧化酶(SOD)、过氧化物酶(POD)活性和过氧化氢(H2O2)、植物总酚(TP)积累[12, 13],增强植物的抗逆性,从而有效抵御病原菌的侵入。在本研究中,喷施茉莉酸甲酯极显著提高烟草叶片中超氧化物歧化酶活性、过氧化物酶活性和过氧化氢的积累。结果表明,喷施茉莉酸甲酯可以提高植物的防御酶活性,诱导植物启动抗性,增强植物对环境胁迫的耐受性,也会诱导植物对病原微生物产生抗性,同时植物内环境的变化也会影响植物的生长发育,改变植物叶际或内生优势菌群[14]。
关于植物与微生物关系的建立,前人使用了共生关系来描述,两者之间是一种长期的生态相互作用,可以从互惠到寄生[15]。微生物群落与作物生长发育的关系是微生物生态学和作物病害防治研究的重要课题[1]。植物的健康状况与植物叶际微生物群落多样性有关[16]。定殖在叶片的微生物可以改善生态系统(如有毒污染物的植物修复[17]和对植物生长有利的重要元素循环[18])或有助于植物降低病原体的侵染[19],这些微生物被认为是植物益生菌[20]。在以往关于植物益生菌的研究中,前人通过施用生物菌肥从而降低病原体感染植物,提高叶际微生物群落的丰富度和多样性,降低植物的病害指数,促进植物生长。本结果表明,与未喷施茉莉酸甲酯的烟草相比,喷施茉莉酸甲酯的烟草叶际细菌丰富度和多样性显著降低,叶际真菌丰富度显著降低,但多样性极显著升高;且微生物群落组成表明,喷施茉莉酸甲酯后烟草叶片的高氏白粉菌属显著降低,可降低烟草白粉病的发病情况。同时,喷施茉莉酸甲酯主要是影响烟草叶际的真菌群落组成,在减少高氏白粉菌属的同时,增加了另外2种有害真菌属,可能是由于植物叶际对微生物生长的可用资源有限[21, 22],所以在降低白粉菌属后其他劣势菌属得以生长,且可能茉莉酸甲酯对链格孢属和镰刀菌属无抑制作用。主成分分析也表明茉莉酸甲酯对真菌群落的组成影响较大,对细菌群落组成影响极小,细菌群落相对稳定。叶际优势菌属与抗氧化酶活性相关性分析表明,高氏白粉菌属与超氧化物歧化酶活性和过氧化氢积累呈显著负相关关系,青枯菌与超氧化物歧化酶活性呈显著正相关系,但抗氧化酶活性与微生物群落之间的相互影响机制尚不清楚,亟待进一步研究。
茉莉酸甲酯可以提高植物抗氧化酶活性,诱导植物防御启动;减少植物叶际的有害微生物,促进植物的生长发育。未来的研究还可以将茉莉酸甲酯作为一种重要的植物抗病诱导剂,诱导不同植物对细菌、真菌、卵菌和病毒等其他植物病原体,对其诱导的潜在作用和相关机制进行深入探究。这种研究将有助于我们理解诱导植物抗病性的机制及其在农业中的应用,以增强植物抵抗各种病原体的感染。
-
图 1 茉莉酸甲酯对烟草抗氧化酶活性和总酚含量的影响
POD和SOD活性、H2O2含量测定鲜样,TP含量测定干样;图中*表示P<0.05,**表示P<0.01;CK—未喷施茉莉酸甲酯,MeJA—喷施茉莉酸甲酯,图2同;A:茉莉酸甲酯处理后烟草叶片中过氧化物酶活性和过氧化氢含量的变化;B:茉莉酸甲酯处理后烟草叶片中超氧化物歧化酶活性和总酚含量的变化。
Figure 1. Effect of methyl jasmonate on antioxidant enzyme activity and total phenol content in tobacco
POD and SOD activities and H2O2 content were measured in fresh samples, and TP content in dry samples. * indicates P<0.05, ** indicates P<0.01. CK: no spraying, MeJA:spraying with MeJA; Same for Fig.2. Changes in POD activity and H2O2 content in tobacco leaves by spraying (A); changes in SOD activity and TP content in tobacco leaves by spraying (B).
图 2 茉莉酸甲酯对烟草叶际微生物群落丰富度和多样性变化的影响
A:茉莉酸甲酯处理后烟草叶际微生物ACE指数的变化;B:茉莉酸甲酯处理后烟草叶际微生物Shannon指数的变化。
Figure 2. Effects of methyl jasmonate on the richness and diversity of tobacco phyllosphere microbial community
Changes on leaf microbial ACE index of tobacco leaf after spraying (A); changes of microbial Shannon index of tobacco leaf after spraying (B) .
表 1 PCR扩增引物
Table 1 PCR amplification primers
微生物
Microbial引物
Primers序列
Sequence细菌
Bacteria (V3+V4)Forward AACMGGATTAGATACCCKG Reverse ACGGGCGGTGTGTRC 真菌
Fungi (ITS1+ITS2)Forward CTTGGTCATTTAGAGGAAGTAA Reverse GCTGCGTTCATCGATGC 表 2 PCR扩增反应体系及条件
Table 2 PCR amplification reaction system and conditions
反应体系
Reaction system反应条件
Reaction conditions反应成分
Reaction
components添加量
Amount
added缓冲液5×FastPfu
Buffer 5×FastPfu4 mL 95 ℃预变性3 min
Pre-denaturation at 95 ℃
for 3 min
↓
27个循环(95 ℃变性30 s,
55 ℃退火30 s,72 ℃延伸30 s)
27 cycles (denaturation at 95 ℃ for
30 s, annealing at 55 ℃ for
30 s, extension at 72 ℃ for 30 s)
↓
72 ℃稳定延伸10 min
Stable extension at
72 ℃ for 10 min
↓
4 ℃保存
storage at 4 ℃上下游引物
Upstream and
downstream primers0.8 mL 脱氧核糖核苷三磷酸
dNTPs(2.5 mmol·L−1)2 mL 快速-pfu 聚合酶
Fast-Pfu Polymerase0.4 mL DNA模板
DNA template10 ng 双蒸水
ddH2O至20 mL
Up to 20 mL表 3 不同处理氧化酶活性与属水平的优势菌群丰度Pearson相关性分析
Table 3 Pearson correlation analysis on oxidase activity and abundance of dominant flora at genus level under varied treatments
属
Genus超氧化物歧化酶
SOD过氧化物酶
POD过氧化氢
H2O2总酚
TP高氏白粉菌属 Golovinomyces −0.734* 0.037 −0.435* −0.426 未分类真菌属 unclassified_k__Fungi 0.237 −0.702 0.534 0.232 毛孢子菌属 Cutaneotrichosporon −0.601 −0.357 0.979 0.116 青枯菌属 Ralstonia −0.535 0.867* −0.406 0.148 红球菌属 Rhodococcus 0.377 −0.793 0.478 0.472 叶杆菌属 Phyllobacterium 0.557 −0.271 −0.111 0.620 伯克霍尔德氏菌-卡巴拉尼亚-帕拉伯克霍尔德氏菌属
Burkholderia-Caballeronia-Paraburkholderia−0.990 0.963** −0.600 −0.184 *表示在P<0.05水平上显著相关;**表示在P<0.01水平上显著相关。
* Indicates significant correlation at P< 0.05 level; ** indicates significant correlation at P< 0.01 level. -
[1] TRIVEDI P, LEACH J E, TRINGE S G, et al. Plant-microbiome interactions: From community assembly to plant health [J]. Nature Reviews Microbiology, 2020, 18(11): 607−621. DOI: 10.1038/s41579-020-0412-1
[2] LAJOIE G, KEMBEL S W. Host neighborhood shapes bacterial community assembly and specialization on tree species across a latitudinal gradient [J]. Ecological Monographs, 2021, 91(2): 668−672.
[3] GUPTA R, ELKABETZ D, LEIBMAN-MARKUS M, et al. Cytokinin drives assembly of the phyllosphere microbiome and promotes disease resistance through structural and chemical cues [J]. The ISME Journal, 2022, 16(1): 122−137. DOI: 10.1038/s41396-021-01060-3
[4] WANG H B, KOU X H, WU C E, et al. Methyl jasmonate induces the resistance of postharvest blueberry to gray mold caused by Botrytis cinerea [J]. Journal of the Science of Food and Agriculture, 2020, 100(11): 4272−4281. DOI: 10.1002/jsfa.10469
[5] KĘPCZYŃSKA E, KRÓL P. The phytohormone methyl jasmonate as an activator of induced resistance against the necrotrophAlternaria porrif. sp. solani in tomato plants [J]. Journal of Plant Interactions, 2012, 7(4): 307−315. DOI: 10.1080/17429145.2011.645169
[6] 宾金华, 姜胜, 黄胜琴, 等. 茉莉酸甲酯诱导烟草幼苗抗炭疽病与PAL活性及细胞壁物质的关系 [J]. 植物生理学报, 2000, 26(1):1−6. DOI: 10.3321/j.issn:1671-3877.2000.01.001 BIN J H, JIANG S, HUANG S Q, et al. The relationship between methyl jasmonate induced anthracnose resistance of tobacco seedlings and phenylalanine ammonia lyase activity and cell wall substances [J]. Acta Photophysiologica Sinica, 2000, 26(1): 1−6.(in Chinese) DOI: 10.3321/j.issn:1671-3877.2000.01.001
[7] 盘柳依, 赵显阳, 陈明, 等. 茉莉酸甲酯调控防御酶活性诱导猕猴桃果实抗采后软腐病 [J]. 植物保护, 2019, 45(1):75−80. PAN L Y, ZHAO X Y, CHEN M, et al. Regulation of defense enzymes by methyl jasmonate to induce the resistance of kiwifruits against soft rot [J]. Plant Protection, 2019, 45(1): 75−80.(in Chinese)
[8] SAAVEDRA G M, SANFUENTES E, FIGUEROA P M, et al. Independent preharvest applications of methyl jasmonate and chitosan elicit differential upregulation of defense-related genes with reduced incidence of gray mold decay during postharvest storage of Fragaria chiloensis fruit [J]. International Journal of Molecular Sciences, 2017, 18(7): 1420. DOI: 10.3390/ijms18071420
[9] MOTALLEBI P, NIKNAM V, EBRAHIMZADEH H, et al. Exogenous methyl jasmonate treatment induces defense response against Fusarium culmorum in wheat seedlings [J]. Journal of Plant Growth Regulation, 2017, 36(1): 71−82. DOI: 10.1007/s00344-016-9620-3
[10] ALI N D, SORKHOH N, SALAMAH S, et al. The potential of epiphytic hydrocarbon-utilizing bacteria on legume leaves for attenuation of atmospheric hydrocarbon pollutants [J]. Journal of Environmental Management, 2012, 93(1): 113−120.
[11] YU X X, ZHANG W J, ZHANG Y, et al. The roles of methyl jasmonate to stress in plants [J]. Functional Plant Biology:FPB, 2019, 46(3): 197−212. DOI: 10.1071/FP18106
[12] 吴莹莹, 吴碧球, 陈燕, 等. 茉莉酸甲酯诱导水稻对褐飞虱抗性与植株总酚含量的关系研究 [J]. 西南农业学报, 2012, 25(2):462−466. DOI: 10.3969/j.issn.1001-4829.2012.02.022 WU Y Y, WU B Q, CHEN Y, et al. Relations between resistance of rice induced by methyl jasmonate, brown plant hopper(Nilaparvata lugens) and total phenol content [J]. Southwest China Journal of Agricultural Sciences, 2012, 25(2): 462−466.(in Chinese) DOI: 10.3969/j.issn.1001-4829.2012.02.022
[13] 赵显阳, 盘柳依, 陈明, 等. 茉莉酸甲酯对辣椒抗青枯病的诱导效应及抗氧化酶活性的影响 [J]. 植物保护学报, 2018, 45(5):1103−1111. ZHAO X Y, PAN L Y, CHEN M, et al. Inductive effect of methyl jasmonate to bacterial wilt and the effects on the activities of antioxidant enzymes in pepper seedlings [J]. Journal of Plant Protection, 2018, 45(5): 1103−1111.(in Chinese)
[14] ROMAN-REYNA V, PINILI D, BORJA F N, et al. The rice leaf microbiome has a conserved community structure controlled by complex host-microbe interactions[J]. bioRxiv, 2019, DOI:10.1101/615278.
[15] HAN G Z. Origin and evolution of the plant immune system [J]. The New Phytologist, 2019, 222(1): 70−83. DOI: 10.1111/nph.15596
[16] BABALOLA O O. Beneficial bacteria of agricultural importance [J]. Biotechnology Letters, 2010, 32(11): 1559−1570. DOI: 10.1007/s10529-010-0347-0
[17] PAWLIK M, PIOTROWSKA-SEGET Z. Endophytic bacteria associated with Hieracium piloselloides: Their potential for hydrocarbon-utilizing and plant growth-promotion [J]. Journal of Toxicology and Environmental Health Part A, 2015, 78(13/14): 860−870.
[18] FÜRNKRANZ M, WANEK W, RICHTER A, et al. Nitrogen fixation by phyllosphere bacteria associated with higher plants and their colonizing epiphytes of a tropical lowland rainforest of Costa Rica [J]. The ISME Journal, 2008, 2(5): 561−570. DOI: 10.1038/ismej.2008.14
[19] LINDOW S E, BRANDL M T. Microbiology of the phyllosphere [J]. Applied and Environmental Microbiology, 2003, 69(4): 1875−1883. DOI: 10.1128/AEM.69.4.1875-1883.2003
[20] BERLEC A. Novel techniques and findings in the study of plant microbiota: Search for plant probiotics [J]. Plant Science, 2012, 193/194: 96−102. DOI: 10.1016/j.plantsci.2012.05.010
[21] VAN ELSAS J D, CHIURAZZI M, MALLON C A, et al. Microbial diversity determines the invasion of soil by a bacterial pathogen [J]. PNAS, 2012, 109(4): 1159−1164. DOI: 10.1073/pnas.1109326109
[22] MOTALLEBI P, NIKNAM V, EBRAHIMZADEH H, et al. Methyl jasmonate strengthens wheat plants against root and crown rot pathogen Fusarium culmorum infection [J]. Journal of Plant Growth Regulation, 2015, 34(3): 624−636. DOI: 10.1007/s00344-015-9496-7
-
期刊类型引用(1)
1. 张振远,滕环瑜,潘影,王召军,张洪映,闫筱筱,崔红. 不同浓度吐温-80对烟草叶面微生物洗脱效果的影响. 烟草科技. 2023(12): 7-13 .  百度学术
百度学术
其他类型引用(4)




 下载:
下载: